經鼻蝶竇垂體瘤切除術對合并心肌病患者血清生長激素水平及心臟結構功能的影響分析*
顧俊怡,李向東,王 中,虞正權,周幽心,陳 罡,陳宇超,劉玉釗
(蘇州大學附屬第一醫院神經外科,蘇州 215000)
論著·臨床研究
經鼻蝶竇垂體瘤切除術對合并心肌病患者血清生長激素水平及心臟結構功能的影響分析*
顧俊怡,李向東,王 中,虞正權,周幽心,陳 罡,陳宇超,劉玉釗
(蘇州大學附屬第一醫院神經外科,蘇州 215000)
目的研究生長激素型垂體瘤合并心肌病患者外科手術治療及臨床療效。方法選取該院2012年6月至2016年6月收治的65例生長激素型垂體腺瘤伴心肌病患者,所有患者均采取經鼻鼻蝶竇手術入路切除垂體瘤,觀察術后2周血清生長激素水平、心電圖結果、超聲心電圖結果及臨床癥狀。結果術后患者體征均有明顯改善,肢端肥大及鼻唇肥厚明顯改善,頭暈乏力、高血壓及高血糖等均得到顯著改善;術后平均生長激素水平為(4.37±2.03)μg/L,顯著低于術前的(40.27±4.18)μg/L,差異有統計學意義(P<0.01);患者術后的室間隔厚度(IVST)、左室舒張末期內徑(LVIDd)和左室后壁厚度(LVPWT)均顯著低于術前,差異有統計學意義(P<0.01);患者術后的平均二尖瓣血流頻譜(E/A)和左室射血分數(LVEF)明顯低于術前,差異有統計學意義(P<0.01)。結論經鼻蝶竇垂體瘤切除術能降低患者生長激素水平,改善心臟功能。
垂體腫瘤;心肌增厚;生長激素;垂體,瘤切除術
生長激素型垂體瘤占垂體瘤的71%,其發病機制為生長激素分泌過多引起內分泌失調,從而進一步發展為骨骼、軟組織及內臟的增生肥大,多發生于青春期后[1]。生長激素型的腺瘤患者常伴隨心臟疾病,為生長激素分泌過多而導致心肌肥厚,引起心律失常及心功能衰退,對患者的身體健康及生活質量造成極大困擾,嚴重者可導致死亡。經鼻蝶竇入路顯微鏡下垂體瘤切除術和經鼻蝶竇入路神經內鏡下垂體瘤切除術是目前常用的手術方法。單側經鼻蝶竇入路垂體瘤切除術具有手術時間短、創傷小、術中失血量少、患者恢復快等優點[2],回顧性總結生長激素性垂體瘤伴心肌病臨床病例,得出臨床診療經驗,為提高診治水平提供一定幫助,現報道如下。
1 資料與方法
1.1一般資料 選取本院2012年6月至2016年6月收治的65例生長激素型垂體瘤伴心肌病患者,其中男39例,女26例,年齡25~63歲,平均(44.26±4.64)歲。術前均有不同程度的面容改變及肢端肥大。超聲檢查可見所有患者均存在不同程度的左心室肥大、心室擴張。其中30例伴頭痛,以額頂部或者枕部為主;17例伴視野受損;39例伴心電圖異常,8例左室高壓,16例左室肥大勞損,13例伴不同類型傳導阻滯;8例伴高血糖;21例伴頭暈乏力,15例存在心力衰竭,術前22例存在高血壓。所有患者中生長激素水平5~10 μg/L 5例,<10~30 μg/L 26例,>30 μg/L 34例,生長激素平均為(40.27±4.18)μg/L。頭顱MRI影像檢查,10例腫瘤直徑大于30 mm,10例腫瘤直徑20~<30 mm,34例腫瘤直徑<10~20 mm,11例腫瘤直徑小于或等于10 mm。
1.2納入與排除標準 納入標準:(1)生長激素水平大于10 μg/L,口服葡萄糖抑制劑試驗顯示激素水平大于2.5 μg/L[3],或者生長激素水平在5~10 μg/L,進行葡萄糖抑制試驗,生長激素水平不受抑制;(2)術后病理結果顯示為生長激素型垂體腺瘤;(3)伴高血壓及心律不齊;(4)伴左心室高電壓、左心室肥大勞損、T波異常及不同類型傳導阻滯[4]。排除標準:(1)心臟手術史;(2)生長抑素類藥物服用史;(3)合并先天性心臟病。
1.3方法 65例患者均進行顯微鏡下經鼻蝶竇手術入路切除垂體瘤。術后結合血清生長激素水平和腫瘤切除程度給予對應的生長抑素奧曲肽[5]。對于高血壓患者給予β受體阻滯劑和鈣通道阻滯劑進行血壓控制;對于高血糖患者給予低糖低脂飲食,并使用胰島素調節血糖水平;心力衰竭患者給予強心藥物、利尿劑及血管緊張素,并控制攝水量。患者均在術后2周進行療效評估,內容包含血清生長激素水平檢測、心電圖檢測、超聲心電圖檢測及臨床癥狀改善情況。
2 結 果
2.1臨床癥狀改善情況 術后患者體征均有明顯改善,肢端肥大及鼻唇肥厚等現象均有好轉。頭暈乏力及視野缺損等癥狀也明顯好轉。13例高血壓患者術后血壓顯著低于術前,9例高血壓患者術后血壓略低于術前,在無口服降壓藥的情況下通過飲食及運動控制血壓。8例高血糖患者術后血糖顯著低于術前,降至正常水平。5例心力衰竭患者癥狀明顯改善,剩余10例心力衰竭患者無明顯改善;21例頭暈乏力中13例癥狀完全消失。39例心電圖異常患者均得到不同程度的改善。
2.2內分泌檢測結果 術后2周對所有患者進行內分泌檢測,39例生長激素水平小于5 μg/L,17例生長激素水平5~15 μg/L,9例大于15 μg/L。平均生長激素水平為(4.37±2.03)μg/L,較術前的(40.27±4.18)μg/L顯著下降(P<0.01)。術后MRI顯示腫瘤殘留及生長激素水平大于5 μg/L患者均給予生長抑素奧曲肽進行治療。
2.3影像學及病例學檢查 根據MRI顯示腫瘤全切除共38例,占總手術患者58.46%,次切除患者17例,占26.15%,大部分切除10例,占15.39%。47例腫瘤質地軟綿,18例腫瘤質地堅韌,所有病例中有13例伴囊性病變。術前術后典型MRI資料見圖1。腫瘤組織免疫學染色測試:43例純生長激素腺瘤,22例合并泌乳素腺瘤,檢測結果顯示促甲狀腺激素、促腎上皮激素及促黃體生長素及促卵泡生成素染色均為陰性。
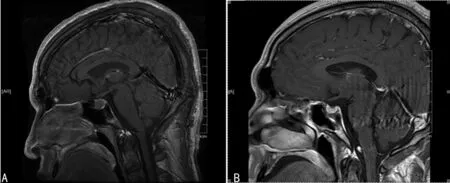
A:術前腫瘤位于鞍內,呈圓形,將正常垂體擠壓至后方;B:術后MRI示腫瘤切除,鞍隔塌陷。
圖1生長激素性型垂體瘤經鼻蝶竇手術切除前、后MRI影像改變
2.4超聲心動圖檢測 所有患者術前術后均給予超聲心動圖檢測。包括左室后壁厚度(left ventricular posterior wall thickness,LVPWT),室間隔厚度(interventricular septal thickness,IVST),左室舒張末期內徑(left ventricular diastolic diameter,LVIDd),二尖瓣血流頻譜(E/A)比值,左室射血分數(left ventricular ejection fraction,LVEF)。患者術后的IVST為(9.89±1.40)mm,明顯低于術前的(15.65±1.43)mm,差異有統計學意義(t=10.873,P<0.01);患者術后的LVIDd為(51.22±3.71)mm,明顯低于術前的(60.05±5.28)mm,差異有統計學意義(t=5.107,P<0.01);患者術后的LVPWT為(8.63±0.78)mm,明顯低于術前的(12.07±0.66)mm,差異有統計學意義(t=12.782,P<0.01);患者術后的平均E/A為1.58±0.42,明顯高于術前的1.40±0.31,差異有統計學意義(t=2.015,P=0.047);患者術后的LVEF為(54.27±7.20)%,明顯高于術前的(49.25±6.09)%,差異有統計學意義(t=2.725,P=0.013),見表1。術后心功能及心臟結構顯著優于術前,見圖2。
表1 65例生長激素型垂體瘤合并心肌患者手術前、后心臟結構及功能參數
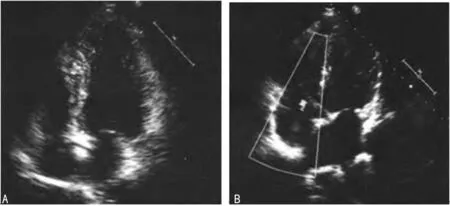
A:術前心臟結構明顯增生肥厚;B:術后心臟結構增生肥厚顯著改善。
圖2生長激素型垂體瘤合并心肌病患者超聲心動圖
3 討 論
生長激素長期分泌可導致慢性心肌疾病,其發病過程長,起病不明顯,超過60%的生長激素型垂體瘤患者均伴隨心肌疾病,而心肌肥大增厚程度與生長激素水平及病程有著極大聯系,病程轉入后期可出現心律失常及心功能不全,是造成患者死亡的主要因素之一[6]。美國心臟協會在2006年將生長激素型腺瘤心肌病列為引起繼發型心肌病之一[7]。生長激素型腺瘤早期可出現心臟結構異常及功能代償,常為室壁增厚、舒縮功能異常等[8]。研究患者超聲心動圖結果可顯示其LVEF均值和E/A比例明顯低于健康人,而LVIDd、IVST、LVPWT值顯著高于健康人。伴隨心慌、頭暈乏力、高血壓及心律失常,嚴重者可導致心力衰竭,甚至死亡。故早診斷早治療是治療生長激素型垂體瘤的可靠途徑。
目前臨床對生長激素型垂體瘤合并心肌疾病的治療首選方案為經鼻蝶竇入路,腫瘤組織切除比例越大越好,盡可能將生長激素降至正常水平[9]。其療效得到廣大一線醫生的一致認可,大部分手術能將腫瘤組織完全切除,有效緩解患者癥狀甚至痊愈[10]。本試驗研究中全切除患者占58.46%,次切除占26.15%,大部分切除占15.39%。術后2周45例生長激素水平小于5 μg/L,平均生長激素水平為(4.37±2.03)μg/L,較術前的(40.27±4.18)μg/L有顯著下降,結果表明手術療效較好。對術后腫瘤直徑大于30 mm的2例患者持續給予生長抑素奧曲肽治療,定期隨訪并觀察殘余腫瘤的生長狀態,隨訪6個月至2年未見腫瘤復發。
生長激素型垂體瘤所引起的心肌病是一種特殊類型心肌病,相關研究表明持續增高的生長激素及胰島素生長因子可作用于心肌細胞的受體,可能增強心肌收縮能力,提高心肌纖維對鈣離子的敏感性[11]。同時能促進心肌蛋白合成,導致心肌厚度增加[12]。生長激素的長期分泌還可導致心肌間質膠原沉淀積聚與纖維化,造成心肌壞死,加重心室的增厚及僵硬[13]。另有研究指出,生長激素的過度分泌引起水潴留,增大前后負荷血管阻力,引發繼發性高血壓[14],此結論在動物實驗中同樣適用[15]。現治療主要途徑是通過切除腫瘤,以綜合治療輔助,從而降低生長激素水平,改善心臟結構。目前臨床常見的手術方式包括神經內鏡下和顯微鏡鏡下行腫瘤切除術,兩種手術方式各有優劣勢,其中顯微鏡下切除術運用時間較早,臨床運用較為廣泛,適應證更為廣泛,技巧熟練度更高。大部分醫院均可獨立開展該手術。而且顯微鏡可呈現三維立體圖像,便于醫師雙手操作,即使發生出血意外也能及時止血,滿足大部分經鼻蝶竇入路行垂體瘤切除術的要求。而神經內鏡下腫瘤切除術其出血率顯著高于顯微鏡下出血率,而且是單手操作,對手術操作者的操作技能有著較高的要求,手術時間更長,當發生出血意外時難以止血。
研究數據表明,垂體瘤切除術后IVST、LVIDd均有顯著下降,心臟舒縮功能有明顯改善,與術前對比差異有統計學意義(P<0.05)[16]。有研究報道,由生長激素引起的腺瘤合并心肌病的心臟結構具有可逆性[17],但能否恢復成發病前的水平則尚未得知,需要進一步研究。然而手術對侵襲性垂體瘤并不能完全切除,心力衰竭程度嚴重,心臟功能為Ⅳ級,術后生長激素也無法恢復至正常水平,需要長期服用生長抑素,遠期療效仍值得觀察。治療后期的重心為恢復靶器官的損傷,需要長期指導治療,適用的藥物包括強心、利尿及降壓藥物。
綜上所述,生長激素型垂體腺瘤合并心臟病為多領域疾病,早確診早切除以控制生長激素水平從而盡快改善心臟結構及功能是治療的有效途徑。配合心臟受累的評估結果能使療效得到進一步提高。
[1]Swaney PJ,Gilbert HB,Webster IR,et al.Endonasal skull base tumor removal using concentric tube continuum robots:a phantom study[J].J Neurol Surg B Skull Base,2015,76(2):145-149.
[2]D′sylva C,Khan T,Fraser LA,et al.Osteoporotic fractures in patients with untreated hyperprolactinemia Vs.those taking dopamine agonists:a systematic review and meta-analysis[J].Endocr Rev,2014,35(3):745-749.
[3]焦永輝,劉小海,代從新,等.信號轉導與轉錄激活因子3表達水平與垂體腺瘤各亞型的相關性[J].中國醫學科學院學報,2015,37(6):693-697.
[4]Ichimura S,Fahlbusch R,Lüdemann W.Treatment of hyponatremia with tolvaptan in a patient after neurosurgical treatment of a pituitary tumor:case report and review of literature[J].J Neurol Surg Rep,2015,76(2):e279-e281.
[5]Mustafina AN,Yakovlev AV,Gaifullina AS,et al.Hydrogen sulfide induces hyperpolarization and decreases the exocytosis of secretory granules of rat GH3 pituitary tumor cells[J].Biochem Biophys Res Commun,2015,465(4):825-831.
[6]徐文俊,王榮,黃勇,等.單鼻孔經蝶入路顯微手術切除垂體瘤后腦脊液鼻漏的相關因素分析及防治[J].重慶醫學,2013,42(20):1671-8348.
[7]Tohti M,Li J,Ma C,et al.Expression of AGR2 in pituitary adenomas and its association with tumor aggressiveness[J].Oncol Lett,2015,10(5):2878-2882.
[8]白吉偉,李儲忠,桂松柏,等.垂體生長激素腺瘤患者的臨床特點及手術療效初步分析[J].中華神經外科雜志,2015,31(7):653-657.
[9]Cecenarro LA,Estario P,Estario ME,et al.Update on endocrinology:management of prolactinomas during pregnancy[J].Rev Fac Cien Med Univ Nac Cordoba,2015,72(3):170-174.
[10]Kuzmińska M.A 21-year old patient with hypernatraemia after intracranial tumour surgery--a case report[J].Przegl Lek,2015,72(8):449-452.
[11]孫帥奇,夏學巍,李普陽,等.過氧化物酶體增殖物激活受體γ激動劑對生長激素分泌型垂體腺瘤的影響[J].實用醫學雜志,2013,29(17):2776-2778.
[12]朱丹化,吳哲褒,陳賢斌,等.垂體生長激素大腺瘤和無功能大腺瘤的生長模式分析[J].中華神經外科雜志,2012,28(1):59-62.
[13] Lois K,Santhakumar A,Vaikkakara S,et al.Phaeochromocytoma and acth-dependent cushing′s syndrome:tumor crf-secretion can mimic pituitary cushing′s disease[J/OL].Clin Endocrinol(Oxf),2016,84(2):177-184.
[13]Lawrence LA,Baker AB,Nguyen SA,et al.Predictors of 30-day morbidity and mortality in transnasal microscopic pituitary tumor excision[J].Int Forum Allergy Rhinol,2016,6(2):206-213.
[14]Takashi Y,Kinoshita Y,Makita N,et al.Rapid recovery of Hypothalamic-Pituitary axis after successful resection of an ACTH-secreting neuroendocrine tumor[J].Intern Med,2015,54(17):2201-2205.
[15]李守漢,孟輝,田巍,等.經鼻蝶垂體瘤手術的術后并發癥分析[J].重慶醫學,2012,41(5):492-493.
[16]Chunharojrith P,Nakayama Y,Jiang X,et al.Tumor suppression by MEG3 lncRNA in a human pituitary tumor derived cell line[J].Mol Cell Endocrinol,2015,416:27-35.
[17]Tang J,Wang ZY,Chen L,et al.Gossypol acetate induced apoptosis of pituitary tumor cells by targeting the BCL-2 via the upregulated microRNA miR-15a[J].Int J Clin Exp Med,2015,8(6):9079-9085.
Analysisoninfluenceoftranssphenoidalapproachpituitaryadenomaresectioninpatientswithcomplicatingcardiomyopathyonserumgrowthhormonelevelandcardiacstructuralfunction*
GuJunyi,LiXiangdong,WangZhong,YuZhengquan,ZhouYouxin,ChenGang,ChenYuchao,LiuYuzhao
(DepartmentofNeurosurgery,FirstAffiliatedHospitalofSuzhouUniversity,Suzhou,Jiangsu215000,China)
ObjectiveTo study the surgical treatment and clinical effect of growth hormone type pituitary tumor complicating cardiomyopathy.MethodsSixty-five cases of growth hormone type pituitary adenoma complicating cardiomyopathy in the hospital from June 2012 to June 2016 were selected and performed transsphenoidal approach pituitary adenoma resection.Then serum growth hormone level,ECG results,ultrasound cardiogram results and clinical symptoms were observed at 2 weeks after operation.ResultsThe signs were significantly improved after surgery,acromegaly and nasolabial hypertrophy were significantly improved,dizziness,fatigue,hypertension and hyperglycemia were significantly improved;the average postoperative growth hormone level was (4.37±2.03)μg/L,which was significantly lower than (40.27±4.18)μg/L before operation,and the difference was statistically significant (P<0.01);postoperative IVST,LVIDd and LVPWT were significantly lower than those before operation,and the difference was statistically significant (P<0.01);postoperative average E/A and LVEF were significantly lower than those before operation,and the difference was statistically significant (P<0.01).ConclusionTranssphenoidal pituitary tumor resection can reduce the level of growth hormone and improves the cardiac function.
] pituitary neoplasms;myocardial thickening;growth hormone;pituitary tumur resection
10.3969/j.issn.1671-8348.2017.36.009
國家自然科學基金資助項目(81671743)。
顧俊怡(1980-),主治醫師,碩士,主要從事顱腦腫瘤研究。
R739.41
A
1671-8348(2017)36-5065-03
2017-08-26
2017-09-27)

