全胃切除術后調節型雙通道空腸間置代胃術重建消化道效果觀察
陶小亮,姜淮蕪,徐亮,陳進,肖仕明,周航宇
(1 西南醫科大學附屬醫院,四川瀘州 646000;2四川綿陽四○四醫院)
全胃切除術后調節型雙通道空腸間置代胃術重建消化道效果觀察
陶小亮1,姜淮蕪1,徐亮1,陳進2,肖仕明2,周航宇2
(1 西南醫科大學附屬醫院,四川瀘州 646000;2四川綿陽四○四醫院)
目的探討全胃切除術后調節型雙通道空腸間置代胃術重建消化道的效果。方法將80例行全胃切除術治療的胃癌患者隨機分為觀察組和對照組,各40例。兩組全胃切除術手術方法相同。全胃切除術后觀察組采用調節型雙通道空腸間置代胃術治療,對照組采用Roux-en-Y吻合術重建消化道。結果觀察組1例、對照組2例隨訪期間因胃癌復發死亡,被剔除。兩組消化道重建時間、術中失血量、術后首次排氣時間、術后首次進食時間比較P均>0.05。 觀察組術后1年內反流性食管炎、傾倒綜合征、RY滯留綜合征發生率均低于對照組(P均<0.05);每次飲食量<300 mL及飲食次數>5次者構成比均低于對照組,術后1年體質量、血紅蛋白、血清總蛋白、白蛋白下降程度均低于對照組(P均<0.05)。結論全胃切除術后采用調節型雙通道空腸間置代胃術重建消化道的效果優于Roux-en-Y吻合術。
胃癌;調節型雙通道空腸間置代胃術;Roux-en-Y吻合術;全胃切除術;消化道重建
近年來進展期胃癌及近端胃癌的發病率逐漸增加[1,2],對此類患者,根治性全胃切除術是首選治療方法,但是全胃切除后采用何種方式行消化道重建目前未達成共識[3]。Roux-en-Y吻合術是目前常用的消化道重建方法,但其并發癥較多。調節型雙通道空腸間置代胃術[4]是在郝希山院士設計的功能性空腸間置代胃術的基礎上改進而來,兼有空腸間置代胃術、Roux-en-Y吻合術、袢式Braun吻合三種術式的特點。本研究觀察了胃癌患者全胃切除術后采用調節型雙通道空腸間置代胃術行消化道重建的效果,并與Roux-en-Y吻合術進行了對比。現報告如下。
1 資料與方法
1.1 臨床資料 選擇2013年2月~2016年2月術前胃鏡病理確診為胃癌行全胃切除術的80例患者,其中男50例、女30例,年齡(56.4±6.2)歲。BMI 21.8±2.6。胃癌臨床分期(WHO標準)為Ⅱ期27例、Ⅲ期44例、Ⅳ期9例。術前未行放化療。排除有胃腸道手術史、患有基礎代謝性疾病者及孕產婦、哺乳期婦女。采用信封法將患者隨機分為觀察組和對照組,各40例。兩組一般資料具有可比性。本研究經醫院倫理委員會批準,患者已簽署知情同意書。
1.2 全胃切除術后消化道重建方式 觀察組全胃切除術后采用調節型雙通道空腸間置代胃術行消化道重建[4]:于距Treitz韌帶約25 cm處將空腸于結腸前上提同食管行側端吻合,距此吻合口遠端35 cm將空腸與十二指腸行側端吻合,然后將距Treitz韌帶10 cm的近端空腸同距十二指腸吻合口遠端約5 cm的空腸行Braun吻合。上述吻合口均用國產26號吻合器完成;吻合器槍身由擬作縮窄縫合的腸腔置入;縮窄縫合部位為十二指腸吻合口與Braun吻合口之間的5 cm空腸。縱向切開該段腸管3 cm,完成上述吻合后,仍然縱向縫合腸管切口,自然完成腸管縮窄。最后位于食管吻合口與Braun吻合口之間的輸入袢腸管5 cm處,采用粗絲線適度結扎,以防止術后輸入袢腸管再通。 對照組采用Roux-en-Y吻合術行消化道重建:全胃切除后,距Treitz韌帶約15~20 cm處切斷空腸,將遠端空腸經結腸前提起,與食管下端行端-側吻合,近端空腸在距食管空腸吻合口下40 cm處與遠端空腸行端-側吻合,十二指腸近端關閉。
1.3 相關指標觀察 ①圍術期相關指標:包括消化道重建時間、術中失血量、術后首次排氣、進食時間。② 隨訪情況:術后隨訪1年,比較兩組并發癥(反流性食管炎、傾倒綜合征、RY滯留綜合征)發生情況、飲食情況(統計每次飲食量<300 mL和飲食次數>5次/d的患者例數)及營養狀況(體質量、血紅蛋白、血清總白蛋白、血清白蛋白下降程度)。
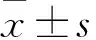
2 結果
2.1 兩組圍手術期指標比較 觀察組1例、對照組2例隨訪期間因胃癌復發死亡,被剔除。兩組消化道重建時間、術中失血量、首次排氣及進食時間比較P均>0.05。見表1。

表1 兩組圍手術期相關指標
2.2 兩組術后并發癥發生情況 觀察組發生反流性食管炎3例(7.7%)、傾倒綜合征3例(7.7%)、RY滯留綜合征2例(5.1%);對照組分別為8例(21.1%)、9例(23.7%)、12例(31.6%)。觀察組反流性食管炎、傾倒綜合征、RY滯留綜合征發生率均低于對照組(P均<0.05)。
2.3 兩組飲食情況及營養狀況比較 觀察組及對照組每次飲食量<300 mL者分別為5例(12.8%)、12例(31.6%),飲食次數>5次/d者分別為4例(15.4%)、12例(26.3%),兩組比較P均<0.05。術后1年觀察組體質量、血紅蛋白、血清總蛋白、白蛋白下降程度均低于對照組(P均<0.05)。見表2。

表2 兩組術后1年體質量、血紅蛋白、血清總蛋白、白蛋白下降程度比較
注:與對照組比較,*P<0.05。
3 討論
胃癌手術治療包括腫瘤的R0切除、受累淋巴結清掃和消化道重建。隨著腫瘤綜合治療療效的提高,術后預期獲得長期生存的患者越來越關注術后并發癥(營養不良、反流性食管炎、傾倒綜合征、RY滯留綜合征等)發生情況。研究表明,全胃切除術后營養不良及并發癥的發生與消化道重建方式密切相關[5]。胃癌全胃切除術后消化道重建應確保患者術后能更快適應“無胃狀態”,盡早恢復日常生活;同時操作應簡單,盡可能減輕術后不適感。Roux-en-Y吻合術重建消化道操作簡單、吻合口少、可防止膽汁和胰液反流,目前應用最為廣泛[6];但其重建消化道不能維持小腸的連續性,且十二指腸被曠置,患者術后早期多出現腸道功能障礙[7]。文獻報道,全胃切除術后采用Roux-en-Y吻合術重建消化道RY滯留綜合征、傾倒綜合征、反流性食管炎發生率分別為42.7%、 16.7%、26.5%[8];本研究對照組術后1年RY滯留綜合征、傾倒綜合征、反流性食管炎發生率與之相近。
調節型雙通道空腸間置代胃術兼有空腸間置代胃術、Roux-en-Y吻合術、袢式Braun吻合三種術式的特點,可以看作三種術式的共同改良手術。本研究結果顯示,兩組消化道重建時間、術中失血量、術后首次排氣時間、術后首次進食時間、住院時間相比差異無統計學意義,說明調節型雙通道空腸間置代胃術未增加手術難度和圍術期風險。觀察組術后1年內反流性食管炎、傾倒綜合征、RY滯留綜合征發生率均低于對照組;每次飲食量<300 mL者和飲食次數>5次/d者構成比均低于對照組;術后1年體質量、血紅蛋白、血清總蛋白、白蛋白下降程度均低于對照組。說明采用調節型雙通道空腸間置代胃術行消化道重建術后并發癥發生率低,患者術后飲食和營養狀態較好。其原因可能與以下幾個方面有關:①消化道重建后食物主要通過十二指腸通道消化,利于十二指腸生理功能的維持和發揮[9]。食物刺激十二指腸黏膜神經可以促進促胰液素和膽囊收縮素分泌,使消化液與食物充分混合,利于胰島素的分泌和食物的消化[10];并且可以維持腸道堿性環境,抑制細菌繁殖,促進腸道黏膜生長;還能延緩食物排空,減少傾倒綜合征的發生。②消化道重建后保持小腸連續性,小腸存在移行性運動復合波[11](對照組空腸-空腸端側吻合口處移行性運動復合波紊亂,近側空腸運動頻率高于遠側空腸,會導致空腸逆蠕動,最終導致RY滯留綜合征[12]),小腸神經、血管連續性得以維持,符合生理狀態,有利于腸道功能保留。③消化道重建后大部分食物通過十二指腸通道,一小部分流質可以通過縮窄通道。該縮窄通道能夠減少十二指腸吻合口張力,并且堿性反流液體可以通過此處,從而減少反流性食管炎及RY滯留綜合征的發生[13]。④消化道重建后模擬胃儲物,在食管吻合口與十二指腸吻合口之間建立35 cm空腸袢,減少了堿性消化液對食管的刺激[14,15],增加進食量,減少進食次數,使術后攝食反應逐漸恢復到正常狀態。
綜上所述,胃癌患者全胃切除術后采用調節型雙通道空腸間置代胃術重建消化道效果優于Roux-en-Y吻合術。但本研究隨訪時間短,病例數少,遠期效果還需要進一步大樣本進行研究。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cance, 2015,136(5):E359-386.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[3] Ajani JA, D′Amico TA, Almhanna K, et al. Gastric cancer, version 3.2016, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2016,14(10):1286-1312.
[4] 肖仕明,姜淮蕪,陳進,等.全胃切除調節型雙通道間置空腸消化道重建[J].中國普外基礎與臨床雜志,2008,15(1):23-26.
[5] Takiguchi N, Takahashi M, Ikeda M, et al. Long-term quality-of-life comparison of total gastrectomy and proximal gastrectomy by postgastrectomy syndrome assessment scale (PGSAS-45): a nationwide multi-institutional study[J]. Gastric Cancer, 2015,18(2):407-416.
[6] Kumagai K, Shimizu K, Yokoyama N, et al. Questionnaire survey regarding the current status and controversial issues concerning reconstruction after gastrectomy in Japan[J]. Surg Today, 2012,42(5):411-418.
[7] 翟同善.全胃切除術后Roux-en-Y滯留綜合征的研究[J].山東醫藥,2010,50(24):53-55.
[8] 郝希山,李強,張忠國.胃癌患者全胃切除術后消化道重建方式的臨床研究[J].中華胃腸外科雜志,2003,6(2):89-92.
[9] Gong JQ, Cao YK, Zhang GH, et al. Uncut esophagojejunostomy with double jejunal pouch: an alternative reconstruction method that improves the quality of life of patients after total gastrectomy[J]. J Invest Surg, 2017,30(2):125-132.
[10] Ding X, Yan F, Liang H, et al. Functional jejunal interposition, a reconstruction procedure, promotes functional outcomes after total gastrectomy[J]. BMC Surg, 2015,15(1):43-48.
[11] Deloose E, Janssen P, Depoortere I, et al. The migrating motor complex: control mechanisms and its role in health and disease[J]. Nat Rev Gastroenterol Hepatol, 2012,9(5):271-285.
[12] 梁寒.全胃切除術后消化道重建的現狀與困惑[J].中國普外基礎與臨床雜志,2013,20(6):589-594.
[13] 袁淼,姜淮蕪,譙時文.胃癌調節型雙通道重建術后患者的生活質量分析[J].廣東醫學,2012,33(20):3076-3078.
[14] 季加孚,季鑫.應該重視胃癌根治術后的消化道重建[J].中華胃腸外科雜志,2013,16(2):104-108.
[15] Sun YS, Ye ZY, Shao QS, et al. The application of uncut Roux-en-Y esophagojejunostomy with distal jejunal pouch on behalf of the stomach surgery in the digestive tract reconstruction after total gastrectomy[J]. Zhonghua Wai Ke Za Zhi, 2012,50(8):699-703.
四川省科技支撐項目(2009SZ0100)。
姜淮蕪(E-mail: jhuaiwu@163.com)
10.3969/j.issn.1002-266X.2017.40.018
R735.2
B
1002-266X(2017)40-0060-03
2017-03-06)

