急性T淋巴細胞白血病相關(guān)長鏈非編碼RNA T-ALL-R-LncR1的發(fā)現(xiàn)、鑒定及其功能研究
張琳,陸超,李天宇
(1無錫市兒童醫(yī)院,江蘇無錫214023;2江蘇省人民醫(yī)院)
急性T淋巴細胞白血病相關(guān)長鏈非編碼RNA T-ALL-R-LncR1的發(fā)現(xiàn)、鑒定及其功能研究
張琳1,陸超2,李天宇1
(1無錫市兒童醫(yī)院,江蘇無錫214023;2江蘇省人民醫(yī)院)
目的對新發(fā)現(xiàn)的急性T淋巴細胞白血病(T-ALL)相關(guān)長鏈非編碼RNA進行鑒定并研究其功能。方法①提取T-ALL Jurkat細胞RNA進行全轉(zhuǎn)錄組深度測序,發(fā)現(xiàn)了一種新的T-ALL相關(guān)長鏈非編碼RNA,命名為T-ALL-R-LncR1。用實時熒光定量PCR和瓊脂糖凝膠電泳法觀察Jurkat細胞和T-ALL患者骨髓單個核細胞中T-ALL-R-LncR1的表達情況。②將體外培養(yǎng)的T-ALL患者骨髓單個核細胞分為實驗組、空質(zhì)粒組和對照組。實驗組轉(zhuǎn)染T-ALL-R-LncR1小干擾RNA(siRNA),空質(zhì)粒組轉(zhuǎn)染空質(zhì)粒,對照組不轉(zhuǎn)染。轉(zhuǎn)染24 h時用實時熒光定量PCR法檢測各組細胞T-ALL-R-LncR1相對表達量。轉(zhuǎn)染24、48、72 h時用CCK-8法觀察各組細胞增殖情況(以O(shè)D450表示),轉(zhuǎn)染48 h用流式細胞術(shù)測算各組細胞凋亡率。結(jié)果① T-ALL-R-LncR1具有原癌基因特性,在人T-ALL Jurkat細胞及T-ALL患者骨髓單個核細胞中高表達。用逆轉(zhuǎn)錄實時定量PCR法從Jurkat細胞及急性T淋巴細胞白血病骨髓單個核細胞中獲得PCR產(chǎn)物的瓊脂糖凝膠電泳結(jié)果符合T-ALL-R-LncR1。測序結(jié)果證實PCR產(chǎn)物為T-ALL-R-LncR1。②實驗組、空質(zhì)粒組和對照組T-ALL-R-LncR1相對表達量分別為0.79±0.18、 1.12±0.08和1。實驗組骨髓單個核細胞 T-ALL-R-LncR1相對表達量低于空質(zhì)粒組和對照組(P均<0.05),空質(zhì)粒組和對照組骨髓單個核細胞 T-ALL-R-LncR1相對表達量相比P>0.05。轉(zhuǎn)染24、48、72 h時實驗組骨髓單個核細胞OD450值均低于空質(zhì)粒組和對照組(P均<0.05),空質(zhì)粒組和對照組骨髓單個核細胞OD450相比P均>0.05。轉(zhuǎn)染48 h時實驗組、空質(zhì)粒組、對照組細胞凋亡率分別為38.67%±1.32%、1.80%±0.14%、1.79%±0.13%。實驗組細胞凋亡率高于空質(zhì)粒組和對照組(P均<0.05),空質(zhì)粒組和對照組細胞凋亡率相比P>0.05。結(jié)論本研究發(fā)現(xiàn)了一種具有原癌基因特性的新T-ALL相關(guān)長鏈非編碼RNA,即T-ALL-R-LncR1。沉默T-ALL-R-LncR1可以促進T-ALL患者骨髓單個核細胞凋亡并抑制其增殖。
急性T淋巴細胞白血病;長鏈非編碼RNA;細胞增殖;細胞凋亡
急性T淋巴細胞白血病(T-ALL)在兒童血液系統(tǒng)惡性腫瘤中的發(fā)病率約為15%,病死率約20%[1]。目前T-ALL的發(fā)病機制仍不清楚。研究發(fā)現(xiàn),長鏈非編碼RNA(LncRNA)參與了腫瘤浸潤與轉(zhuǎn)移、細胞凋亡調(diào)控等過程,并可通過表觀遺傳調(diào)控的方式影響腫瘤細胞生長,可能成為新型腫瘤標志物或腫瘤治療的靶點[2,3]。為尋找T-ALL相關(guān)LncRNA,本研究于2012年3月對T-ALL細胞株Jurkat進行全轉(zhuǎn)錄組深度測序,將新發(fā)現(xiàn)的T-ALL相關(guān)LncRNA命名為T-ALL-R-LncR1,并觀察了轉(zhuǎn)染T-ALL-R-LncR1 siRNA對T-ALL患兒骨髓單個核細胞增殖、凋亡的影響,旨在明確T-ALL-R-LncR1在T-ALL中的作用及其機制。
1 材料與方法
1.1 Jurkat細胞株來源及T-ALL患兒骨髓單個核細胞制備 Jurkat細胞系購于中國科學院上海生命科學研究院細胞資源中心。抽取無錫市兒童醫(yī)院血液科收治的1例T-ALL患兒的骨髓2 mL,肝素抗凝,用淋巴細胞Ficoll分離液分離骨髓單個核細胞,用含100 g/L FBS的RPMI 1640培養(yǎng)基于37 ℃、50 mL/L CO2細胞培養(yǎng)箱中培養(yǎng)。細胞呈懸浮狀態(tài),生長良好,處于對數(shù)生長期時進行后續(xù)實驗。本研究已獲我院醫(yī)學倫理委員會批準,患兒家長簽署知情同意書。
1.2 T-ALL相關(guān)LncR的檢測及鑒定 收集處于對數(shù)生長期的Jurkat細胞,接種于細胞培養(yǎng)板,每孔106個細胞。每孔加入1 mL TRIzol裂解細胞,用移液器(去RNA酶)輕輕來回吹吸裂解細胞,將裂解后的細胞全部轉(zhuǎn)移至無菌無RNA酶的1.5 mL EP管,置于干冰箱中運送至深圳華大基因公司進行全轉(zhuǎn)錄組深度測序。測序數(shù)據(jù)由華大基因公司進行生物信息分析,獲得一種T-ALL相關(guān)的長鏈非編碼RNA,并命名為T-ALL-R-LncR1。采用實時熒光定量PCR法檢測T-ALL-R-LncR1在Jurkat細胞及FALL患者骨髓單個核細胞中的表達情況。引物設(shè)計應(yīng)用Primer5.0軟件。T-ALL-R-LncR1上游引物序列:5′-TGCCAGCACGGCTAGGATAAA-3′,下游引物序列:5′-GTGAAGGAAGCCTGGTTTTGA-3′;內(nèi)參照GAPDH上游引物:5′-GGTCGGAGTCAACGGATT-TGGTCG-3′,下游引物5′-CCTCCGACGCCTGCTTCA-CCAC-3′。PCR擴增反應(yīng)條件:98 ℃預(yù)變性1 min,然后98 ℃變性30 s、64 ℃退火30 s、72 ℃延伸2 min,熱循環(huán)(變性、退火和延伸)35次,最后72 ℃延伸7 min,4 ℃保存。12 g/L瓊脂糖凝膠電泳檢測PCR產(chǎn)物大小,部分PCR產(chǎn)物送上海英駿生物技術(shù)有限公司測序。
1.3 轉(zhuǎn)染T-ALL-R-LncR1 siRNA對T-ALL患兒骨髓單個核細胞增殖、凋亡的影響 將體外培養(yǎng)的T-ALL患兒骨髓單個核細胞接種于6孔培養(yǎng)板,每孔1.5 mL培養(yǎng)基含(3~5)×105個細胞。設(shè)實驗組、空質(zhì)粒組和對照組,每組6孔。實驗組轉(zhuǎn)染T-ALL-R-LncR1小干擾RNA(siRNA),空質(zhì)粒組轉(zhuǎn)染空質(zhì)粒,對照組不轉(zhuǎn)染。轉(zhuǎn)染方法參照LipofectamineTM2000說明書。
1.3.1 各組骨髓單個核細胞T-ALL-R-LncR1相對表達量檢測 采用實時熒光定量PCR法。轉(zhuǎn)染24 h后收集各組細胞,采用TRIzol一步法提取各組細胞總RNA,反轉(zhuǎn)錄為cDNA。行實時熒光定量PCR檢測。T-ALL-R-LncR1上游引物序列5′-GAAGGCGCCATTTCTCTGTG-3′,下游引物序列5′-AGATGTGCGGGTCTTTTCCG-3′;內(nèi)參照β-actin上游引物序列5′-ACTGGAACGGTGAAGGTGAC-3′,下游引物序列5′-AGAGAAGTGGGGTGGCTTTT-3′。反應(yīng)體系為10 μL。PCR擴增條件:95 ℃預(yù)變性30 s,95 ℃變性5 s、60 ℃退火30 s,共40個循環(huán),最后95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s。采用2-ΔΔCt法計算T-ALL-R-LncR1相對表達量。
1.3.2 各組骨髓單個核細胞增殖情況觀察 采用CCK-8法。轉(zhuǎn)染24、48、72 h時每孔加入10 μL CCK-8,輕輕混勻,37 ℃條件下孵育2 h,用全自動酶標儀檢測450 nm處的吸光度(OD450)值,用其表示各組骨髓單個核細胞增殖情況。
1.3.3 各組骨髓單個核細胞凋亡率測算 采用流式細胞術(shù)。轉(zhuǎn)染48 h,收集各組細胞懸液至2.0 mL的EP管,1 000 r/min離心5 min,棄上清。用預(yù)冷的PBS緩沖液洗滌細胞2次,調(diào)整細胞密度至1×105/mL,100 μL細胞懸液中加5 μL AnnexinV-APC和5 μL放線菌素D(7AAD),混勻,避光,室溫放置15 min后每個樣品加入400 μL Binding buffer,振蕩混勻后用流式細胞儀檢測凋亡率。
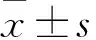
2 結(jié)果
2.1 T-ALL-R-LncR1的特征及其在Jurkat細胞、T-ALL骨髓單個核細胞中的表達情況 T-ALL-R-LncR1由2個外顯子組成,2個外顯子的大小分別是338、1 130 bp,這2個外顯子在6號染色體上的起點和終點分別是147176058、147177525,使用RNAFold軟件對T-ALL-R-LncR1進行了深層次的分析,發(fā)現(xiàn)其有穩(wěn)定的二級結(jié)構(gòu),但是在其開放閱讀框架(ORFs)5′端的轉(zhuǎn)錄起始位點缺乏Kozak序列,它的ORFs不能翻譯成蛋白質(zhì)。用逆轉(zhuǎn)錄實時定量PCR法從Jurkat細胞及T-ALL骨髓單個核細胞中獲得PCR產(chǎn)物瓊脂糖凝膠電泳結(jié)果符合T-ALL-R-LncR1。送上海英駿生物技術(shù)有限公司測序的PCR產(chǎn)物證實為T-ALL-R-LncR1。
2.2 各組骨髓單個核細胞T-ALL-R-LncR1相對表達量比較 實驗組、空質(zhì)粒組和對照組T-ALL-R-LncR1相對表達量分別為0.79±0.18、 1.12±0.08和1。實驗組骨髓單個核細胞 T-ALL-R-LncR1相對表達量低于空質(zhì)粒組和對照組(P均<0.05),空質(zhì)粒組和對照組骨髓單個核細胞 T-ALL-R-LncR1相對表達量相比P>0.05。
2.3 各組骨髓單個核細胞增殖情況比較 相同時間點實驗組骨髓單個核細胞OD450值低于空質(zhì)粒組和對照組(P均<0.05),空質(zhì)粒組和對照組骨髓單個核細胞OD450值相比P>0.05。見表1。

表1 各組轉(zhuǎn)染24、48、72 h時骨髓單個核細胞OD450值比較
注:與對照組、空質(zhì)粒組相比,*P均<0.05。
2.4 各組骨髓單個核細胞凋亡率比較 轉(zhuǎn)染48 h時實驗組、空質(zhì)粒組、對照組細胞凋亡率分別為38.67%±1.32%、1.80%±0.14%、1.79%±0.13%。實驗組細胞凋亡率高于空質(zhì)粒組和對照組(P均<0.05),空質(zhì)粒組和對照組細胞凋亡率相比P>0.05。
3 討論
LncRNA是一類轉(zhuǎn)錄本長度200 nt~100 kb的非編碼RNA,其表達具有時空特異性,是不具備編碼蛋白功能的基因轉(zhuǎn)錄產(chǎn)物[4]。目前越來越多的研究證實,LncRNA以RNA的形式在表觀遺傳調(diào)控、轉(zhuǎn)錄調(diào)控及轉(zhuǎn)錄后調(diào)控等多種層面調(diào)控基因的表達水平,它既可抑制蛋白編碼基因的表達,也可活化某些蛋白編碼基因表達。其作用機制亦多種多樣,如介導染色質(zhì)重構(gòu)及組蛋白修飾、影響下游基因的表達、影響轉(zhuǎn)錄因子活化與轉(zhuǎn)運、調(diào)節(jié)特定蛋白質(zhì)的活性等[5]。多種腫瘤中存在LncRNA的異常表達,尤其是惡性腫瘤[6]。在腫瘤細胞中,某些特定LncRNA的表達水平會發(fā)生特異性改變,在結(jié)腸癌細胞中OCC1基因的轉(zhuǎn)錄水平明顯增高, OCC1 RNA具有明顯的組織特異性,且在正常黏膜中無或很少表達[7]。在前列腺癌中,DD3RNA只在前列腺組織中被特異性轉(zhuǎn)錄,約90%的前列腺癌患者中存在其轉(zhuǎn)錄產(chǎn)物水平增高[8],故DD3RNA被作為特異性的標志物用于前列腺癌的診斷[9]。在小細胞肺癌組織中MALAT-1與肺癌轉(zhuǎn)移形式的特殊關(guān)聯(lián)使其成為肺癌患者診斷的標志物[10]。HOTAIR與乳腺癌、肝癌的復發(fā)、轉(zhuǎn)移有關(guān)[11]。Eis等[12]研究發(fā)現(xiàn),miR-155可由淋巴細胞中LncRNA BIC RNA序列加工而成。但目前為止,臨床上對T-ALL相關(guān)LncRNA的研究較少。
本研究我們通過高通量測序獲得了一個新的T-ALL相關(guān)LncRNA,將其命名為T-ALL-R-LncR1。T-ALL-R-LncR1由2個外顯子組成,2個外顯子的大小分別是338、1 130 bp,這2個外顯子在6號染色體上的起點和終點分別是147176058、147177525,使用RNAFold軟件對T-ALL-R-LncR1進行深層次的分析發(fā)現(xiàn),其有穩(wěn)定的二級結(jié)構(gòu),但是在其開放閱讀框架(ORFs)5′端的轉(zhuǎn)錄起始位點缺乏Kozak序列,它的ORFs不能翻譯成蛋白質(zhì)。這些表明T-ALL-R-LncR 具有原癌基因特點。本研究用實時熒光定量PCR和瓊脂糖凝膠電泳法觀察Jurkat細胞和T-ALL患者骨髓單個核細胞中T-ALL-R-LncR1的表達情況,結(jié)果電泳結(jié)果符合T-ALL-R-LncR1。送去測序的PCR產(chǎn)物也被證實為T-ALL-R-LncR1。表明T-ALL患兒骨髓單個核細胞中存在T-ALL-R-LncR1表達,T-ALL-R-LncR1可能是T-ALL的相關(guān)LncRNA。
為進一步明確T-ALL-R-LncR1與T-ALL的相關(guān)性,并研究T-ALL-R-LncR1在T-ALL發(fā)生發(fā)展中的作用,本研究觀察了轉(zhuǎn)染T-ALL-R-LncR1 siRNA對T-ALL患兒骨髓單個核細胞增殖、凋亡的影響,結(jié)果顯示,相對于轉(zhuǎn)染空質(zhì)粒的空質(zhì)粒組和未轉(zhuǎn)染的對照組,轉(zhuǎn)染T-ALL-R-LncR1 siRNA的實驗組T-ALL患兒骨髓單個核細胞T-ALL-R-LncR1相對表達量降低,細胞凋亡率升高,細胞增殖能力下降。表明T-ALL-R-LncR1確實參與了T-ALL患兒骨髓單個核細胞增殖和凋亡的調(diào)控。
搜索國內(nèi)外數(shù)據(jù)庫,筆者并未發(fā)現(xiàn)類似內(nèi)容的文獻。故本研究發(fā)現(xiàn)了一個新的與T-ALL有關(guān)的LncRNA:T-ALL-R-LncR1;沉默T-ALL-R-LncR1能抑制T-ALL患兒骨髓單個核細胞增殖,促進T-ALL患兒骨髓單個核細胞凋亡。T-ALL-R-LncR1是T-ALL治療的一個潛在的靶點。但是本研究并未涉及T-ALL-R-LncR1調(diào)控T-ALL患兒骨髓單個核增殖、凋亡的機制,今后我們將進行這方面的研究。
[1] Van Vlierberghe P, Ferrando A. The molecular basis of T cell acute lymphoblastic leukemia[J]. Clin Invest, 2012,122(10):3398-3406.
[2] Brockdorff N. Noncoding RNA and polycomb recruitment[J]. RAN, 2013,19(4):429-442.
[3] Zhang L, Xu HG, Lu C. A novel long non-coding RNAT-ALL-R-LncR1 knockdown and Par-4 cooperate to induce cellular apoptosis in T-cell acute lymphoblastic leukemia cells[J]. Leukemia Lymphoma, 2014,55(6):1373-1382.
[4] Mercer TR, Dinger ME, Mattick JS, et al. Long non-coding RNAs: insights into functions[J]. Nat Rev Genet, 2009,10(3):155-159.
[5] Wilusz JE, Sunwoo H,Spector DL. Long noncoding RNAs: functional surprises from the RNA world[J]. Genes Dev, 2009,23(13):1494-1504.
[6] Fu X, Ravindranath L, Tran N, et al. Regulation of apoptosis by a prostate-specific and prostate cancer-associated nonconding gene PCGEM1[J]. DNA Cell Biol, 2006,25(3):135-141.
[7] Pibouin L, Villaud YJ, Ferbus D, et al. Cloning of the mRNA of overexpression in colon carcinoma-1: a sequence overexpressed in a subset of colon carcinomas[J]. Cancer Gen Cytog, 2002,133(1):55-60.
[8] Bussemakers MJC, Van Bokhoven A, Verhaegh GW, et al. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer[J]. Cancer Res, 1999,59(23):5975-5979.
[9] De Kok JB, Verhaegh GW, Roelofs RW, et al. DD3PCA3, a very sensitive and specific marker to detec prostate tumors[J]. Cancer Res, 2002,62(9):2695-2698.
[10] Ji P, Diederichs S, Wang W, et al. MALAT-1, a novel nonconding RNA, and thymosin beta4 predict metastasis and survival in early-stage non-small cell lung cancer[J]. Oncogene, 2003,22(2):8031-8041.
[11] Niinuma T, Suzuki H, Nojima M, et al. Upgulation of miR-196a and HOTAIR drive malignant character in gastrointestinal stromal tumors[J]. Cancer Res, 2012,72(5):1126-1136.
[12] Eis PS, Tam W, Sun L, et al. Accumulation of miR-155 and BIC RNA in human B cell lymphomas[J]. Proc Natl Acad Sci U S A, 2005,102(10):3627-3632.
國家自然科學基金資助項目(81170487);無錫市衛(wèi)生計生委“科教強衛(wèi)工程”醫(yī)學青年人才項目資助(QNRC014);無錫市衛(wèi)生局重大項目(Z201302)。
李天宇(E-mail: wxlty999@163.com)
10.3969/j.issn.1002-266X.2017.40.022
R733.71
B
1002-266X(2017)40-0042-03
2016-08-11)

