沉默鈣連蛋白對人腎母細胞瘤細胞凋亡及內質網應激、JNK信號通路的影響
孫為增,林國雄,林海
(海南省人民醫院,海口570311)
沉默鈣連蛋白對人腎母細胞瘤細胞凋亡及內質網應激、JNK信號通路的影響
孫為增,林國雄,林海
(海南省人民醫院,海口570311)
目的探討沉默鈣連蛋白(Calnexin)對腎母細胞瘤細胞凋亡及內質網應激、JNK信號通路的影響。方法將腎母細胞瘤SK-NEP-1細胞分為對照組、空載體組、實驗組。對照組正常培養不轉染。空載體組轉染空白質粒,實驗組轉染Calnexin shRNA。轉染24 h后全部更換為正常培養液繼續培養48 h。采用實時熒光定量 PCR法檢測各組Calnexin mRNA表達,TUNEL法檢測細胞凋亡指數(AI),Western blotting法檢測葡萄糖調節蛋白78(GRP78)、需肌醇酶1(IRE1)、腫瘤壞死因子受體相關因子2(TRAF2)、凋亡信號調節激酶1(ASK1)、磷酸化凋亡信號調節激酶1(p-ASK1)、c-Jun N末端激酶(JNK)及磷酸化c-Jun N末端激酶(p-JNK)蛋白相對表達量。結果Calnexin mRNA相對表達量:實驗組、空載體組、對照組分別為0.28±0.01、1.01±0.06、1.00±0.08;實驗組低于空載體組和對照組(P<0.05),但空載體組與對照組比較無統計學差異(P>0.05)。AI:實驗組、空載體組、對照組分別為32.86±3.72、5.46±0.68、5.26±0.17;實驗組高于空載體組和對照組(P<0.05),但空載體組與對照組比較無統計學差異(P>0.05)。GRP78、IRE1、TRAF2、ASK1、p-ASK1、JNK及p-JNK蛋白相對表達量:實驗組高于空載體組和對照組(P均<0.05),但空載體組與對照組比較無統計學差異(P均>0.05)。結論沉默Calnexin 可引發內質網應激并激活JNK細胞凋亡通路,進而促進腎母細胞瘤SK-NEP-1細胞凋亡。
腎母細胞瘤;鈣連蛋白;細胞凋亡;內質網應激;JNK信號通路
腎母細胞瘤占我國小兒惡性腫瘤的17.8%左右,目前主要采用手術+放化療等綜合療法治療,但Ⅲ、Ⅳ期腎母細胞瘤治療效果及預后不佳[1,2]。在腫瘤的發生及發展過程中,內質網應激(ERS)普遍存在[3],且ERS可選擇性的保留對ERS有拮抗傾向的細胞,使存活下的腫瘤細胞向更惡性的方向進展[4]。鈣連蛋白(Calnexin)是內質網中的Ⅰ型跨膜蛋白,具有輔助糖蛋白折疊裝配、控制內質網折疊蛋白質量監控、調節細胞內Ca2+穩態和緩解ERS等作用[2]。本課題組提出下調Calnexin基因表達可使腎母細胞瘤SK-NEP-1細胞無法調節及降解錯誤折疊蛋白,進而促進腫瘤細胞凋亡的科學假說。為驗證這一假說,2016年6~10月,我們用慢病毒轉染技術沉默腎母細胞瘤SK-NEP-1細胞Calnexin mRNA表達,并觀察了SK-NEP-1細胞ERS情況及下游JNK通路蛋白表達情況的變化。現報告如下。
1 材料與方法
1.1 材料 SK-NEP-1細胞購自美國ATCC公司,用含有10%滅活胎牛血清的DMEM培養液于37 ℃、5%CO2、飽和濕度下培養,每2至3天傳代1次。鈣連蛋白短發夾RNA(Calnexin shRNA)為本實驗室自行制備。實時熒光定量PCR試劑盒及葡萄糖調節蛋白78(GRP78)、需肌醇酶1(IRE1)、腫瘤壞死因子受體相關因子2(TRAF2)、凋亡信號調節激酶1(ASK1)、磷酸化凋亡信號調節激酶1(p-ASK1)、c-Jun N末端激酶(JNK)及磷酸化c-Jun N末端激酶(p-JNK)蛋白檢測試劑盒購自Boster公司。
1.2 SK-NEP-1細胞分組及Calnexin shRNA轉染 將SK-NEP-1細胞懸濁液以5×104/孔的密度接種于24孔板,細胞融合80%~90%時將細胞分為對照組、空載體組、實驗組。對照組正常培養不轉染。空載體組轉染空白質粒,實驗組轉染Calnexin shRNA。每組6孔。轉染24 h后全部更換為正常培養液繼續培養48 h[5]。
1.3 相關指標觀察
1.3.1 Calnexin mRNA表達 采用實時熒光定量PCR法檢測,操作按試劑盒說明書進行。正向引物:5′-GAAGGGAAGTGGTTGCTGTG-3′,反向引物:5′-CGTCTTTCTTGGCTTTGGAT-3′。提取各組細胞全部RNA,反轉錄得到對應的cDNA。在冰浴的無核酸酶的離心管中加入反應混合物,加熱條件:70 ℃加熱5 min,冷卻2 min。離心后加入5×Buffer(4 μL)、RNasin(0.5 μL)、1 μL M-MLV,輕輕混勻。25 ℃溫浴10 min,42 ℃溫浴50 min,95 ℃加熱5 min,終止反應。經由PCR儀完成上述過程,可得20 μL cDNA,待PCR循環結束后,馬上升溫至95 ℃,維持10 min,再降至60 ℃,維持20 s;提升至72 ℃,維持30 s,最后降至4 ℃維持5 min,此過程循環40次。采用2-ΔΔCT法計算Calnexin mRNA的相對表達量。
1.3.2 細胞凋亡情況 采用TUNEL法檢測各組細胞凋亡指數(AI)。收集各組細胞經過0.1%Trition X-100透化后,用PBS漂洗3次,每次漂洗5 min,再滴加3%H2O2200 μL,漂洗3次后,加入蛋白酶K工作液置于常溫下20 min;漂洗3次后加入TUNEL反應液(TdT+熒光素標記的dUTP)37 ℃恒溫箱中避光孵育60 min;PBS清洗3次后加入DAPI,再次應用PBS漂洗3次,最后防熒光淬滅封片劑封片。隨機移動組織切片,選取細胞分布較均勻的高倍視野計數1 000 個以上,在相鄰的10個視野下,藍色熒光為腎母細胞瘤細胞核,綠色熒光為凋亡細胞核。凋亡指數(AI)=各視野陽性細胞數/視野所有細胞總數×100%。
1.3.3 GRP78、IRE1、TRAF2、ASK1、p-ASK1、JNK及p-JNK蛋白表達 采用Western blotting法。于液氮條件下研碎細胞,提取細胞內蛋白質并定量檢測。于濃縮膠5%、分離膠10%條件下行SDS-PAGE。電泳結束后恒流200 mA轉膜90min轉印至PVDF膜。P封閉1 h后孵育一抗。加入山羊抗大鼠多克隆HRP標記二抗(1∶1 000)孵育2 h。經ECL底物發光反應后圖像保存。普通抗體的封閉液、一抗孵育液、二抗孵育液為5%脫脂奶粉溶液[7]。各目的蛋白相對表達量用目的蛋白條帶灰度值與內參照GAPDH條帶灰度值之比表示。
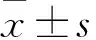
2 結果
2.1 各組Calnexin mRNA相對表達量比較 實驗組、空載體組、對照組Calnexin mRNA相對表達量分別為0.28±0.01、1.01±0.06、1.00±0.08;實驗組Calnexin mRNA相對表達量低于空載體組和對照組(P<0.05),但空載體組和對照組比較無統計學差異(P>0.05)。
2.2 各組細胞AI比較 實驗組、空載體組、對照組AI分別為32.86±3.72、5.46±0.68、5.26±0.17;實驗組AI高于空載體組和對照組(P<0.05),空載體組與對照組比較無統計學差異(P>0.05)。
2.3 各組GRP78、IRE1、TRAF2、ASK1、p-ASK1、JNK及p-JNK蛋白相對表達量比較 實驗組GRP78、IRE1、TRAF2、ASK1、p-ASK1、JNK及p-JNK蛋白相對表達量高于空載體組和對照組(P均<0.05),但空載體組與對照組比較無統計學差異(P均>0.05)。見表1。

表1 各組GRP78、IRE1、TRAF2、ASK1、p-ASK1、JNK和p-JNK相對表達量比較
注:與對照組和空質粒組比較,*P<0.05。
3 討論
腎母細胞瘤是最早發現對化療藥物敏感的兒童惡性腫瘤,目前采用放療、化療及手術等綜合治療方案已將患兒生存率由30%提升至90%以上[8,9],但放、化療對患兒產生的長期影響尚無研究報告。尋找高效、靶向治療腎母細胞瘤的治療方法是目前研究熱點,更是亟待解決的問題。ERS是近年來新發現的指標凋亡機制,現階段研究認為ERS發生的主要原因是內質網折疊蛋白功能異常,導致錯誤蛋白在內質網內堆積[5],短時間的ERS是細胞自我修復的一種方法,但長期ERS發生即可引起細胞凋亡。
Calnexin/鈣網織蛋白(Calreticulin)循環是內質網內穩態體系的重要組成部分,對錯誤折疊的糖蛋白重新折疊起關鍵作用,而難以糾正構象的糖蛋白為避免在內質網過度堆積造成危害,則在內質網甘露糖苷酶Ⅰ作用下從Calnexin/Calreticulin循環中釋放出來,與受體蛋白EDEM結合;后者通過Sec61p通道進入細胞質,在泛素-蛋白酶體系中將其降解,這一過程稱為糖蛋白內質網相關性降解[10]。研究證實,惡性腫瘤細胞已耐受缺氧所引發的ERS,減少腫瘤細胞對ERS的耐受性,使腫瘤細胞更傾向于凋亡,可能成為治療腎母細胞瘤的新靶點[11,12]。JNK信號通路是絲裂原活化蛋白激酶家族中重要的通路之一,存在于多種生命活動過程中且易受多種細胞外應激因素激活并介導細胞凋亡。已有證據表明,JNK信號通路參與了過度ERS所引發的細胞凋亡[13,14]。因此,沉默Calnexin可能引發SK-NEP-1細胞加重ERS,打破內質網耐受平衡,進而激活JNK信號通路,介導SK-NEP-1細胞凋亡。
本研究用Calnexin shRNA沉默Calnexin基因表達,結果顯示轉染后實驗組細胞Calnexin mRNA相對表達量明顯降低,驗證了沉默效果。用TUNEL法觀察各組細胞凋亡情況,結果實驗組細胞凋亡明顯增多,與本研究團隊提出的假說相符,也與Ryan的研究結果相似[15]。為探討沉默Calnexin誘導SK-NEP-1細胞凋亡的機制,本研究進一步采用Western blotting法檢測各組細胞中ERS標志物GRP78及JNK信號通路相關蛋白RE1、TRAF2、ASK1、p-ASK1、JNK、p-JNK表達,結果顯示,沉默Calnexin的實驗組細胞GRP78、IRE1、TRAF2、ASK1、p-ASK1、JNK及p-JNK表達升高,這說明沉默Calnexin可使細胞內ERS標志物GRP78表達增高,并激活JNK信號通路的表達,打破腎母細胞瘤SK-NEP-1細胞原本對ERS耐受的平衡,增加JNK信號通路的活化及磷酸化水平,誘導腎母細胞瘤SK-NEP-1細胞凋亡。進一步驗證了本研究團隊提出的假說。
綜上所述,本研究雖然證實沉默Calnexin可通過 IRE1/TRAF2/ASK1/p-ASK1/JNK/ p-JNK信號通路誘導腎母細胞瘤SK-NEP-1細胞凋亡。但ERS所引發的信號通路較多[16],沉默Calnexin對SK-NEP-1細胞其他凋亡通路的影響尚不得而知。下一步的研究將更深入的探討Calnexin和腎母細胞瘤的關系,為腎母細胞瘤的臨床治療提供新靶點和新思路。
[1] 蔣也平,沈穎,孫寧.174例腎母細胞瘤臨床特點及生存分析[J].首都醫科大學學報,2009,30(2):137-141.
[2] 張峰.內質網分子伴侶Calnexin的研究進展[J].生物學通報,2008,43(8):7-10.
[3] 賈宇鵬,何苗,魏敏杰.GRP78在腫瘤發生發展及干性形成中的研究進展[J].生命的化學,2015,35(4):559-564.
[4] 曾惠愛,劉先領.內質網應激與腫瘤細胞凋亡[J].腫瘤防治研究,2013,40(2):206-208.
[5] 王伊林,趙雅君,楊洋,等.磷酸肌酸鈉對慢病毒介導Calumenin蛋白沉默阿霉素損傷心肌細胞內質網應激信號通路的作用[J].臨床心血管病雜志,2015,31(10):1119-1122.
[6] Kim SH, Kim KY, Yu SN, et al. Silibinin induces mitochondrial NOX4-mediated endoplasmic reticulum stress response and its subsequent apoptosis[J]. BMC Cancer, 2016,16(1):452.
[7] 王伊林,單曉彤,柴花,等.丹參酮ⅡA磺酸鈉腹腔注射對阿霉素心肌病大鼠心功能及左室纖維化的影響[J].山東醫藥,2016,56(7):34-36.
[8] Green DM, Breslow NE, Beckwith JB, et al. Treatment with nephrectomy only for small, stage I/favorable histology Wilms′tumor: a report from the National Wilms′Tumor Study Group[J]. J Clin Oncol, 2001,19(17):3719-3724.
[9] 何珂駿,張勤,袁曉軍,等.61例兒童腎母細胞瘤的診斷治療與隨訪[J].上海交通大學學報(醫學版),2014,34(6):890-893.
[10] 林勝利,李載權,唐朝樞.Calnexin/Calreticulin循環與糖蛋白內質網應激相關性降解[J].醫學分子生物學雜志,2004,1(5):298-301.
[11] 葉建新,劉聲源,莊金福.新輔助化療對進展期胃癌手術并發癥的影響[J].腫瘤防治研究,2014,41(9):1026-1030.
[12] Ghadban T, Jessen A, Reeh M, et al. In vitro study comparing the efficacy of the water-soluble HSP90 inhibitors, 17-AEPGA and 17-DMAG, with that of the nonwater-soluble HSP90 inhibitor, 17-AAG, in breast cancer cell lines[J]. Int J Mol Med, 2016,38(4):1296-1302.
[13] 趙珊,馬迎春,劉亞坤,等.姜黃素通過抑制內質網應激和JNK通路過度活化減輕小鼠肺缺血再灌注損傷[J].中國病理生理學,2013,29(2):308-313.
[14] 孔宏亮,苗志林,李占全,等.阿霉素對心肌肌醇依賴酶I-JNK通路的影響[J].中國組織化學與細胞化學雜志,2013,22(1):66-70.
[15] Ryan D, Carberry S, Murphy AC, et al. Calnexin, an ER-induced protein, is a prognostic marker and potential therapeutic target in colorectal cancer[J]. J Transl Med, 2016,14(1):196.
[16] Zhou XM , Qing X, Wang YL, et al. Total flavonoids of astragalus play a cardioprotective role in viral myocarditis[J]. Acta Cardiol Sin, 2016,32(1):81-88.
Effectsofsilencingcalnexinonapoptosis,endoplasmicreticulumstress,andJNKsignalingpathwayofhumannephroblastomacells
SUNWeizeng,LINGuoxiong,LINHai
(HainanProvincialPeople′sHospital,Haikou570311,China)
ObjectiveTo investigate the effects of silencing calnexin on the apoptosis, endoplasmic reticulum stress, and JNK signaling pathway of human nephroblastoma cells.MethodsThe nephroblastoma SK-NEP-1 cells were divided into the control group, empty vector group, and experimental group. The cells in the control group were not transfected. The cells in the empty vector group were transfected with the blank plasmid, and the experimental group with Calnexin shRNA. After 24-hour transfection, all were replaced with normal culture medium and then were cultured for 48 h. The expression of Calnexin mRNA was detected by real-time fluorescence quantitative PCR. The apoptotic index (AI) was detected by TUNEL method. Western blotting was used to detect the relative expression of glucose-regulated protein 78 (GRP78), inositol-requiring enzyme 1 (IRE1), tumor necrosis factor receptor-associated factor 2 (TRAF2), apoptosis signal-regulating kinase 1 (ASK1), p-ASK1, c-Jun N-terminal kinase (JNK) and phosphorylated c-Jun N-terminal kinase (p-JNK) protein.ResultsThe relative expression of calnexin mRNA was 0.28±0.01, 1.01±0.06, and 1.00±0.08 in the experimental group, empty vector group, and control group, respectively. The experimental group was lower than the empty vector group and the control group (P<0.05), but there was no significant difference between the empty vector group and the control group (P>0.05). AI in the experimental group, empty vector group, and control group were 32.86±3.72, 5.46±0.68, and 5.26±0.17; the experimental group was higher than the empty vector group and the control group (P<0.05), but there was no significant difference between the empty vector group and the control group (P>0.05). The relative expression levels of GRP78, IRE1, TRAF2, ASK1, p-ASK1, JNK and p-JNK were higher in the experimental group than those in the empty vector group and the control group (allP<0.05), but there was no significant difference between the empty vector group and the control group (P>0.05).ConclusionSilencing calnexin can lead to endoplasmic reticulum stress and activate JNK cell apoptosis pathway, and thus promote the apoptosis of nephroblastoma SK-NEP-1 cells.
nephroblastoma; calnexin; apoptosis; endoplasmic reticulum stress; JNK signaling pathway
海南省自然科學基金資助項目(20168283)。
孫為增(1982-),男,碩士,主治醫師,主要研究方向:小兒外科常見疾病的發病機制及治療。E-mail: HNsunweizeng@163.com
林海(1978-),男,碩士,副主任醫師,主要研究方向:腎母細胞瘤的治療。E-mail: linhai2317@163.com
10.3969/j.issn.1002-266X.2017.40.006
R737.11
A
1002-266X(2017)40-0022-04
2016-11-01)

