護腸清毒微丸對慢加急性肝衰竭大鼠肝損傷的治療效果及作用機制
孫歡娜,張向磊,石建美,田瑞淵
(1山東中醫藥大學附屬醫院,濟南250014;2青島市海慈醫療集團;3山東中醫藥大學第一臨床學院;4山東大學齊魯醫院)
護腸清毒微丸對慢加急性肝衰竭大鼠肝損傷的治療效果及作用機制
孫歡娜1,張向磊2,3,石建美3,田瑞淵4
(1山東中醫藥大學附屬醫院,濟南250014;2青島市海慈醫療集團;3山東中醫藥大學第一臨床學院;4山東大學齊魯醫院)
目的探討護腸清毒微丸對慢加急性肝衰竭大鼠肝損傷的治療效果及其作用機制。方法將Wistar大鼠分為正常對照組、模型組、乳果糖組及護腸清毒微丸低、中、高劑量組。除正常對照組外,其余各組均制備慢加急性肝衰竭模型,乳果糖組及護腸清毒微丸低、中、高劑量組自肝衰竭造模后分別灌胃給予0.81 g/(kg·d)乳果糖及3.4、6.8、13.5 g/(kg·d)護腸清毒微丸,均連續給藥4周。給藥結束后12 h,收集各組尿液及血液標本。觀察各組給藥過程中一般狀況,統計肝衰竭造模后第28天各組死亡情況。檢測血清ALT、AST、PA、TBIL,血漿內毒素,凝血酶原活動度(PTA),血清炎性因子TNF-α、IL-1、IL-6、IL-8、IL-10,血漿D-乳酸、二胺氧化酶(DAO),尿乳果糖/甘露醇(L/M)。結果正常對照組處理過程中精神狀態好,體質量增加較快;其他組造模過程中毛發凌亂、無光澤,飲食量少,活動少,甚至呼吸急促、球結膜水腫、死亡;護腸清毒微丸各組及乳果糖組隨著灌胃給藥時間的延長上述癥狀逐漸改善,以高劑量組改善最為明顯。至肝衰竭造模后第28天,模型組死亡率高于其他各組,護腸清毒微丸中劑量組死亡率高于乳果糖組(P均<0.05)。與正常對照組比較,其他組血清ALT、AST、TBIL及血漿內毒素水平均升高,血清PA、PTA水平均降低;與模型組比較,護腸清毒微丸低、中、高劑量組及乳果糖組血清ALT、AST、TBIL及血漿內毒素水平均降低,血清PA、PTA水平均升高;與乳果糖組比較,護腸清毒微丸低、中、高劑量組血清ALT、AST、TBIL及血漿內毒素水平均降低,血清PA、PTA水平均升高;組間比較P均<0.05。與正常對照組比較,其他組血清TNF-α、IL-1、IL-6、IL-8、IL-10、D-乳酸、DAO及尿L/M水平均升高;與模型組比較,護腸清毒微丸低、中、高劑量組及乳果糖組均降低;與乳果糖組比較,護腸清毒微丸低、中、高劑量組均降低;組間比較P均<0.05。護腸清毒微丸高劑量組上述指標變化均較低、中劑量組顯著(P均<0.05)。結論護腸清毒微丸可抑制慢加急性肝衰竭大鼠肝損傷, 抑制炎性細胞因子釋放、糾正腸黏膜通透性、穩定內環境、阻斷腸源性內毒素血癥的發生等可能是其作用機制。
慢加急性肝衰竭;護腸清毒微丸;腸源性內毒素血癥;腸黏膜屏障
腸源性內毒素是肝功能衰竭發生的物質基礎[1]。腸源性內毒素血癥與肝損害互為因果關系,內毒素不僅加重肝損害,而且是促進門脈高壓、腎損害等多器官病變的重要因素[2]。護腸清毒微丸具有健脾調腸、化瘀解毒等功效,可用于腸源性內毒素血癥的治療,但其作用機制尚未明確[3,4]。2015年10月~2016年6月,我們探討護腸清毒微丸結腸靶向給藥對慢加急性肝衰竭大鼠腸源性內毒素血癥的治療效果及其作用機制。
1 材料與方法
1.1 材料 雄性Wistar大鼠120只,4周齡,體質量80~100 g,購于山東魯抗集團,動物合格證編號SCXK(魯)20130009。護腸清毒微丸(0.3 g/粒)由山東中醫藥大學附屬醫院制劑室負責制劑和質量控制,藥物組成包括云苓、大黃、黃芩、赤芍、甘草等。乳果糖(0.3 g/粒)由山東中醫藥大學附屬醫院制劑室負責制劑和質量控制。乳果糖標準品、甘露醇標準品、羧甲基纖維素鈉,IL-1、IL-2、IL-6、IL-8、IL-10試劑盒,ALT、AST、前白蛋白(PAlb)、總膽紅素(TBIL)檢測試劑盒均購自山東博科生物產業有限公司。
1.2 動物分組及處理 取10只大鼠作為正常對照組;其余110只制作慢加急性肝衰竭模型。造模方法:首先采用人血白蛋白(HSA)多點注射致敏制備肝纖維化模型,具體方法參考文獻[5];然后以D-氨基半乳糖(D-gal)/脂多糖聯合急性攻擊肝纖維化大鼠,建立與人慢加急性肝衰竭形態學表現相似的實驗動物模型,具體方法參考文獻[6]。造模過程中15只死亡,余95只隨機編碼并分為5組,分別為模型組、護腸清毒微丸低劑量、護腸清毒微丸中劑量組、護腸清毒微丸高劑量、乳果糖組,每組19只。乳果糖組及護腸清毒微丸低、中、高劑量組自造模后開始連續灌胃,分別給予13.5 g/(kg·d)乳果糖及3.4、6.8、13.5 g/(kg·d)護腸清毒微丸(采用0.5%羧甲基纖維素鈉溶液配成混懸液),均在每天上、下午8點各灌胃1次,連續給藥4周。正常對照組及模型組以相同體積的蒸餾水灌胃。給藥結束后12 h,利用代謝籠收集各組尿液,離心后取上清液,備用;將各組給予戊巴比妥鈉溶液腹腔注射麻醉,待麻醉滿意后沿腹正中線打開腹腔,暴露門靜脈,結扎肝門口處門靜脈,以取血針抽取門靜脈血1 mL,裝入抗凝管中待檢內毒素;下腔靜脈取血,3 000 r/min離心15 min,取上清液,-80 ℃冰箱保存備檢。
1.3 相關指標觀察 ①一般狀況及死亡情況:觀察并記錄各組給藥過程中一般狀況,如體質量、被毛光澤度、大便、活動情況等統計造模后第28天各組死亡情況。②肝功能指標:采用奧林巴斯AU5400生化分析儀檢測血清ALT、AST、PA、TBIL,具體步驟參照試劑盒說明書。③血漿內毒素:采用動態濁度法檢測血漿內毒素。④凝血酶原活動度(PTA):采用Stago血凝儀檢測PTA。⑤炎性因子:采用ELISA法檢測血清TNF-α、IL-1、IL-6、IL-8、IL-10。⑥腸通透性指標:采用ELISA法檢測血清D-乳酸,采用雙抗體夾心法檢測血二胺氧化酶(DAO)活性,采用高效液相色譜法檢測尿乳果糖/甘露醇(L/M)。
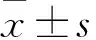
2 結果
2.1 各組造模后一般狀況及死亡情況 正常對照組處理過程中精神狀態好,飲食飲水量多,體質量增加較快,毛發有光澤。其他各組在造模過程中毛發凌亂、無光澤,飲食量少,活動少,對外界刺激反應遲鈍;隨著造模時間增加,上述狀態持續加重,且出現呼吸急促、球結膜水腫,部分出現呼吸微弱、不能站立等瀕死癥狀。護腸清毒微丸各組及乳果糖組大鼠隨著灌胃給藥時間的延長上述癥狀逐漸改善,以高劑量組改善最為明顯。至給藥處理后第28天,模型組死亡14只(73.7%),護腸清毒微丸小、中、高劑量組分別為9只(47.3%)、5只(26.3%)、4只(21.1%),乳果糖組為7只(36.8%),模型組死亡率均高于其他各組,護腸清毒微丸低劑量組死亡率高于護腸清毒微丸中、高劑量組及乳果糖組(P均<0.05)。
2.2 各組肝功能指標比較 與正常對照組比較,其他組血清ALT、AST、TBIL水平均升高,血清PAlb水平均降低;與模型組比較,護腸清毒微丸低、中、高劑量組及乳果糖組血清ALT、AST、TBIL水平均降低,血清PAlb水平均升高;乳果糖組及護腸清毒微丸低、中、高劑量組血清ALT、AST、TBIL水平逐漸降低,血清PAlb水平逐漸升高;組間比較,P均<0.05。見表1。

表1 各組血清ALT、AST、PAlb、TBIL水平比較
2.3 各組血漿內毒素及PTA水平比較 與正常對照組比較,護腸清毒微丸各組與乳果糖組血漿內毒素水平均升高、PTA均降低;與模型組比較,護腸清毒微丸低、中、高劑量組與乳果糖組血漿內毒素水平均降低、PTA均升高;與乳果糖組比較,護腸清毒微丸低、中、高劑量組血漿內毒素水平均降低,護腸清毒微丸中、高劑量組PTA均升高;護腸清毒微丸中、高劑量組血漿內毒素水平均低于、PTA水平均高于護腸清毒微丸低劑量組;組間比較,P均<0.05。見表2。

表2 各組血漿內毒素及PTA水平比較
2.4 各組血清炎癥因子水平比較 與正常對照組比較,其他組血清TNF-α、IL-1、IL-6、IL-8、IL-10水平均升高;與模型組比較,護腸清毒微丸低、中、高劑量組及乳果糖組上述指標均降低;乳果糖組及護腸清毒微丸低、中、高劑量組上述指標均逐漸降低;組間比較,P均<0.05。見表3。
2.5 各組血清D-乳酸、DAO水平及尿L/M比較 與正常對照組比較,其他組血清D-乳酸、DAO水平及尿L/M均升高;與模型組比較,護腸清毒微丸低、中、高劑量組及乳果糖組上述指標均降低;與乳果糖組比較,護腸清毒微丸中、高劑量組上述指標均降低;護腸清毒微丸高劑量組上述指標均低于低、中劑量組;組間比較,P均<0.05。見表4。
3 討論
慢加急性肝衰竭是指在慢性肝病基礎上短期內發生急性肝功能失代償的臨床癥候群,臨床主要表現為極度乏力、明顯的消化道癥狀、黃疸迅速加深、出血傾向、失代償性腹水、伴或不伴有肝性腦病等。慢加急性肝衰竭發病機制復雜,病情進展迅速,病死率極高[7]。近年來,腸源性內毒素血癥對于慢加急性肝衰竭的發展和轉歸逐漸被學者認同。生理狀態下,肝臟具有很強的內毒素滅活能力[8],一旦肝臟受損,其對內毒素滅活的能力下降,則可誘發腸源性內毒素血癥[9];腸道微生態失衡、腸道菌群易位是產生內毒素的重要原因。肝病患者存在細菌過度繁殖、腸道菌群結構改變[10],同時腸道蠕動能力、機械清除能力和屏障功能減弱,導致大量內毒素被吸收[11]。肝衰竭—腸道菌群失調—腸道屏障功能受損—腸源性內毒素血癥形成一個惡性循環, 在慢加急性肝衰竭的發生、發展、 維持、惡化過程中發揮主導作用。

表3 各組血清TNF-α、IL-1 、IL-6、 IL-8、 IL-10水平

表4 各組血清D-乳酸、DAO水平及尿L/M比較
研究證實,應用腸道微生態調節劑、乳果糖或拉克替醇等可改善肝衰竭患者預后,減少腸道細菌易位、降低內毒素血癥可能是其作用機制[7]。目前,腸源性內毒素血癥的治療多采用乳果糖。乳果糖是一種不被胃腸黏膜雙糖酶分解的人工合成雙糖,可酸化腸道,調節腸道菌群,抑制嗜堿性有害菌群繁殖,減少腸道內毒素產生;乳果糖作為一種輕瀉劑可增加腸蠕動,促進腸道內腐敗物質排出,減少內毒素等有害物質進入血循環,達到防治腸源性內毒素血癥的目的[12];但長時間應用可導致腸道酸堿平衡失調。研究證實,中醫藥可通過調節免疫紊亂、改善肝臟微循環、修復腸黏膜屏障、恢復腸道微生態,阻斷腸源性內毒素血癥的發生、發展[13]。護腸清毒微丸是根據中醫理論,結合慢加急性肝衰竭腸源性內毒素血癥發生的病機特點,即本虛標實,以脾虛為本,濕、熱、瘀、毒為標,制備的具有健脾護腸、清熱涼血、化瘀解毒之效的方藥;藥物組成包括云苓、大黃、黃芩、赤芍、薏苡仁、甘草等。方中茯苓健脾益氣滲濕;大黃瀉熱涼血,解毒逐瘀;黃疸諸火瘡。云苓、大黃為君藥,既能健脾清腸,又可清熱涼血、化瘀解毒。薏苡仁健脾利水滲濕,使脾健濕自化;黃芩清熱燥濕;赤芍清熱涼血、活血化瘀。薏苡仁、黃芩、赤芍共為臣藥,助君藥以健脾活血、清熱化濕、涼血解毒。甘草為佐使之藥以調和諸藥,又可補脾益氣、清熱解毒、緩急止痛。
本研究結果顯示,模型組血清ALT、AST、TBIL快速升高,PA迅速降低,說明其肝臟功能急劇惡化,肝細胞大量壞死,一般狀態差;給予護腸清毒微丸及乳果糖組肝指標均較模型組改善、一般狀態好于模型組,死亡率低于模型組,且護腸清毒微丸組上述指標均好于乳果糖組,其中以護腸清毒微丸高劑量組[13.5 g/(kg·d)]效果最好;說明護腸清毒微丸可抑制慢加急性肝衰竭大鼠肝損傷,效果優于乳果糖,且呈劑量依賴性。
慢加急性肝衰竭患者發生腸源性內毒素血癥時,機體釋放大量TNF-α、IL-1、IL-6、IL-8、IL-10等促炎細胞因子[14,15],誘發持續性炎癥反應,并不斷自我增強,形成瀑布級聯反應,造成對肝臟的二次打擊[16],導致肝細胞大量壞死,表現為肝功能急劇惡化。清除內毒素及減少炎癥介質釋放對阻斷病情進展,改善肝功能具有重要意義。凝血酶原是由肝臟合成的維生素K依賴因子,是血液凝固因子之一。PTA是判斷肝細胞壞死嚴重程度及患者預后的敏感指標。本研究模型組血清TNF-α、IL-1、IL-6、IL-8、IL-10水平及血漿內毒素水平均顯著升高,PTA水平下降。給予護腸清毒微丸及乳果糖干預大鼠炎性因子及血漿內毒素水平均顯著下降,PTA水平升高;且護腸清毒微丸效果優于乳果糖,乳果糖高劑量組效果優于低、中劑量組。上述結果提示,護腸清毒微丸能夠清除內毒素,抑制炎性細胞因子釋放,穩定內環境,阻止炎癥反應進展,防止肝細胞凋亡、壞死。
血漿 DAO和D-乳酸水平可反映腸黏膜損屏障功能[17]。D-乳酸是胃腸細菌發酵的代謝產物,生理情況下很少被吸收,且哺乳動物不具備將其快速降解的酶系統。當腸黏膜通透性增加時,血漿D-乳酸水平升高。DAO是小腸絨毛上皮細胞的胞內氧化酶,當腸黏膜細胞受損壞死時該酶釋放入血,導致血漿DAO活性增高[18]。腸道通透性是最直接和最準確的反映腸黏膜功能的量化指標。腸黏膜通透性改變可使腸道吸收乳果糖增加,但對甘露醇的吸收無明顯變化。L/M測定是上最常用的評估腸黏膜通透性的無創診斷方法[19]。本研究結果顯示,護腸清毒微丸能夠顯著降低慢加急性肝衰竭大鼠血清D-乳酸、DAO水平及尿L/M水平,說明護腸清毒微丸可改善腸黏膜通透性,修復腸黏膜屏障,且效果好于乳果糖。
綜上所述,護腸清毒微丸可抑制慢加急性肝衰竭大鼠肝損傷,抑制炎性細胞因子釋放、糾正腸黏膜通透性、穩定內環境、阻斷腸源性內毒素血癥的發生等可能是其作用機制。
[1] 韓德五.腸源性內毒素血癥所致“繼發性肝損傷”的臨床依據[J].世界華人消化雜志,1999,7(12):1055-1058.
[2] 高方媛,王憲波.腸源性內毒素血癥在肝衰竭發生發展中的作用[J].臨床肝膽病雜志,2014,30(8):825-828.
[3] 毛毛,李勇,黃書婷.大黃解毒湯灌腸治療慢性乙型病毒性肝炎腸源性內毒素血癥45例[J].陜西中醫,2010,31(5):515-516.
[4] Li Y, Wang L, Su CH, et al. Clinical observation on the treatment of chronic severe hepatitis B by retention enema with huchang Jiedu Decoction[J]. Chin J Integr Med, 2010,16(4):348-352.
[5] 王寶恩,王志富,殷蔚荑,等.實驗性免疫性肝纖維化模型的研究[J].中華醫學雜志,1989,69(9):503-505.
[6] 張文中,劉旭華,趙軍,等.慢加急性肝衰竭大鼠血TNF-α、白介素-10及肝細胞凋亡的動態變化[J].中國血液凈化,2007,6(9):496-499.
[7] 中華醫學會感染病學分會肝衰竭與人工肝學組.肝衰竭診治指南(2012年版)[J].實用肝臟病雜志,2013,16(3):210-216.
[8] 汪承柏.重視慢性肝炎內毒素血癥的防治[J].中西醫結合肝病雜志,2001,11(4):193-194.
[9] Ding LA, Li JS, Li YS, et al. Intestinal barrier damage caused by tra-uma and lipopolysaccharide[J]. World J Gastroenterol, 2004,10(16):2373-2378.
[10] 袁林艷,吳亞云,李宏,等.微生態制劑治療肝衰竭內毒素血癥的研究進展[J].世界華人消化雜志,2013,21(14):1286-1291.
[11] Bauer TM, Schwacha H, Steinbrückner B, et al. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia[J]. Am J Gastroenterol, 2002,97(9):2364-2370.
[12] 占國清,譚華炳,劉翔,等.肝康Ⅱ號聯合乳果糖保留灌腸治療乙肝相關性肝衰竭腸源性內毒素血癥[J].中國中西醫結合消化雜志,2015,23(4):270-275.
[13] 張向磊,胡冬青,孫歡娜,李勇.護腸清毒微丸結腸靶向給藥降低血漿內毒素及TNF-α、IL - 6、 IL-8臨床研究[J].吉林中醫藥,2016,36(9):891-893.
[14] 杜立樹,平龍玉,張曼俐.細胞因子在乙肝相關性肝衰竭患者中的表達意義[J].中國中西醫結合消化雜志,2017,25(2):144-147.
[15] 陳海芬.慢性乙型肝炎和肝功能衰竭患者血清 IL-32、IL-6、IL-8檢測的意義[J].現代實用醫學,2015,27(4):474-475.
[16] 盧琳琳,陸偉,胡東勝,等.急性肝衰竭大鼠腸黏膜屏障功能變化特點分析[J].山東醫藥,2012,52 (39):51-53.
[17] 杜春武.阿德福韋酯聯合谷氨酰胺治療對乙肝肝硬化患者免疫功能及腸黏膜屏障的影響[J].四川解剖學雜志,2015,23(4):27-34.
[18] 張妮,朱保權,張慶立.危重癥患兒血漿 D-乳酸水平和二胺氧化酶活性與胃腸功能障礙關系研究[J].臨床兒科雜志,2006,24(10):794-796.
[19] 李鑫,王晨,聶嬌,等.酒精性肝炎小鼠肝腸組織變化與內毒素血癥的關系探討[J].實用肝臟病雜志,2013,16(3):254-256.
TherapeuticeffectandmechanismofHuchangQingdupelletsintreatmentofliverinjuryofratswithacute-on-chronicliverfailure
SUNHuanna1,ZHANGXianglei,SHIJianmei,TIANRuiyuan
(1TheAffiliatedHospitalofShandongUniversityofTraditionalChineseMedicine,Jinan250014,China)
ObjectiveTo investigate the therapeutic effects and possible mechanism of Huchang Qingdu pellets in treatment of liver injury of rats with acute-on-chronic liver failure (ACLF).MethodsWistar rats were divided into the normal control group, model group, lactulose group, and Huchang Qingdu pellet groups (including low-, medium- and high-dose groups) randomly. In addition to the normal control group, we made ACLF models in the other groups. Rats in the lactulose group, the low-, medium- and high-dose Huchang Qingdu pellet groups were given 0.81 g/(kg·d) lactulose, 3.4, 6.8, and 13.5 g/(kg·d) Huchang Qingdu pellets, respectively, for 4 weeks. At 12 h after the end of the administration, urine and blood samples were collected from each group. The general condition of the rats in each group and the death of each group on the 28 th day after the modeling was observed. The levels of ALT, AST, PA, TBIL, plasma endotoxin (ET), prothrombin activity (PTA), TNF-α, IL-1, IL-6, IL-8, IL-10, plasma D-lactic acid (D-LAC), diamine oxidase (DAO), and lactulose/mannitol (L/M) were detected.ResultsThe rats in the normal control group had good mental state and the body weight increased rapidly. In the process of modeling, the rats in the other groups had messy hair, dullness, less diet, less activity and even shortness of breath, conjunctival edema and death. The above symptoms in the lactulose group and Huchang Qingdu pellet groups were improved over the time of intragastric administration, and the rats in the high-dose group were the most significant. On the 28th day after the modeling, the mortality rate in the model group was higher than those in the other groups. The mortality rate of the medium-dose group was higher than that of the lactulose group (P<0.05). Compared with the normal control group, the levels of serum ALT, AST, TBIL and plasma endotoxin increased, and the levels of serum PA and PTA decreased. Compared with the model group, the levels of serum ALT, AST, TBIL and plasma endotoxin in the lactulose group, the low-, medium- and high-dose Huchang Qingdu pellet groups decreased, and the levels of serum PA and PTA increased. Compared with the lactulose group, the serum levels of ALT, AST, TBIL and plasma endotoxin in the low-, medium- and high-dose Huchang Qingdu pellet groups decreased, and the serum PA and PTA levels increased (allP<0.05). The serum levels of TNF-α, IL-1, IL-6, IL-8, IL-10, D-LAC, DAO, and urinary L/M increased in the other groups as compared with those of the the normal control group; compared with the model group and the lactulose group, the low-, medium- and high-dose Huchang Qingdu pellet groups were lower (allP<0.05). The changes of the above indexes in the high-dose group were significantly lower than those in the medium- and low-dose groups (allP<0.05).ConclusionsHuchang Qingdu pellets can prevent liver injury of ACLF rats by inhibiting the release of inflammatory cytokines, improving the permeability of intestinal mucosa, stabilizing the internal environment, and blocking the occurrence of intestinal endotoxemia.
acute-on-chronic liver failure; Huchang Qingdu pellets; intestinal endotoxemia; intestinal mucosal barrier
山東省自然科學基金資助項目(ZR2015PH055)。
孫歡娜(1980-),女,主治醫師,主要研究方向:肝膽病的中西醫結合治療。E-mail: nana_huan191@163.com
李勇(1958-),女,主任醫師,教授,博士生導師,主要研究方向:肝膽病的中西醫結合治療。E-mail: liy1958@163.com
10.3969/j.issn.1002-266X.2017.40.003
R575.3
A
1002-266X(2017)40-0009-05
2017-05-02)

