術前子宮動脈介入化療栓塞術對宮頸癌患者腫瘤切除率及生存質量的影響
楊卉
·論著·
術前子宮動脈介入化療栓塞術對宮頸癌患者腫瘤切除率及生存質量的影響
楊卉
目的觀察術前子宮動脈介入化療栓塞術對宮頸癌患者腫瘤切除率及生存質量的影響。方法將90例宮頸癌患者按治療方法分為直接手術組和動脈介入化療組,每組45例。觀察動脈介入化療組化療前后腫瘤大小變化及化療不良反應,比較2組手術情況,于手術后檢測血清血管內皮生長因子(VEGF)含量及宮頸癌組織VEGF、天冬氨酸蛋白水解酶3(Caspase-3)、天冬氨酸蛋白水解酶9(Caspase-9)、腫瘤壞死因子α誘導蛋白(TNFAIP8)、過氧化物還原酶4(Prdx4)表達水平,比較2組術后1年生活質量評分及術后3年復發率、淋巴結轉移率及生存率。結果化療后,動脈介入化療組腫瘤最大徑(2.79±1.64)cm,較化療前(5.28±0.56)cm明顯縮小(Plt;0.05),且不良反應輕微。動脈介入化療組較直接手術組根治性切除率明顯提高(Plt;0.05),術后淋巴結轉移率明顯降低(Plt;0.05)。手術后,動脈介入化療組較直接手術組血清VEGF-A、VEGF-C、VEGF-D含量明顯降低,宮頸癌組織VEGF-A、VEGF-C、VEGF-D、TNFAIP8、Prdx4表達水平明顯降低,Caspase-3、Caspase-9表達水平明顯升高,差異均有統計學意義(Plt;0.05)。術后3年,動脈介入化療組較直接手術組復發率、淋巴轉移率及生存率均明顯降低(Plt;0.05)。此外,2組術后1年生活質量評分比較無差異統計學意義(Pgt;0.05)。結論宮頸癌患者行術前子宮動脈化療栓塞術,可有效縮小腫瘤體積,提高腫瘤根治性切除率,促進癌細胞凋亡,降低血清轉移浸潤指標,改善遠期療效,且未影響患者生活質量。
宮頸癌;子宮動脈介入化療栓塞術;腫瘤切除率;生存質量
宮頸癌是一種女性常見的惡性腫瘤,其發病率高居所有女性惡性腫瘤第4位,且正呈逐年上升趨勢,是導致女性死亡的第二大原因[1]。年輕的宮頸癌患者普遍對生育能力保留有強烈愿望,所以根治性手術已成為其臨床上首選治療方法。已有研究表明,宮頸癌患者行根治性子宮切除術5年生存率最高可達90%[2]。隨著宮頸癌早期篩查工作的開展,使得宮頸癌早期發現率有顯著提高,然而部分患者的腫瘤體積較大,手術切除存在困難,且術后易出現復發及轉移,并影響預后。近年研究表明,化療在宮頸癌治療中可發揮重要作用,尤其是術前新輔助介入化療,已成為宮頸癌不可或缺的輔助治療手段[3,4]。術前新輔助化療可有效減小巨塊型腫瘤體積,顯著提高腫瘤切除率,并有效預防腫瘤浸潤及淋巴結轉移[5]。術前子宮動脈化療栓塞術為常見的新輔助化療手段之一,本研究旨在探討術前子宮動脈介入化療栓塞術對宮頸癌患者腫瘤切除率及存活質量的影響,報告如下。
1 資料與方法
1.1 一般資料 病例來源于2010年12月至2013年12月在我院接受治療的90例宮頸癌患者。納入標準:(1)均經組織學檢查確診為宮頸癌;(2)國際婦產科聯盟(FIGO)分期屬于ⅠB2期或ⅡA2期;(3)均為首次接受治療;(4)卡氏(KPS)評分70分以上;(5)腫瘤最大直徑≥4 cm;(6)治療前均簽署研究知情同意書。排除標準:(1)既往存在其他類型惡性腫瘤史者;(2)心、肝、腎功能異常者;(3)存在嚴重基礎疾病者;(4)凝血功能異常者;(5)輔助檢查存在遠處轉移灶者;(6)均無介入手術及化療禁忌癥。本研究取得我院醫學倫理委員會批準,將入組患者按治療方法分為動脈介入化療組和直接手術組,每組45例。2組一般資料比較差異無統計學意義(Pgt;0.05)。見表1。

表1 2組一般資料比較 n=45
1.2 方法
1.2.1 直接手術組:直接行手術治療。術前行血常規、電解質、心肝腎功能檢查,不存在明顯異常時,給予全身麻醉,并行廣泛全子宮切除術+盆腔及腹主動脈旁淋巴結清掃術,同時視患者具體情況選擇行卵巢移位術。對于年輕鱗癌患者,通常選擇保留卵巢,并予以卵巢移位;腺癌患者經與醫生進行有效溝通后,選擇切除或保留一側卵巢。子宮切除術后,根據本院治療經驗,對于存在盆腔淋巴結、腹主動脈旁淋巴結、宮旁轉移或切緣陽性等高危因素者,予以術后輔助放化療;對于同時存在宮頸深部間質浸潤及脈管瘤栓高危因素者,予以術后輔助放療。
1.2.2 動脈介入化療組:術前給予子宮動脈介入化療栓塞術,由股動脈穿刺插管入對側髂內動脈,在造影下使子宮動脈得以顯示,將化療藥物注入靶血管,注入量為總藥物量的一半,接著將導管退出,待腹主動脈成袢后,于髂內動脈插入,造影下將余下藥物注入靶血管。根據患者病理類型選擇不同化療方案,鱗癌:藥物組成為長春新堿、博來霉素、順鉑、絲裂霉素,劑量分別為1 mg/m2、25 mg/m2、60 mg/m2、10 mg/m2;腺癌或腺鱗癌:藥物組成為阿霉素、順鉑,劑量分別為30 mg/m2、70 mg/m2。首次給藥2周后再重復給藥1次。化療完成3周后,行血常規、肝腎功能、心電圖、影像學等檢查,排除手術禁忌后,予以廣泛全子宮切除術+盆腔及腹主動脈旁淋巴結清掃術,同時視患者具體情況選擇行卵巢移位術。后續治療原則同直接手術組。
1.3 觀察指標 (1)瘤體直徑:動脈介入化療組于化療前后采用超聲檢測瘤體直徑;(2)術前化療不良反應;(3)手術情況:主要包括手術時間、術中出血量、根治性手術率及術后淋巴結轉移率;(4)VEGF、促凋亡分子、抗凋亡分子表達:分別于治療前及手術后采用酶聯免疫吸附法檢測患者血清血管內皮生長因子A(VEGF-A)、VEGF-C、VEGF-D含量,并于術后采集宮頸組織,采用免疫組化法檢測血管內皮生長因子(VEGF)、天冬氨酸蛋白水解酶3(Caspase-3)、天冬氨酸蛋白水解酶9(Caspase-9)、腫瘤壞死因子α誘導蛋白(TNFAIP8)、過氧化物還原酶4(Prdx4)表達水平;(5)生存質量:術后1年,采用歐洲腫瘤研究與治療中心宮頸癌患者生活質量問卷評價患者生活質量,評分越高代表生存質量越好;(6)遠期療效:統計2組術后3年復發率、淋巴結轉移率及生存率。

2 結果
2.1 動脈介入化療組腫瘤直徑變化及化療不良反應 化療前,動脈介入化療組腫瘤最大徑為(5.28±0.56)cm,化療后動脈介入化療組腫瘤最大徑為(2.79±1.64)cm,化療前后比較差異有統計學意義(t=9.087,Plt;0.05)。治療過程中出現白細胞減少(21/45)、血小板減少(10/45)、貧血(12/45)、胃腸道反應(28/45)、肝功能異常(9/45)、脫發(10/45)等不良反應,WHO程度不良反應程度分級均在0~Ⅱ度,經對癥處理均得到緩解,患者經順利完成治療。
2.2 2組手術情況比較 2組均順利完成手術,未出現治療相關死亡病例。動脈介入化療組較直接手術組手術時間明顯縮短,術中出血量明顯減少,術后淋巴結轉移率明顯降低,根治性手術率明顯提高,差異均有統計學意義(Plt;0.05)。見表2。

表2 2組手術情況比較 n=45
2.3 2組治療前及手術后血清VEGF-A、VEGF-C、VEGF-D含量比較 治療前,2組血清VEGF-A、VEGF-C、VEGF-D含量比較差異無統計學意義(Pgt;0.05);手術后,2組血清VEGF-A、VEGF-C、VEGF-D含量較治療前均明顯降低(Plt;0.05),且動脈介入化療組較直接手術組血清VEGF-A、VEGF-C、VEGF-D含量明顯降低(Plt;0.05)。見表3。


組別VEGF-AVEGF-CVEGF-D動脈介入化療組 治療前26.54±3.719.34±1.1311.43±1.65 手術后11.26±1.92*#3.25±0.57*#4.46±0.68*#直接手術組 治療前27.48±4.239.74±1.1212.31±1.94 手術后19.36±2.84*6.36±0.87*7.86±0.91*
注:與治療前比較,*Plt;0.05;與直接手術組比較,#Plt;0.05
2.4 2組手術后宮頸癌組織VEGF-A、VEGF-C、VEGF-D表達水平比較 手術后,動脈介入化療組較直接手術組宮頸癌組織VEGF-A、VEGF-C、VEGF-D表達水平均明顯降低,差異有統計學意義(Plt;0.05)。見表4。


組別VEGF-AVEGF-CVEGF-D動脈介入化療組8.36±1.144.24±0.8311.41±1.52直接手術組 11.96±2.417.84±0.9118.84±2.61t值9.05819.60716.502P值lt;0.05lt;0.05lt;0.05
2.5 2組手術后宮頸癌組織促凋亡分子與抗凋亡分子表達水平比較 手術后,觀察組較對照組宮頸癌組織Caspase-3、Caspase-9表達水平明顯升高(Plt;0.05),TNFAIP8、Prdx4表達水平明顯降低(Plt;0.05)。見表5。


組別Caspase-3Caspase-9TNFAIP8Prdx4動脈介入化療組67.12±8.9251.89±7.7322.48±4.0211.21±1.54直接手術組 36.42±5.9733.42±5.3446.84±7.7118.12±2.54t值19.18713.1888.44015.605P值lt;0.05lt;0.05lt;0.05lt;0.05
2.6 2組生存質量評分比較 術后1年,2組生存質量各維度評分比較差異無統計學意義(Pgt;0.05)。見表6。
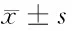
表6 2組生存質量評分比較 n=45,分,
2.7 2組復發率及生存率比較 觀察組術后3年復發率、淋巴轉移率、生存率分別為13.33%、15.56%、93.33%,均明顯大于對照組的37.78%、42.22%、77.78%,差異有統計學意義(Plt;0.05)。見表7。
3 討論
宮頸癌為常見婦科惡性腫瘤之一,其標準治療手段為外科手術聯合術后放化療,但放療遠期毒副作用明顯[6]。近年來,新輔助化療引起臨床廣泛重視,其聯合手術已成為一種新的治療方案。新輔助化療是指針對局部惡性腫瘤患者予以術前化療,尤其適用于腫瘤最大徑4 cm以上的宮頸癌患者,其旨在縮小腫瘤體積,減少高危因素,為手術順利進行創造有利條件[7]。其主要優勢:(1)控制腫瘤體積,減少宮旁、脈管浸潤,改善腫瘤分期,擴大手術適應證;(2)縮短手術時間,減少術中出血量;(3)增加微小病灶清除率,有效預防后期復發;(4)預先評價腫瘤化療效果,從而為術后治療提供參考;(5)抑制癌細胞活力,降低術中播散及術后轉移發生率[8,9]。國外有學者給予局部晚期宮頸癌患者術前新輔助化療,化療方案為紫杉醇+順鉑方案,緩解率、完全緩解率分別為90.7%、39.5%,化療后全部患者均順利完成手術[10]。子宮動脈介入化療栓塞術常用新輔助化療方案之一,本研究對45例宮頸癌患者予以子宮動脈介入化療栓塞術,由股動脈穿刺插管入對側髂內動脈,并經造影顯示子宮動脈,將化療藥物注入靶血管,并根據病理類型不同,選擇不同化療方案。本研究納入患者均屬于ⅠB2期或ⅡA2期,瘤體積較大(最大徑≥4 cm),易出現淋巴結轉移,造成預后不良。研究表明,腫瘤大小是影響手術效果及預后的重要因素[11]。本研究顯示,經化療后,動脈介入化療組腫瘤最大徑明顯縮小,且化療無嚴重不良反應,患者可耐受,這表明宮頸癌患者術前行子宮動脈化療栓塞術是安全有效的。

表7 2組術后3年復發率及生存率比較 n=45,例(%)
任紅英等[12]研究顯示,新輔助化療組與單純手術組手術時間比較差異無統計學意義(Pgt;0.05)。某前瞻性研究顯示,新輔助化療組較單純手術組術中出血量明顯增多[13]。另有研究表明,術前行動脈介入化療,可有效降低術中出血量[14]。本研究結果顯示,動脈介入化療組較直接手術組手術時間明顯縮短,術中出血量明顯減少,與上述報道存在差異,考慮是由手術醫師水平和熟練程度存在差異造成的;此外,動脈介入化療組較直接手術組術后淋巴結轉移率明顯降低;由此可見,術前子宮動脈化療栓塞術可有效改善手術情況。提高腫瘤切除率是術前輔助化療的重要目標。莊晴晴等[15]研究表明,宮頸癌患者術前行輔助化療,手術切除率可達100%。楊學剛等[16]研究顯示,子宮動脈化療栓塞可提高腫瘤切除率,且效果優于靜脈化療。本研究中,動脈介入化療組腫瘤根治性切除率為91.11%,明顯高于直接手術組的71.11%,表明術前子宮動脈化療栓塞術可有效提高宮頸癌患者腫瘤切除率。
多數癌細胞有著浸潤性生長的特點[17]。手術僅能夠將可見病灶切除,無法徹底清除經局部新生血管及淋巴結轉移與浸潤的癌細胞,故宮頸癌患者術后易復發及淋巴結轉移。新輔助化療除可有效縮小腫瘤體積外,也可抑制局部血管及淋巴管生長,殺傷浸潤及轉移腫瘤細胞,從而提高手術對腫瘤清除效果。VEGF家族在血管及淋巴管生長上發揮著重要作用,VEGF-A可促進局部血管生長,VEGF-C、VEGF-D則可介導淋巴管新生[18]。本研究結果顯示,術后,動脈介入化療組較直接手術組血清及宮頸癌組織VEGF-A、VEGF-C、VEGF-D表達水平均明顯降低,這表明術前子宮動脈介入化療栓塞術可有效抑制VEGF表達,影響局部血管及淋巴管新生。除充當浸潤生長通路外,新生血管及淋巴管亦可為癌細胞輸送營養及氧氣,促進癌細胞生長。術前子宮動脈化療栓塞術不但可發揮直接殺死癌細胞的作用,并可將腫瘤組織供血血管栓塞,使得癌細胞缺血缺氧而出現損傷。細胞凋亡為殺傷癌細胞的共同途徑,化療藥物及栓塞均可經多種途徑促使Caspase-9分子激活,并通過凋亡信號傳遞而使Caspase-3活化,從而促使癌細胞凋亡[19]。本研究結果顯示,動脈介入化療組較直接手術組宮頸癌組織Caspase-3、Caspase-9水平明顯升高,表明術前子宮動脈介入化療栓塞術可提高促凋亡因子水平,介導癌細胞凋亡。抗凋亡分子可拮抗促凋亡機制,發揮癌細胞保護作用。已有研究證實,TNFAIP8、Prdx4可抑制癌細胞凋亡[20]。本研究結果顯示,動脈介入化療組較直接手術組宮頸癌組織TNFAIP8、Prdx4表達水平明顯降低,表明子宮動脈介入化療栓塞能夠有效降低宮頸癌組織抗凋亡能力,介導癌細胞凋亡。術后隨訪顯示,動脈介入化療組術后3年復發率、淋巴結轉移率、生存率分別為13.33%、15.56%、93.33%,均明顯優于對照組的37.78%、42.22%、77.78%,表明術前子宮動脈介入化療栓塞術明顯改善宮頸癌遠期療效。隨著醫學模式轉變,臨床治療效果評價不再局限于手術本身效果,癌癥患者的生存質量亦為臨床關注,本研究中2組患者術后1年生活質量比較差異無統計學意義(Pgt;0.05),表明術前子宮動脈化療栓塞術并未降低患者生存質量。
綜上所述,術前子宮動脈栓塞術可為宮頸癌患者手術治療創造有利條件,提高腫瘤根治性切除率,促進細胞凋亡,降低血清轉移浸潤因子,明顯改善術后3年復發率、淋巴轉移率,提高生存率,且未降低患者生活質量。
1 Tewari KS,Sill MW,Penson RT,et al.Improved survival with bevacizumab in advanced cervical cancer.New England Journal of Medicine,2014,370:734-743.
2 謝珊莉,唐乾坤,劉貴.腹腔鏡下保留盆腔自主神經在早期宮頸癌根治術中的應用價值.西部醫學,2015,27:1720-1722.
3 王亮亮,李玉芝,王麗華.紫杉醇聯合奈達鉑術前輔助治療局部晚期宮頸癌30例.蚌埠醫學院學報,2015,40:1330-1332.
4 姚威.白蛋白結合型紫杉醇聯合奈達鉑化療治療晚期、復發轉移性宮頸癌近遠期療效及安全性.湖南師范大學學報(醫學版),2017,14:90-93.
5 張云,朱勇,李小花.術前新輔助化療結合放療治療局部晚期宮頸癌療效觀察.醫學臨床研究,2016,33:950-952.
6 齊曼,宋冀,鄭艷杰.調強放療與三維適形放療治療局部晚期宮頸癌的臨床療效及毒副作用觀察.實用癌癥雜志,2015,30:698-700.
7 李霞.新輔助化療在宮頸癌治療中的應用效果觀察.山西醫藥雜志,2016,45:1180-1182.
8 王蘭.新輔助化療治療宮頸癌的療效評價.實用藥物與臨床,2016,19:952-955.
9 陳曉琴,廖綺琳,陳梅英,等.新輔助化療治療局部晚期子宮頸癌的臨床療效評價.現代中西醫結合雜志,2015,24:852-854.
10 Irani S,Ahmadi F,Javam M,et al.Outcome of isolated fetal choroid plexus cyst detected in prenatal sonography among infertile patients referred to Royan Institute:A 3-year study.Iranian Journal of Reproductive Medicine,2015,13:571-576.
11 劉丹,程雪花.年輕女性宮頸癌患者臨床特征與早期宮頸癌預后因素分析.熱帶醫學雜志,2017,17:32-34.
12 任紅英.新輔助化療聯合手術治療宮頸癌的效果及對患者生存質量的影響.實用癌癥雜志,2017,32:458-460.
13 Lee DW,Lee KH,Lee JW,et al.Is neoadjuvant chemotherapy followed by radical surgery more effective than radiation therapy for stage IIB cervical cancer.International Journal of Gynecological Cancer,2013,23:1303-1310.
14 陸佳紅,張薏,陸麗紅,等.新輔助化療在Ⅰb2和Ⅱa期宮頸癌治療中的療效觀察.現代婦產科進展,2017,26:210-212,215.
15 莊晴晴,王常玉.新輔助化療與單純手術在局部晚期宮頸癌患者中的療效對比分析.現代婦產科進展,2016,25:7-10.
16 楊學剛,許國輝,吳戈,等.子宮動脈化療栓塞治療局部晚期宮頸癌.中華放射學雜志,2013,47:735-738.
17 Bogani G,Cromi A,Serati M,et al.A prospective case-control study on the impact of neoadjuvant chemotherapy on surgery-related outcomes of laparoscopic radical hysterectomy.Anticancer Research,2014,34:5703-5708.
18 黃璇,張詢.宮頸癌預后相關分子標志物的研究進展.腫瘤防治研究,2016,43:806-810.
19 王惠霞,李淑紅,趙宏燕.術前不同途徑新輔助化療對宮頸癌血管新生及細胞增殖的影響.海南醫學院學報,2016,22:2463-2466.
20 朱怡.宮頸癌組織中microRNA-124表達量與癌細胞生長、侵襲的相關性研究.海南醫學院學報,2016,22:1999-2002.
Effectsofpreoperativeuterinearterialchemoembolizationontumorresectionrateandsurvivalqualityofpatientswithcervicalcancer
YANGHui.
DepartmentofObstetricsandGynecology,People’sHospitalofDangyangCity,Hubei,Dangyang444100,China
ObjectiveTo observe the effects of preoperative uterine arterial chemoembolization on tumor resection rate and quality of survival in patients with cervical cancer.MethodsNinety patients with cervical cancer were randomly divided into direct operation group and arterial intervention chemotherapy group,with 45 patients in each group.The tumor size and adverse effects caused by chemotherapy in arterial intervention chemotherap were observed before and after chemotherapy,and surgical results were compared between two groups.Moreover the content of serum vascular endothelial growth factor (VEGF) and the expression levels of VEGF,aspartic proteinase 3 (Caspase-3), aspartic proteinase 9 (Caspase-9),tumor necrosis factor α-induced protein (TNFAIP8) and peroxiredoxin 4 (Prdx4) in cervical cancer tissues were detected after surgery.The life quality score on 1 year after operation,3-year relapse rate,lymph node metastasis rate and 3-year survival rate after operation were observed and compared between the two groups.ResultsAfter chemotherapy,the maximal diameter of tumor was 2.79±1.64cm in arterial intervention chemotherapy group with mild adverse reactions,which was significantly smaller than that [(5.28±0.56)cm] before chemotherapy (Plt;0.05).As compared with that in direct operation group,the radical resection rate in arterial intervention chemotherapy group was significantly increased (Plt;0.05),moreover, lymph node metastasis rate was significantly decreased (Plt;0.05).After surgery, the serum levels of VEGF-A,VEGF-C and VEGF-D were significantly decreased in arterial intervention chemotherapy group,furthermore, the expression levels of VEGF-A,VEGF-C, VEGF-D,TNFAIP8,Prdx4 in cervical cancer tissues were significantly decreased,however, the expression levels of Caspase-3 and Caspase-9 were significantly increased,as compared with those in direct operation group (Plt;0.05). On 3 years after operation,the relapse rate,lymph node metastasis rate and survival rate in arterial intervention chemotherapy group were significantly lower than those in direct operation group (Plt;0.05).In addition,there were no significant differences in life quality scores on 1 year after operation between two groups (Pgt;0.05).ConclusionThe preoperative uterine arterial chemoembolization can effectively decrease tumor size of patients with cervical cancer,improve tumor radical resection rate and promote cancer cell apoptosis,moreover,which can reduce the serum indexes of metastasis and infiltration of tumor, and can improve long term efficacy without affecting the life quality of patients.
cervical cancer; uterine arterial chemoembolization; tumor resection rate; quality of survival
10.3969/j.issn.1002-7386.2017.23.002
444100 湖北省當陽市人民醫院婦產科
R 711.74
A
1002-7386(2017)23-3530-05
2017-09-09)

