反復種植失敗患者凍融胚胎移植的三種內膜準備方案的分析
杜彥,李潔亮,杜靜,盧惠燕,林秀峰
(中山市博愛醫院生殖中心,中山 528403)
反復種植失敗患者凍融胚胎移植的三種內膜準備方案的分析
杜彥,李潔亮,杜靜,盧惠燕,林秀峰*
(中山市博愛醫院生殖中心,中山 528403)
目的 使用GnRH-a 3.75 mg降調節激素替代、單純激素替代及自然周期內膜準備方案對提高反復種植失敗患者凍融胚胎移植(FET)妊娠率的利弊分析。 方法 選取160例(周期)行FET的反復種植失敗患者,根據內膜準備方式分為自然周期組(A組)82例、激素替代周期組(B組)36 例和降調節激素替代組(C組)42例。比較三組患者的種植率、妊娠率、流產率和生殖激素水平。 結果 A、B和C三組患者的種植率分別為23.61%、21.25%和38.78%,臨床妊娠率分別為42.68%、36.10%和61.90%;C組與A組、B組的種植率和臨床妊娠率比較差異均有統計學意義(P<0.05)。A組與B組間胚胎移植日內膜厚度差異有統計學意義[(10.40±1.81)mm vs.(9.12±1.61)mm](P<0.05)。三組患者的流產率和異位妊娠率比較,差異無統計學意義(P>0.05)。 結論 與自然周期內膜準備方案及傳統激素替代內膜準備方案比較,3.75 mg GnRH-a降調節激素替代內膜準備方式可提高反復種植失敗患者凍融胚胎移植妊娠率而不增加流產率。
反復種植失敗; 垂體降調節; 凍融胚胎移植; 子宮內膜容受性
(JReprodMed2017,26(11):1104-1108)
1983年世界上第一例冷凍胚胎移植獲得臨床妊娠[1],1985年第一例凍融胚胎獲得健康嬰兒出生[2]。經過30多年的努力,體外受精-胚胎移植(IVF-ET)及其衍生技術已取得了巨大的進步。盡管如此,仍有少部分夫婦助孕治療后未能獲得妊娠。胚胎著床是一個復雜的過程,有種植潛能的胚胎和具有容受性的子宮內膜是胚胎種植的必要因素。患者施行胚胎移植后,未能妊娠的最主要原因是種植失敗。對于胚胎移植后未獲妊娠的患者,本中心以<40歲連續2個周期共移植4個及以上優質卵裂期胚胎或2個及以上優質囊胚未獲妊娠稱為反復種植失敗(repeated implantation failure,RIF)。
RIF可能是由于胚胎發育異常、子宮內膜容受性差,或者多種因素影響的最終結果。夫婦間遺傳學的異常、精子缺陷、胚胎非整倍體及透明帶異常等是RIF中的胚胎因素。病理狀態的子宮內膜如宮腔粘連、子宮內膜增生癥、粘附分子及免疫因子表達的異常等都可能降低子宮內膜容受性。而肥胖、吸煙、甲狀腺功能異常、高泌乳素血癥、子宮內膜異位癥和輸卵管積水則可能對兩方面都不利。
資料與方法
一、研究對象與分組
回顧分析2016年1~10月在我中心診斷為RIF患者進行凍融胚胎移植(FET)的160個周期。納入標準:(1)<40歲連續2個周期移植4個及以上優質卵裂期胚胎或2個及以上優質囊胚種植失敗;(2)所有患者月經周期規律且經超聲或宮腔鏡證實宮腔形態正常,無子宮肌瘤、宮腔粘連、子宮內膜增生過長、子宮內膜異位癥及子宮腺肌病;(3)本次移植至少有1枚優質胚胎。排除標準:(1)子宮內膜過薄(<7 mm);(2)BMI≥26 kg/m2;(3)染色體異常;(4)內科合并癥如甲狀腺功能異常。
根據內膜準備方式分為自然周期組(A組)82例、激素替代周期組(B組)36 例和降調節激素替代組(C組)42例。比較三組患者的種植率、妊娠率、流產率和生殖激素水平。
二、研究方法
1.內膜準備:(1)自然周期組(A組):月經周期第3~5天B超檢查排除卵巢囊腫,依據患者月經周期長短,月經第9~11天再次B超監測卵泡大小,當卵泡直徑≥14 mm,內膜厚度≥6 mm時,持續監測尿或者血LH值,必要時肌肉注射HCG10 000 U誘導排卵。排卵后第3天FET卵裂期胚胎,第5天移植囊胚。排卵后給予地屈孕酮(達芙通,雅培,荷蘭)20 mg,bid,肌肉注射HCG 2 000 U,q3 d×3次行黃體支持;(2)激素替代周期組(B組):月經的第3~4天B超監測內膜情況,如內膜厚度>5 mm則不入組參與最后的實驗數據統計。當日給予補佳樂(含戊酸雌二醇1 mg,拜耳,德國)2片,bid,連續服藥7 d,第8天監測內膜厚度,如厚度>6 mm則繼續原用藥劑量,如厚度<6 mm,加藥至每次3片,bid連續服藥5 d。第12天時再次監測內膜,厚度<8 mm則加藥至每次4片,bid,總服藥周期最長不超過3周,3周后如內膜厚度仍<8 mm,則取消周期。當服藥天數≥12 d,內膜厚度≥8 mm時,監測血清雌二醇(E2)水平,當E2>700 pmol/L時,繼續服用補佳樂并加黃體酮60 mg/d肌肉注射。排卵后第4天FET卵裂期胚胎,第6天移植囊胚。移植術后繼續補佳樂與黃體酮行黃體支持;(3)降調節激素替代組(C組):月經第1~3天排除妊娠后予GnRH-a(達菲林注射液,3.75 mg/支,博福-益普生,法國)3.75 mg肌肉注射,28 d后抽血及B超檢查,達到垂體降調節標準即E2<183.5 pmol/L、卵泡刺激素(FSH)<5 U/L、黃體生成激素(LH)<5 U/L、子宮內膜厚度<5 mm時,采用HRT方案準備內膜(方法同B 組),但黃體支持增加地屈孕酮(達芙通,雅培,荷蘭)20 mg,bid。
2.胚胎凍融和移植:胚胎凍融和移植按玻璃化冷凍操作常規解凍、復蘇。卵裂期胚胎分四級。Ⅰ級胚胎:卵裂球大小均勻,無細胞死亡,碎片<5%;Ⅱ級胚胎:卵裂球大小較均勻,碎片占5%~20%;Ⅲ級胚胎:碎片較多,占21%~50%的胚胎;Ⅳ級胚胎:卵裂球不等大,碎片>50%,胞質顆粒不均,變黑,或有大量空泡。解凍后卵裂球成活率≥50%,認為該胚胎復蘇。囊胚的質量通過鏡下形態學觀察進行評定,根據內細胞團和滋養層細胞進行質量評估。內細胞團分級:A 級,細胞數目多,排列緊密;B 級,細胞數目少,排列松散;C 級,細胞數目很少。滋養層細胞分級:A 級,上皮細胞層由較多的細胞組成,結構致密;B 級,上皮細胞由不多的細胞組成,結構松散;C級,上皮細胞層由稀疏的細胞組成。本中心優胚標準:卵裂期7~9細胞Ⅰ級和Ⅱ級胚胎,囊胚評分為3AB及以上胚胎。患者均按衛生部的規定移植1~3 個復蘇胚胎。
3.觀察指標及妊娠結局判斷:移植后繼續用藥至第12~14天測血HCG≥25 U/L且持續升高,2周后B超監測孕囊,確定是否臨床妊娠;臨床妊娠確認后持續黃體支持至孕8~12周。早期流產率為移植后3個月內流產人數與臨床妊娠人數的比值;胚胎種植率=種植胚胎數/移植胚胎數× 100%。
三、統計學方法
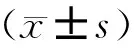
結 果
一、患者一般情況比較
共納入患者160例,其中A組82例,B組36例,C組42例。患者年齡、體重指數(BMI)、卵巢基礎狀態、移植胚胎數、移植優質胚胎數等一般情況均符合正態分布,經檢驗組間差異均無統計學意義(P>0.05)。移植日子宮內膜厚度自然周期與激素替代周期有統計學差異(P<0.05)(表1)。
二、胚胎移植后臨床妊娠率、早期流產率、胚胎種植率及異位妊娠率比較
三組間異位妊娠率、早期流產率均無統計學差異(P>0.05),自然周期組與激素替代周期組患者的臨床妊娠率、胚胎種植率無統計學差異(P>0.05);但是降調節激素替代組的臨床妊娠率、胚胎種植率與自然周期組、激素替代周期組有統計學差異(P<0.05)(表2)。

表1 各組患者一般情況及各項觀察指標的比較
注:與B組比較,*P<0.05
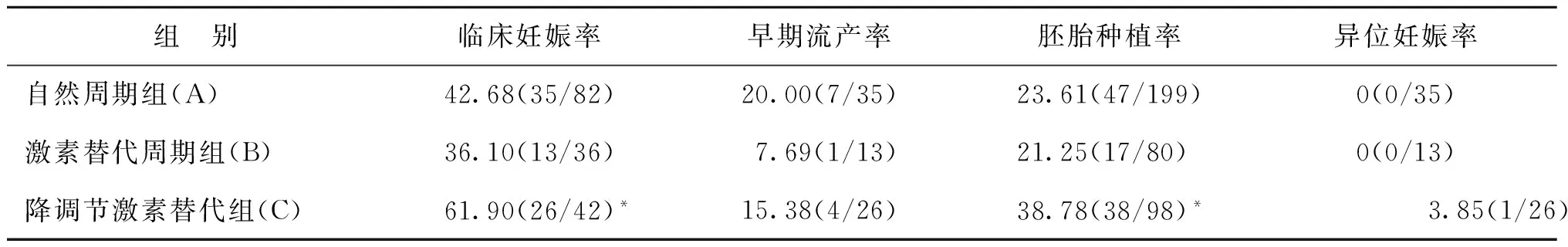
表2 三組患者移植后臨床妊娠率、早期流產率、胚胎種植率及異位妊娠率(%)
注:與A組及B組比較,*P<0.05
討 論
FET的成功妊娠明顯增加了IVF-ET的累積妊娠率。在國家全面二孩政策出臺后,FET為許多有冷凍胚胎的高齡患者提供了妊娠的希望。在胚胎予以冷凍保存的情況下,子宮內膜條件的好壞直接關系FET技術的成功與否。目前,FET內膜準備方案主要有自然周期、激素替代、降調節激素替代、促排卵周期等。臨床上可依據患者的原發疾病、依從性、經濟能力等選擇不同的方案。
自然周期是FET中最為常見的子宮內膜準備方案,符合胚胎著床的生理要求,且實施方便、花費少。是月經周期規律且有正常排卵患者最經濟有效的方案。正常生理過程中,受精卵著床經過定位、黏附和侵入三個過程,但子宮僅有一個極短的窗口期允許受精卵著床,稱為種植窗,多為LH峰后7~11 d,非常短暫[3]。因此監測過程中需要反復觀察患者尿液或血液的LH數值及卵泡發育情況以確定準確的排卵及種植窗開啟時間,其過程繁瑣,尤其是患者出現卵泡不破裂黃素化時更難監控,周期取消率高。另有少部分患者可能出現空卵泡,只有形態學改變,沒有雌激素、孕激素的周期變化,妊娠率也會下降。在本研究中對于RIF患者,自然周期組的妊娠率較激素替代組高,但沒有統計學意義,不建議做為常規選擇方案。
激素替代周期多用于排卵障礙或者子宮內膜薄的患者。激素替代周期中患者復診的次數明顯減少,而且可依據患者的工作安排適當調整就診及手術時間,同時避免因排卵異常導致的取消周期。但是單純在早卵泡期添加外源性雌激素無法保證垂體被完全抑制,雌激素的增加可能負反饋誘發內源性早發LH 峰,從而影響子宮內膜微環境狀態,降低子宮內膜容受性[4]。其次,激素替代周期依靠外源的雌、孕激素維持妊娠,較自然周期黃體支持用藥劑量大、時間長,患者的經濟負擔會有所增加。雖然在本研究中患者的流產率較低,但統計學無差異,不建議作為RIF的首選方案。
降調節激素替代是在FET前給予GnRH-a降調節預處理后再使用激素替代周期行內膜準備。GnRH廣泛分布于神經、內分泌、生殖、消化系統和免疫系統,通過傳遞信息,使各系統達到協調統一。當GnRH-a與腦垂體上的GnRH受體結合初期會促進其分泌FSH和LH,引起用藥初期的激發作用,而在用藥5~7 d后FSH和LH開始下降,14 d內降低到基礎值以下,體內的雌激素處于早卵泡期甚至達絕經期水平,卵巢呈現靜止狀態,可抑制早發LH峰的出現,獲得更高的臨床妊娠率和活產率[5];Huang 等[6]的研究表明,子宮內膜間質細胞及上皮細胞均存在GnRH受體,體外細胞培養實驗中,它能夠激活絨毛膜滋養層和底蛻膜細胞上的尿激酶型纖維蛋白溶解酶,調控子宮內膜間質蛋白水解,從而有利于內膜蛻膜化和早期囊胚著床[7]。Taskin等[8]的研究提示GnRH-a降調節后行激素替代周期中,在予孕激素替代第5天行子宮內膜活檢發現,子宮內膜胞飲突成熟發育數目較非GnRH-a激素替代周期組顯著增多且治療反應性增強,妊娠率提高。洪宇等[9]研究表明GnRH-a可以增加子宮內膜整合素avβ3 的表達,整合素avβ3 可以通過介導滋養層細胞與子宮內膜上皮細胞之間的相互作用,參與囊胚黏附,使胚胎植入子宮內膜,從而提高子宮內膜容受性。故GnRH-a不僅可使卵泡發育同步化,而且可增加子宮內膜容受性。因此,降調節激素替代可減少自發卵泡發育,降低取消率,使子宮內膜更易接受外源性激素調控,改善胚胎種植環境,還可靈活安排胚胎移植時間。
RIF的發生機制尚未明確,有不少的研究認為與免疫因素有關。對于存在免疫異常的患者,在FET中使用GnRH-a降調節,可部分逆轉Th2類細胞因子,從而使Th1/Th2比例達到平衡,由此促進母胎免疫耐受,避免種植失敗及妊娠丟失。Yang等[10]、方穎等[11]、吳曉燕等[12]研究表明,對于RIF患者,使用降調節激素替代周期較其他內膜準備方案顯著提高胚胎種植率、臨床妊娠率及繼續妊娠率。
本研究通過回顧性分析也得出相同的結論:對于RIF患者FET時使用降調節激素替代周期的胚胎種植率和臨床妊娠率高于激素替代周期與自然周期。
但是,由于長效GnRH-a的價格較高,使用此方案延長了患者FET的準備時間,增大了藥物的使用,增加了患者的經濟負擔。因此,我們在臨床上并不將其作為首選的FET方案。但對于RIF的患者可最終提高 FET 的妊娠率,可作為首選。
[1] Trounson A,Mohr L.Human pregnancy following cryopreservation,thawing and transfer of an eight-cell embryo[J].Nature,1983,305:707-709.
[2] Cohen J,Simons RF,Fehilly CB,et a1.Birth after replacement of hatching blastocyst cryopreserved at the expanded blastocyst stage[J].Lancet,1985,16:647-659.
[3] Marcus SF,Ledger WL.Efficacy and safety of long-acting GnRH agonists in in vitro fertilization and embryo transfer[J].Hum Fertil(Camb),2001,4:85-93.
[4] 張波,顏軍昊.胚胎反復著床失敗的病因及處理措施[J].生殖與避孕,2014,34:564-570.
[5] Eltoukhy T,Taylor A,Khalaf Y,et al. Pituitary suppression in ultrasound-monitored frozen embryo replacement cycles.A randomised study[J].Hum Reprod,2004,19:874-879.
[6] Huang HY,Raga F,Kruessel JS,et al. Gonadotropin-releasing hormone messenger ribonucleic acid and protein expression in Vero cells[J].J Assist Reprod Genet,2001,18:268-275.
[7] Liu J,Maccalman CD,Wang YL,et al. Promotion of human trophoblasts invasion by gonadotropin-releasing hormone(GnRH) I and GnRH Ⅱ via distinct signaling pathways[J].Mol Endocrinol,2009,23:1014-1021
[8] Taskin O,Akkoyunlu G,Simsek M,et al. Comparing the effects of GnRH-a on endometrial receptivity in patients undergoing ART and prepared frozen embryo transfer cycles[J].Fertil Steril,2002,78:S232.
[9] 洪宇,謝梅青,王良岸,等.GnRH-a對內異癥術后患者黃體中期子宮內膜整合素avβ3和PR 表達的影響[J].中華婦產科雜志,2010,45:699-701.
[10] Yang X,Huang R,Wang YF,et al. Pituitary suppression before frozen embryo transfer is beneficial for patients suffering from idiopathic repeated implantation failure[J].HuaZhong Univ Sci Technolog Med Sci,2016,36:127-131.
[11] 方穎,洪黎明,楊曉葵.降調節聯合激素替代周期方案在多次胚胎種植失敗患者凍融胚胎移植周期中的應用[J].首都醫科大學學報,2015,35:1-4.
[12] 吳曉燕,李志凌,林虹,等.多次胚胎移植失敗患者采用凍融胚胎移植3種內膜準備方案結局分析[J].中國計劃生育學雜志,2014,22:248-254.
[編輯:谷炤]
Analysis of the outcome of three kinds of endometrial preparation protocols in frozen-thawed embryo transfer cycle in patients with repeated implantation failure
DUYan,LIJie-liang,DUJing,LUHui-yan,LINXiu-feng*
ReproductiveCenterofBoAiHospital,Zhongshan528403
Objective:To analyze the outcome of down-regulation & hormone replacement,hormone replacement only and natural cycle in frozen-thawed embryo transfer in patients with repeated implantation failure.
Methods:A total of 160 patients with repeated implantation failure were selected and divided into natural cycle(group A,n=82),hormone replacement cycle(group B,n=36) and down-regulation & hormone replacement cycle(group C,n=42).The implantation rate,pregnancy rate,abortion rate and reproductive hormone level were compared among the three groups.
Results:The implantation rate was 23.61%,21.25% and 38.78% and the pregnancy rate was 42.68%,36.10% and 61.90% in group A,B,C respectively.There were significant differences in implantation rate and pregnancy rate between Group C and the other two groups(P<0.05).There was significant difference in endometrial thickness[(10.40±1.81) mm vs.(9.12±1.61) mm]on day of transplantation between Group A and Group B(P<0.05).There were no significant differences in abortion rate and ectopic pregnancy rate among the three groups(P>0.05).
Conclusions:Compared with hormone replacement only cycle and natural cycle,pregnancy rate can be effectively improved by hormone replacement cycle after down regulation in the patients with repeated implantation failure,and it does not increase the abortion rate.
Repeated implantation failure; Down regulation; Frozen-thawed embryo transfer; Endometrial receptivity
10.3969/j.issn.1004-3845.2017.11.011
2017-08-29;
2017-09-12
杜彥,女,廣東中山人,副主任醫師,生殖醫學專業.(*
)

