CFDA2017新《醫療器械分類目錄》淺析*
麻 良 黃軍斌 王 菲 崔澤實
CFDA2017新《醫療器械分類目錄》淺析*
麻 良①②黃軍斌③△王 菲④*崔澤實①*
目的:解讀國家食品藥品監督管理總局2017年8月31日發布的新《醫療器械分類目錄》(新《分類目錄》)。方法:借鑒美國食品藥品管理局(FDA)和歐盟醫療器械分類方法,對分類原則、層級結構等方面進行比較研究;對醫療器械分類研究報道進行文獻計量分析,揭示此項研究的聚焦度與發展特點。結果:新《分類目錄》基于臨床醫學學科分類結合功能需求的分類方法,將醫療器械分類聚焦在臨床使用上,無疑將有利于企業、醫療、監管等領域的應用;在2002年版43類的基礎上凝集為22類,另較美國FDA增加了醫用成像、放射治療、醫用軟件等6個子目錄,符合技術進展實際;檢索中國知網(2002-2017年)獲得673篇文獻,發文量基本上呈逐年增加趨勢,表明研究一直處于較活躍勢態。結論:新《分類目錄》體現以技術專業和臨床使用特點為分類原則,層級結構便于多方使用及與國際接軌,是醫療器械監管科學發展的結果。
醫療器械;分類目錄;監管;風險管理
由表1可見,在新《分類目錄》的22個子目錄中有19個與一個或以上臨床醫學二級學科或三級學科相關,而子目錄12、13兩項植入器械及子目錄15患者承載器械與多學科的臨床應用及其診療流程即“臨床使用特點”相關。因此,可以認為新《分類目錄》是基于臨床醫學學科分類結合功能需求的分類方法。把醫療器械分類聚焦在臨床使用上,無疑將有利于企業、醫療、監管等領域的應用。
1.2 采用層級結構加風險管理類別標注
對新《分類目錄》可以理解為整體上有子目錄、一級產品類別(205個)、二級產品類別(1094個;標注產品描述、預期用途)、產品品名(舉例)4層級分層結構,并將管理類別標注到品名(舉例),以有源手術器械為例,層級結構如圖1所示。
美國食品藥品管理局(Foodand Drug Administration,FDA)分類結構是在16個專業子類的基礎上,在每個子類中除總則外(Subpart A General Provisions)把此類醫療器械按產品功能及用途細分到“診斷、治療、監測、其他”4個亞類,相應的產品可在Subpart下累列[2]。以麻醉類為例分層結構如圖2所示。
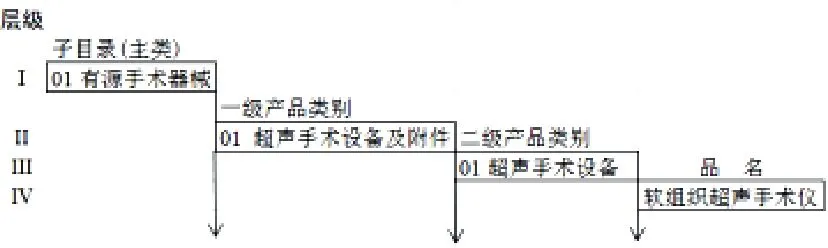
圖1 新《分類目錄》有源手術器械的層級結構圖
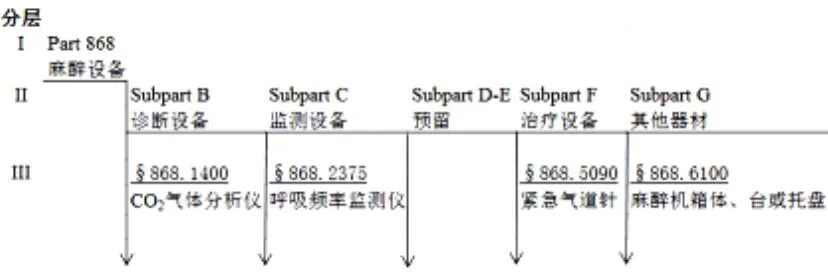
圖2 美國FDA醫療器械分類中麻醉設備類的分層結構圖
1.3 體現機制創新
目前,有關報道討論較集中在美國FDA和歐盟等分類方法[3-5]。FDA在《聯邦法規匯編》(Code of Federal Regulations)第21卷(21 CFR862-892)中列出了16大類醫療器械,歐盟委托歐洲標準化組織在參考多個國家的醫療器械分類基礎上編制了“全球醫療器械命名系統”(global medical device nomenclature,GMDN),兩者比較見表2。

表1 醫療器械分類目錄(CFDA2017年第143號)
新《分類目錄》在2002年版43類的基礎上凝集為22類,與美國FDA及GMDN分類進行比較,總體與兩者兼容,更便于與國際接軌,較美國FDA多6個類別。
(1)醫用成像器械:集合了放射學成像、磁共振成像、核醫學成像、超聲成像及窺鏡5個子類(一級產品類別),與目前國際慣用及市場研究數據歸類基本一致。
(2)放射治療器械:美國FDA與GMDN是把“診斷與治療放射設備”歸為一類,新《分類目錄》單列出此項。
(3)醫療器械消毒滅菌器械:隨著對院內感染控制的日趨重視,消毒滅菌器械滲透在醫療機構外科、口腔等諸技術環節,消毒供應中心(central sterile supply department,CSSD)已逐步成為一個重要的專業領域,制定此分類順應了醫院管理需求[6]。
(4)有源介入器械與無源介入器械:區分于低值耗材,兩類器材屬于目前慣用的“高值醫用材料”范疇[7]。由于介入放射學技術的進展及老齡化、疾病譜改變等因素驅動,市場份額逐年增長,如果統含在醫用耗材中顯然不甚合適。
(5)醫用軟件:分列此項符合對醫療器械定義的描述,應用軟件已成為醫療器械的特定產品類別;此外,醫療器械軟件帶來的醫療風險越來越引發人們注意,美國醫療技術評估機構ECRI在所發表的“Top 10 Health Technology Hazards for 2017”一文中將軟件管理列為第6位,認為“軟件管理問題將把患者和患者數據置于風險之中”[8]。
(6)醫用診察和監護器械及注輸、護理和防護器械兩個子類,也反映出此類產品臨床應用與技術發展的趨同性。
CFDA新《分類目錄》與美國FDA在二級及以下結構的分類原則上有所不同(正如圖1、圖2所示),大致可以認為CFDA是沿著醫療器械的工程學屬性向下細分,并將主設備與配套裝置、附件分別列出,便于管理;而美國FDA是在二級結構開設了4個功能區向下銜接相關產品。
綜上所述,新《分類目錄》的制定是建立在對我國前期經驗的總結優化及對國外分類方法深入分析研究的基礎上,體現機制創新。
2 新《分類目錄》彰顯醫療器械監管的科學發展
2002年版《醫療器械分類目錄》發布至今不乏有關醫療器械分類研究的報道。以“醫療器械”為主題詞并含“分類”檢索中國知網2002-2017年文獻數據,共檢索到文獻747篇,剔除報刊為673篇;其中期刊文獻472篇、會議文獻51篇、學位論文150篇。年代分布呈波折式增加,在2012年達到69篇,期刊文獻在2014年最多為53篇,之后顯見進入平臺期,如圖3所示。
由圖3可見,醫療器械分類是較為熱點的研究領域,也是學術會議交流較活躍的專題,特別是學位論文達到了150篇。諸多學者在指出2002年版《醫療器械分類目錄》存在著目錄劃分原則相互交叉、缺乏產品類別的描述與定義等需要改進之處的同時,對美國FDA、歐盟等分類方法進行了較為廣泛的比較研究[4-5,9-10]。實際上1997年CFDA就發布了《醫療器械分類目錄》,在2002年版《醫療器械分類目錄》發表后,CFDA也在不斷充實內容,如2012年CFDA發布食藥監辦械[2012]108號文件對《6823醫用超聲儀器及有關設備》、《6830醫用X射線設備》、《6831醫用X射線附屬設備及部件》、6834醫用射線防護用品、裝置》4個子目錄進行了修訂[11]。

表2 美國FDA與全球醫療器械命名系統
正是在這些研究工作的基礎上,2015年CFDA發布《醫療器械分類規則》(國家食品藥品監督管理總局令第15號),隨之《醫療器械分類目錄》的修訂工作正式啟動。表明國家醫療器械監管部門高度重視醫療器械分類研究工作,新《分類目錄》彰顯出醫療器械分類目錄制定的科學發展進程。
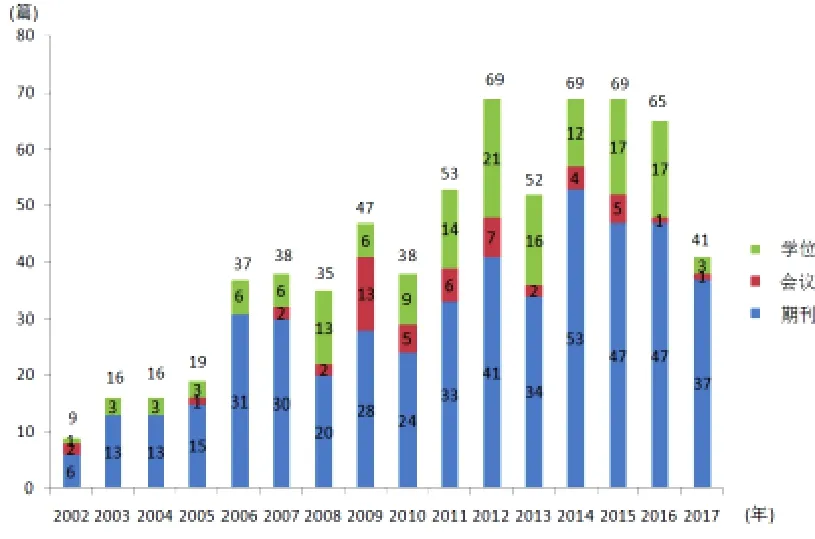
圖3 2002-2017年醫療器械分類研究文獻分布圖
3 有關思考
推行《醫療器械分類目錄》的主要目的是用于指導監管部門和企業識別產品管理類別,并作為劃分不同層級監管職能、實施不同層級注冊審批制度的重要依據[11]。但鑒于醫療器械監管是圍繞醫療器械的全生命周期進行,涉及生產、市場前管理、市場中管理、在用管理等諸環節,因此分類目錄的應用將滲透到企業、醫療衛生機構、高校及科研院所、評估機構、行業協會等領域。為全面實施新《分類目錄》,聯動相關領域工作,需要考慮以下方面。
3.1 建立分類數據的轉換機制
為有效實施新《分類目錄》,有必要在2002年版與2017年版之間開展詞目轉換研究,建立分類數據的轉換機制,為基層單位的數據庫管理提供便利條件。嘗試與美國FDA、歐盟等分類目錄的轉換研究,對開展市場數據分析等國際接軌工作會有一定幫助。
3.2 加強醫療器械代碼研究
代碼是信息管理的重要標簽,目前我國采用的醫療器械代碼不甚一致,在醫學裝備信息的收集與各渠道信息轉換上存在諸多不便[12]。早在1990年,原衛生部和國家中醫藥管理局聯合發布了《全國衛生系統醫療器械儀器設備(商品、物資)分類與代碼》(標識代號:WZB 01-90),WZB01-90是在國家標準GB7635-1987基礎上編制,作為全國衛生系統物資管理的專業標準;1999年修訂再版為《全國衛生行業醫療器械儀器設備(商品、物資)分類與代碼:WS/T118-1999》。在貫徹新《分類目錄》的同時,應同步加強醫療器械代碼研究,渴望達到全國統一使用。
3.3 盡快與醫療器械大數據研究接軌
開展大數據分析與分析工具研究、建立大數據平臺是近年我國醫學裝備行業的聚焦專題,新《分類目錄》也為醫療器械大數據研究創造了基礎條件,建議應盡快接軌,發揮大數據在我國深化醫藥衛生改革中的作用,有效服務于健康事業。
[1]馬艷紅,安慧娟.創新機制 精準分類 穩妥實施[N].中國醫藥報,2017-09-05(003).
[2]https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPCD/classification.cfm[DB/OL].
[3]周良彬,伍倚明,李偉松,等.國內外醫療器械分類管理思路和規則的對比分析[J].中國醫療器械信息,2016,22(7):26-31,35.
[4]曹青,李文,廖曉曼,等.國內外醫療器械分類管理現狀和思路簡介[J].醫療裝備,2016,29(1):56-58.
[5]張兆豐.醫療器械分類系統及方法剖析[J].中國醫療器械雜志,2010,34(6):452-454.
[6]沈逸君.醫院消毒滅菌設備概論[J].中國醫學裝備,2005,2(10):46-48.
[7]麻良,王菲,崔澤實,等.我國醫用耗材管理研究熱點的文獻計量學社會網絡分析[J].中國醫學裝備,2016,13(1):35-40.
[8]EXECUTIVE BRIEF Top 10 Health Technology Hazards for 2017[J/OL],ECRI Institute.Excerpted from:Health Devices 2016 November,www.ecri.org/2017hazards.
[9]楊昕,卓越.完善醫療器械分類方法的建議[J].中國醫療器械雜志,2015,39(06):449-450,459.
[10]付曉陽,孫利華.國外醫療器械分類管理經驗對我國的啟示[J].中國醫藥導刊,2012,14(12):2207-2208,2206.
[11]李靜莉,鄭佳,張春青,等.中國醫療器械分類目錄全面修訂的設計與思考[J].中國醫療器械雜志,2017,41(4):283-285,305.
[12]楊驍婷,陳小玲,周奕,等.醫療器械分類及編碼分析[J].中國處方藥,2013,11(6):20-22.
Brief analysis of CFDA 2017 new edition classification and catalogue of medical devices/
MA Liang, HUNAG Jun-bin, WANG Fei, et al//
China Medical Equipment,2017,14(10):130-133.
Objective: to interpret the new edition and catalogue of medical devices issued by the China Food and Drug Administration(CFDA)in August 31, 2017(new catalogue).Methods: Based on the United States FDA, EU medical device classification methods, a comparative study of the classification principle, hierarchy structure; bibliometric analysis of medical device classification research reports, focusing degree and development characteristics of the study. Results:the classification of new categories in clinical medicine was classified according to the functional requirements.The classification of medical devices focused in clinical applications, it will facilitate the applications of enterprise,medical and health institutions, regulators and other fields; on the basis of the 43 categories of the 2002 edition,aggregated into 22 categories, other than the United States FDA increase in medical imaging and radiation therapy and medical software etc 6 categories, in accordance with the recent technical progress. CNKI(2002~2017) acquired the 673 articles, articles basically increase year by year, that has been in a state of active research. Conclusion: The new catalogue of medical devices embodies the features of technical specialty and clinical applications, which is classified principle, hierarchical structure, convenient for multi-field use and acting on international standards. It is the result of scientific development of medical device supervision and administration.
Medical device; Classified catalogue; Supervision and administration; Risk management
1.College of Pharmacy, China Medical University, Shenyang, 110122,China. 2.Department of Human resource, The First Hospital of China Medical University ,Shenyang 110001, China.
10.3969/J.ISSN.1672-8270.2017.10.038
麻良,男,(1988- ),碩士,助教。中國醫科大學藥學院、中國醫科大學附屬第一醫院人力資源部,從事衛生(裝備)技術評估與社會醫學研究。
1 對新《分類目錄》的初步認知
,新《分類目錄》更貼近臨床醫學學科分類與醫學技術流程,體現以需求為導向,正如2017年第143號文件所述“新《分類目錄》按技術專業和臨床使用特點分為22個子目錄”,見表1。
2017-08-16
1672-8270(2017)10-0130-04
R197.39
A
△共同第一作者:黃軍斌
遼寧省教育廳項目(遼教發[2014]108)“生命科學(醫藥工)綜合實驗實訓平臺”;沈陽市科學技術項目(F12-264-4-01)“分子細胞計量學實驗技術數字資源共享服務平臺”
①中國醫科大學藥學院 遼寧 沈陽 110122
②中國醫科大學附屬第一醫院人力資源部 遼寧 沈陽 110001
③吉林大學公共衛生學院 吉林 長春 130021
④中國醫科大學財務處 遼寧 沈陽 110122
*通訊作者:wangfei@cmu.edu.cn;zscui@cmu.edu.cn
在國家食品藥品監督管理總局(China Food and Drug Administration, CFDA)發布2002年版《醫療器械分類與代碼》后時隔15年,于2017年8月31日又發布新版《醫療器械分類目錄》(根據CFDA2017年第143號文件以下簡稱“新《分類目錄》”),自2018年8月1日起施行。9月5日《中國醫藥導報》以“創新機制 精準分類 穩妥實施”為題報道[1]。因此,認知2017年新《分類目錄》的分類原則、基本結構以及基本要素,對貫徹實施甚為重要。
1.1 以技術專業和臨床使用特點為分類原則

