人體外周血CD3+CD4-CD8-雙陰性T細胞體外擴增的實驗研究
王新梅,王雪野,韓 梅*,肖中平
(吉林省人民醫院 1.血液科;2.腫瘤科,吉林 長春130021)
人體外周血CD3+CD4-CD8-雙陰性T細胞體外擴增的實驗研究
王新梅1,王雪野2,韓 梅1*,肖中平1
(吉林省人民醫院 1.血液科;2.腫瘤科,吉林 長春130021)
目的探討人體外周血CD3+CD4-CD8-雙陰性T細胞(DNT細胞)在體外進行分離和擴增的方法。方法取健康的成人外周血20 ml,應用Rosettesep抗體吸附法去除CD4+T細胞和CD8+T細胞;再將DNT細胞放入anti-CD3mAb包被的培養板中,并加入rhIL-2、rhIL-4,共同培養,第10天和第14天計數細胞擴增倍數及記錄擴增曲線;利用Easysep免疫磁珠法純化,采用流式細胞儀檢測其純度。結果經分選、純化后的DNT細胞,純度可達94%以上;體外培養第10天和第14天,DNT細胞擴增倍數分別為53倍和41倍。結論通過Rosettesep抗體吸附法及Easysep免疫磁珠法分離及純化DNT細胞是可行的,可獲得大量高純度的DNT細胞。
CD3+CD4-CD8-雙陰性T細胞;Rosettesep抗體吸附法;Easysep免疫磁珠法;流式細胞術
(ChinJLabDiagn,2017,21:1831)
免疫調節性T細胞是人體免疫系統產生免疫耐受的重要機制,近年來由于免疫學和分子生物學技術的飛速發展,免疫調節性T細胞越來越受到人們的關注,研究發現這類細胞在機體的自身免疫、腫瘤免疫以及器官移植等方面都具有重要的作用。目前被證實的具有調節免疫應答功能的細胞主要包括:免疫抑制性CD8+CD28-T細胞、γδTCR+T細胞、自然殺傷(NK) T細胞、CD8+否決細胞以及CD3+CD4-CD8-雙陰性T細胞(double negative T cells,DNT細胞)[1]。其中DNT細胞具有獨特的生物學功能,主要與其表面標志不同及分泌特殊的效應因子有關[2,3]。然而,DNT細胞在正常人和小鼠的外周血T淋巴細胞中的數量極少,僅占1%-2%和1%-5%[4-6],這就限制了對其功能的進一步研究。因此,對于DNT細胞的體外擴增方法及優化,成為目前亟待解決的問題。本課題研究的目的為體外分離和培養外周血DNT細胞,獲取一定數量高純度的DNT細胞,為進一步研究其作用機制奠定基礎。
1 材料和方法
1.1標本來源
每年進行健康體檢志愿者5名,其中男2名,女3名,年齡21-44歲,中位年齡33歲。于清晨、空腹、采集肝素抗凝靜脈血20 ml。
1.2試劑和儀器
抗-CD3 單抗購自美國eBioscience公司;rh IL-2,rh IL-4購自美國PEPROTECH公司;Rosettesep CD4、CD8負選試劑盒、Easysep CD4、CD8、CD56正選試劑盒、磁極均購自于加拿大STEMCELL公司;淋巴細胞分離液購自達科為生物技術有限公司;CD3-PC5/ CD4-FITC /CD8-PE,CD3-FITC/CD56-PE,流式細胞儀(EPICS XL)均產自于美國貝克曼-庫爾特公司;5 ml聚苯乙烯試管,購自于美國BD公司;多標記微孔板分析儀1420,購自美國PerkinElmer Victor公司。
1.3實驗方法
1.3.1Rosettesep抗體吸附法分離DNT細胞 新鮮肝素抗凝靜脈血20 ml,加入Rosettesep Human CD4和 CD8 Depletion Cocktail各 50 μl/mL,在室溫條件下,孵育20 min;加入PBS+2%FBS 10 ml;加入到15 ml Ficoll中,于2 300 rpm離心30 min。取上、中層交界的白色云霧狀液體層,再加入PBS+2%FBS稀釋,于1 200 rpm離心10 min,棄上清,重復2次。計數細胞,以細胞培養液調整細胞濃度為1.0×106/mL。
1.3.2DNT細胞的體外培養 準備24孔板,用anti-CD3mAb 100 ng/mL包被,封口膜封口,孵箱過夜。以適量PBS+2%FBS洗板3次,分別加入RPMI-1640,10% FBS,鏈霉素100 μg/mL,青霉素100 U/mL,rhIL-2 50 U/mL,rhIL-4 30 U/mL。將細胞濃度調整為1×106個/mL的DNT細胞加入24孔板,每孔加2 ml。每3天換液1次。共培養10-14天。
1.3.3DNT細胞的純化 收集24孔板中細胞,計數細胞并調整細胞濃度為1×108個/mL,放入聚苯乙烯試管中,加入Easysep Human CD4 Positive Selection Cocktail 、Easysep Human CD8 Positive Selection Cocktail、 Easysep Human CD56 Positive Selection Cocktail 各100 μl/mL,在室溫條件下進行孵育,15 min,再于聚苯乙烯試管中分別加入磁珠50 μl/mL,混勻,室溫避光,孵育10 min,再加入Robosep Buffer,至總體積為2.5 ml,放入磁極中5 min,將所需要的DNT細胞倒入新的試管中,重復3次,加入2 ml Robosep Buffer,1 200 rpm,離心10 min。
1.3.4免疫熒光染色及流式細胞儀檢測 取細胞懸液100 μl,分別加入CD3-PC5/CD4-FITC /CD8-PE,CD3-FITC /CD56-PE各20 μl,室溫避光孵育15 min,加入冷PBS洗滌,1 500 rpm離心,10 min,棄上清,加入0.5 ml的PBS,混勻。采用EPICS-XLII流式細胞儀進行檢測,收集細胞數5×106個/管。上機前對流式細胞儀進行光流路質量調控,雙色熒光補償,Listmode形式保存文件,應用CellQuest軟件分析結果。
2 結果
2.1DNT細胞的體外培養
細胞培養第7、10、14天,鏡下可見培養板底大量圓形核深染細胞,細胞數量及克隆現象逐漸增多,第10天達高峰,第14天可見細胞凋亡現象。
2.2DNT細胞的流式細胞儀檢測結果
采用Rosettesep抗體吸附法分離DNT細胞,流式細胞儀檢測CD3+CD4-CD8-T細胞比例為94.4%(圖1)。體外擴增及Easysep免疫磁珠法純化后的CD3+CD4-CD8-T細胞純度可達99.2%(圖 2)。

2.3DNT細胞的體外擴增
將細胞培養至d7,d10,d14,計算擴增倍數。結果顯示細胞培養至d10生長最旺盛,延長培養時間,細胞數逐漸減少。第0天,第4天,第7天,第10天,第14天,DNT細胞數分別為8×106個,8×107個,3.12×108個,4.24×108個,3.28×108個。DNT細胞擴增倍數分別為0倍,10倍,39倍,53倍,41倍(圖3)。
3 討論
DNT細胞,是一群既不表達CD4分子,也不表達CD8分子的調節性T細胞,通過抗原特定因子的方式,來抑制免疫應答的發生[7]。大量的研究表明,DNT細胞具有抑制腫瘤生長的作用,有望成為一種新型的腫瘤過繼細胞免疫治療方法。目前,一些免疫學專家認為,能夠使調節T細胞活化的刺激因素主要為T細胞受體(TCR),這種受體對調節性T細胞起刺激性作用,對其功能造成影響。但是,DNT細胞與其他種類的調節性T細胞不同,因其本身不表達共受體CD4和CD8,也不表達共刺激分子CD28[8]。另外,一些專家學者指出,細胞因子等對于DNT細胞的激活和DNT細胞發揮的功能都具有重要的作用[9]。DNT 細胞能夠在體外存活,需要有外源性的IL-2和IL-4的參與刺激,同時IL-4也具有保護DNT細胞的作用,避免發生和TCR交叉刺激,從而發生細胞的凋亡[10,11]。有研究者基于體外容易得到的人外周血單個核細胞,用 CD3抗體成功在體外擴增活化T淋巴細胞,并且CD3抗體可增加淋巴細胞轉化,并與濃度有關[12]。
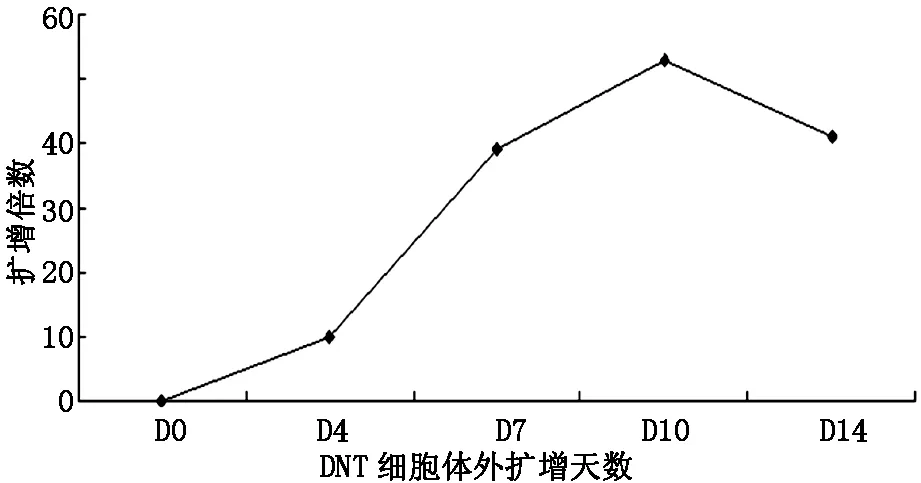
圖3 DNT細胞體外擴增的生長曲線
在實驗研究中我們采用的擴增方法為通過anti-CD3mAb包被培養板,起到了人工APC的作用,能夠減少異體APC所帶來的各種差異,以及異體免疫細胞的污染,減少因異體排斥反應所引起的增殖減低,加上rhIL-2和rhIL-4,方法簡便,有利于大批量擴增及應用。但此種方法受限于不能長期培養,在培養14天左右細胞數就逐漸下降,所以本實驗方法有待于進一步改進。Ford Mclntyre等[13]研究發現,同種異體的APC可以有效的激活DNT細胞,使DNT細胞在體外進行擴增,通過穿孔素途徑可以引起同種異體或同種同體的B細胞的凋亡。在我們的實驗中也同樣見到的細胞凋亡現象,考慮與B細胞的凋亡有關。
傳統的細胞分選的技術,如流式細胞術,十分昂貴,而且對于DNT細胞的分選費時較多, 從而影響了細胞的活性,不利于細胞的進一步培養及應用。免疫磁珠法分選細胞是通過磁極和包被不同的抗體,可進行幾乎所有細胞亞群的分離和純化,不僅簡便靈活,而且經濟省時,并且對于細胞造成的損傷也小,有利于分離后的培養和應用。本實驗采用Rosettesep抗體吸附法和Easysep免疫磁珠法獲得的DNT細胞,純度大于94%,可保證對于DNT細胞體外培養擴增以及對DNT細胞抗腫瘤等作用研究的實驗要求。
通過本研究得到的純度高并且數量多的DNT細胞,使接下來研究DNT細胞發揮免疫調節功能和對腫瘤的抑制作用的分子機制奠定了理論基礎。
[1]Xu H,Lauer FT,Liu KJ,et al.Environmentally relevant concentrations of arsenite and monomethylarsonous acid inhibit IL-7/STAT5 cytokine signaling pathways in mouse CD3+CD4-CD8-double negative thymus cells [J].Toxicol Lett,2016,4(15):247,62.
[2]Yeh S,Li Z,Sen HN,et al.Scleritis and multiple systemic autoimmune manifestations in chronic natural killer cell lymphocytosis associated with elevated TCRalpha/beta+CD3+CD4-CD8-double-negative T cells[J].Br J Ophthalmol,2010,94(6):748.
[3]Voelkl S,Gary R,Mackensen A.Characterization of the immunoregulatory function of human TCR-αβ+CD4-CD8-double-negative T cells [J].Eur J Immunol,2011,41(3):739.
[4]Lai ZW,Borsuk R,Shadakshari A,et al.Mechanistic target of rapamycin activation triggers IL-4 production and necrotic death of double-negative T cells in patients with systemic lupus erythematosus[J].J Immunol,2013,191(5):2236.
[5]Hillhouse EE,Beauchamp C,Chabot-Roy G,et al.Interleukin-10 limits the expansion of immuno regulatory CD4-CD8- T cells in autoimmune-prone non-obese diabetic mice[J].Immunol Cell Biol,2010,88(8):771.
[6]Dugas V,Beauchamp C,Chabot-Roy G,et al.Implication of the CD47 pathway in autoimmune diabetes[J].J Autoimmun,2010,35(1):23.
[7]Bryant N L,Suarez-Cuervo C,Gillespie GY,et al.Characterization and immuno-therapeutic potential of gammadelta T-cells in patients with glioblastoma[J].Neuro Oncol,2009,11(4):357.
[8]Grishkan IV,Ntranos A,Calabresi PA,et al.Helper T cells down-regulate CD4 expression upon chronic stimulation giving rise to double-negativeT cells[J].Cell Immunol,2013,284(1-2):68.
[9]Getachew Y,Cusimano FA,James LP,et al.The role of intrahepatic CD3+/CD4-/CD8- double negative T (DN T) cells in enhanced acetaminophen toxicity[J].Toxicol Appl Pharmacol,2014,280(2):264.
[10]張竹虛,張 麗.αβ-TCR+CD3+CD4-CD8-雙陰性T細胞:一種新發現的免疫調節T細胞[J],現代免疫學,2004,24(1):5.
[11]Mou Z,Liu D,Okwor I,et al.MHC class II restricted innate-like double negative T cells contribute to optimal primary and secondary immunity to Leishmania major[J].PLoS Pathog,2014,10(9):e1004396.
[12]Bernardo I,Mancebo E,Aguiló I,et al.Phenotypic and functional evaluation of CD3+CD4-CD8-T cells in human CD8 immunodeficiency [J].Haematologica,2011,96(8):1195.
[13]Ford Mcintyre MS,Gao JF,Li X,et al,Consequences of Double Negative regulatory T cell and Antigen Presenting Cell interaction on immune response suppression[J].Int Immunopharmacol,2011,11(5):597.
AmplificationofHumanperipheralbloodCD3+CD4-CD8-doublenegativeTcellsinvitro
WANGXin-mei,WANGXue-ye,HANMei.
(HematolgyDepartmentofJilinProvincePeople’sHospitalChangchun130021,China)
ObjectiveTo detect the method of isolation and amplification CD3+CD4-CD8-double negative T cells (DNT) in vitro.MethodsWe used the Rosettesep to remove CD4+T cells and CD8+T cells from human peripheral blood.To culture DNT cells with anti-CD3mAb,rhIL-2 and rhIL-4.We computed and recordedthe amplification times after day 10 and day 14.To putify DNT cells with Easysep and test its purity with flow cytometry.ResultsThe purity of DNT cells is 94%.The amplification times is 53 in day 10 and 41 in day 14.ConclusionThe method of Rosettesep and Easysep can be used to isolate and purify DNT cells.
CD3+CD4-CD8-double negative T cells;Rosettesep antibody adsorption method;Easysep micro-magnetic beads method;Flow cytometry
R446.62
A
2016-12-09)
吉林省衛生廳項目(2012Z052),吉林省科技廳項目(20150204074SF)
*通訊作者
1007-4287(2017)10-1831-04
王新梅(1983-),女,醫學碩士,醫師,主要從事血液病基礎相關研究。

