小反芻獸疫病毒P蛋白及非結(jié)構(gòu)蛋白V表達(dá)特性研究
嚴(yán) 歡 , 馬玉馨 , 信愛(ài)國(guó) , 高華峰
(1. 云南省熱帶亞熱帶動(dòng)物病毒病重點(diǎn)實(shí)驗(yàn)室 , 云南 昆明 650024 ; 2. 云南農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)學(xué)院 , 云南 昆明 650201)
小反芻獸疫病毒P蛋白及非結(jié)構(gòu)蛋白V表達(dá)特性研究
嚴(yán) 歡1,2, 馬玉馨1,2, 信愛(ài)國(guó)1, 高華峰1
(1. 云南省熱帶亞熱帶動(dòng)物病毒病重點(diǎn)實(shí)驗(yàn)室 , 云南 昆明 650024 ; 2. 云南農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)學(xué)院 , 云南 昆明 650201)
從小反芻獸疫病毒全長(zhǎng)cDNA中對(duì)磷酸化蛋白P及其編碼的非結(jié)構(gòu)蛋白V基因進(jìn)行特異擴(kuò)增,PCR產(chǎn)物回收后分別連接于T載體酶切及測(cè)序分析后,將其亞克隆至真核載體pEGFP-N2及原核表達(dá)載體pET32a, 獲得的真核表達(dá)質(zhì)料命名為pEGFP-P、 pEGFP-RV與空載體對(duì)照轉(zhuǎn)染Vero細(xì)胞, 經(jīng)濃度為800 μg/μL G418篩選后獲得均一表達(dá),熒光定位觀察表明P蛋白與V蛋白的表達(dá)并不相同,P蛋白嚴(yán)格定位于細(xì)胞漿,而V蛋白則能在胞漿及胞核內(nèi)觀察到;獲得原核表達(dá)質(zhì)粒pET32a-P 和pET32a-RV在37 ℃通過(guò)條件優(yōu)化后以1.0 mmol/L IPTG誘導(dǎo)后分別收獲細(xì)胞上清及沉淀用于SDS-PAGE及Western Blot對(duì)重組P、V蛋白的檢測(cè),結(jié)果表明,重組P蛋白為90 ku,重組V蛋白為55 ku的可溶性融合蛋白,可溶性表達(dá)產(chǎn)物經(jīng)500 mmol/L 咪唑兩次純化后獲得80%以上純度的表達(dá),純化得到的蛋白免疫兔子后能產(chǎn)生特異性抗體。
小反芻獸疫病毒 ; P/V蛋白 ; 細(xì)胞定位 ; 原核表達(dá)
小反芻獸疫病毒(Pestedespetitsruminantsvirus, PPRV)是副黏病毒科、麻疹病毒屬的成員,山羊高度易感。該病主要在非洲及中東地區(qū)流行,近年來(lái)在中國(guó)周邊國(guó)家頻繁發(fā)生,自2007年西藏自治區(qū)首次報(bào)道該病疫情[1-3]。2013年11月新疆再次暴發(fā)該病,由于山羊和綿羊的大面積流動(dòng),該病在國(guó)內(nèi)迅速傳播,至2014年9月不到一年的時(shí)間,全國(guó)共有22個(gè)省或自治區(qū)的256個(gè)縣暴發(fā)疫情。該病現(xiàn)已成為對(duì)養(yǎng)羊業(yè)危害較大的疫病,小反芻獸疫病毒磷酸化蛋白基因(P)及非結(jié)構(gòu)蛋白V在病毒天然免疫過(guò)程中起到關(guān)鍵作用,對(duì)這兩種蛋白的特性及功能研究對(duì)研究病毒的特性有重要意義[4-5]。本試驗(yàn)通過(guò)真核及原核兩種不同方式表達(dá)了病毒P及非結(jié)構(gòu)蛋白V,研究其細(xì)胞定位及蛋白部分特性。
1 材料與方法
1.1 材料 大腸埃希菌DH5a、真核載體pEGFP-N2及原核表達(dá)載體pET32a、小反芻獸疫病毒N75/1弱毒疫苗株及全長(zhǎng)cDNA文庫(kù)由云南省熱帶亞熱帶動(dòng)物病毒病重點(diǎn)實(shí)驗(yàn)室保存、Vero細(xì)胞系為云南省熱帶亞熱帶動(dòng)物病毒病重點(diǎn)實(shí)驗(yàn)室保存。
1.2 酶及試劑 各種工具酶,均購(gòu)自TaKaRa公司,寶生物工程(大連)有限公司;蛋白質(zhì)分子量標(biāo)準(zhǔn),購(gòu)自晶美公司;PCR產(chǎn)物回收試劑盒及凝膠回收試劑盒為上海生工生物工程技術(shù)服務(wù)有限公司產(chǎn)品;IPTG(異丙基-β-D-硫代半乳糖苷)為Promega公司產(chǎn)品;組氨酸His單抗、堿性磷酸酶標(biāo)記的羊抗鼠二抗,購(gòu)自上海碧云天生物技術(shù)有限公司;引物合成及DNA測(cè)序由上海生工生物工程技術(shù)服務(wù)有限公司完成。
1.3 小反芻獸疫病毒的PCR擴(kuò)增 根據(jù)小反芻獸疫病毒N75/1毒株序列,合成如下表1引物用于目的基因的擴(kuò)增。參考全長(zhǎng)文庫(kù)基因序列信息,用Primer Premier5.0設(shè)計(jì)用于擴(kuò)增用于連接報(bào)告質(zhì)粒pEGFP-N2的結(jié)構(gòu)蛋白P及V:用primer mutation設(shè)計(jì)點(diǎn)突變引物。

表1 擴(kuò)增病毒結(jié)構(gòu)蛋白P及其編碼的非結(jié)構(gòu)蛋白V及基因點(diǎn)突變的引物
注:斜體下劃線大寫字母為用于連接載體的酶切位點(diǎn),黑體大寫字母為保護(hù)性堿基
1.4 重組表達(dá)載體的構(gòu)建 序列測(cè)定正確的P、V基因雙酶切陽(yáng)性片段分別與雙酶切的pEGFPN2載體在T4連接酶作用下16 ℃連接16 h,構(gòu)建真核表達(dá)載體pEGFP-P、 pEGFP-RV及原核表達(dá)載體pET32a-P 和pET32a-V然后轉(zhuǎn)化DH5a感受態(tài)細(xì)胞,涂板后培養(yǎng)14 h挑選構(gòu)建pEGFP-V,進(jìn)行點(diǎn)突變及雙酶切鑒定。鑒定出的陽(yáng)性克隆提取質(zhì)測(cè)序驗(yàn)證并命名為pEGFP-RV。
1.5 重組質(zhì)粒轉(zhuǎn)染與篩選 將提取的重組質(zhì)粒pEGFP-P、 pEGFP-RV與脂質(zhì)體混勻,加入無(wú)血清及抗生素細(xì)胞培養(yǎng)基混勻后于5% CO2培養(yǎng)24 h,通過(guò)梯度試驗(yàn)加入終濃度為800 μg/μL的G418,培養(yǎng)8 d后進(jìn)行細(xì)胞消化培養(yǎng),經(jīng)兩代篩選培養(yǎng)后觀察重組蛋白的細(xì)胞定位。
1.6 融合蛋白的誘導(dǎo)表達(dá)及純化 將測(cè)序正確的重組質(zhì)粒pET32a-P 和pET32a-RV 轉(zhuǎn)化E.coliBL21(DE3),在含有10 mg/L 氨芐青霉素的LB培養(yǎng)基中37 ℃搖菌過(guò)夜,后以1∶100 轉(zhuǎn)接到20 mL新鮮的含10 mg/L 氨芐青霉素的LB培養(yǎng)基。37 ℃搖菌2 h,A600 nm值 約為0.6時(shí),加入IPTG至終濃度分別為0.01、0.10、1.0 mmol/L,37 ℃搖菌誘導(dǎo)4 h,6 000 r/min (4℃)低溫離心10 min 收菌。對(duì)上清液和沉淀均進(jìn)行聚丙烯酰胺凝膠電泳(SDS‐PAGE)分析,判定表達(dá)形式。誘導(dǎo)表達(dá)的融合蛋白包含有6X His 片段,適用Ni‐NTA 樹脂親和層析法純化目的蛋白。
1.7 多抗血清的制備 分別用二次純化的蛋白20 mg P/V免疫兔子,以10 mg的劑量免疫二次免疫,加強(qiáng)免疫后7 d采血檢測(cè)。
1.8 SDS-PAGE電泳及Western Blot檢測(cè) 重組原核表達(dá)質(zhì)粒pET32a-P 和pET32a-RV分別加入IPTG 37 ℃誘導(dǎo)后收集細(xì)胞及血清,進(jìn)行SDS-PAGE電泳,分析表達(dá)量大小及表達(dá)產(chǎn)物的可溶性,將SDS-PAGE電泳產(chǎn)物轉(zhuǎn)移至硝酸纖維膜上,重組蛋白用含5%脫脂乳的TBST封閉4 ℃過(guò)夜,以抗6His標(biāo)鑒蛋白的單抗結(jié)合1 h后,顯色觀察其特異性條帶。
2 結(jié)果
2.1 小反芻獸疫病毒N75/1結(jié)構(gòu)蛋白P與非結(jié)構(gòu)蛋白V基因的克隆與鑒定 從全長(zhǎng)文庫(kù)質(zhì)粒中用特異引物擴(kuò)增P、V基因,PCR產(chǎn)物經(jīng)1%瓊脂糖凝膠電泳檢測(cè)得到與預(yù)期相符的大小分別為1 536 bp、895 bp的條帶,擴(kuò)增的目的片斷膠回收后連接到pMD19-T載體上,轉(zhuǎn)化到感受態(tài)細(xì)胞DH5α,篩選陽(yáng)性克隆,提取的重組質(zhì)粒經(jīng)PCR鑒定和限制性內(nèi)切酶鑒定得到了與預(yù)期相符的核酸片段,將載體 pEGFP-N2與pMD19-T載體上目的基因進(jìn)行雙酶切或單酶切,酶切產(chǎn)物經(jīng)膠回收后連接,酶切檢測(cè)構(gòu)建克隆的正確性,所構(gòu)建的融合表達(dá)載體分別命名為pEGFP-P及pEGFP-V, pEGFP-V通過(guò)在體外突變插入鳥嘌磷G,得到一個(gè)大小為896 bp的基因片段,獲得的重組質(zhì)粒經(jīng)PCR鑒定及序列測(cè)定分析后命名為pEGFP-RV(見(jiàn)圖1)。
2.2 小反芻獸疫病毒結(jié)構(gòu)蛋白P與非結(jié)構(gòu)蛋白V重組質(zhì)粒的轉(zhuǎn)染 提取重組質(zhì)粒pEGFP-N2、pEGFP-P、pEGFP-RV,經(jīng)脂質(zhì)體轉(zhuǎn)染非洲綠猴腎細(xì)胞Vero,轉(zhuǎn)染后于48 h后可觀察到大量表達(dá),通過(guò)梯度試驗(yàn)加入深度分別500 mg/mL~1 200 mg/mL的G418, 在深度為1 000 mg/mL時(shí),能完全抑制未表達(dá)目的蛋白的Vero細(xì)胞,經(jīng)連續(xù)篩選4代后,建立穩(wěn)定表達(dá)P、V蛋白的重組細(xì)胞系, 通過(guò)熒光顯微鏡可觀察到小反芻獸疫磷酸化蛋白在轉(zhuǎn)染早期及穩(wěn)定表達(dá)后均嚴(yán)格定位于細(xì)胞漿內(nèi),而空載體及非結(jié)構(gòu)蛋白V在細(xì)胞核在胞核及胞漿內(nèi)均有分步。見(jiàn)中插彩版圖2。
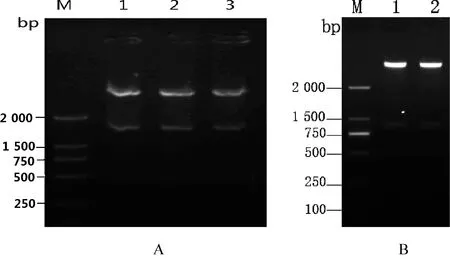
圖1 結(jié)構(gòu)蛋白基因P雙酶切電泳
2.3 小反芻獸疫病毒結(jié)構(gòu)蛋白P與非結(jié)構(gòu)蛋白V重組質(zhì)粒的原核表達(dá) 將表達(dá)菌E.coliBL21(DE3)于37 ℃振蕩培養(yǎng)至A600 nm值為0.6時(shí),在誘導(dǎo)溫度為37 ℃、誘導(dǎo)時(shí)間為4 h、IPTG 濃度依次0.01、0.1、1.0 mmol/L,在IPTG 濃度為1.0 mmol/L 時(shí),目的蛋白的表達(dá)最高。在大腸桿菌DE3菌株中的誘導(dǎo)表達(dá)的蛋白部分以包涵體形式存在,大部分蛋白以可溶形式表達(dá)于上清中,目的蛋白P和V均獲得表達(dá)。見(jiàn)圖3。
2.4 小反芻獸疫病毒結(jié)構(gòu)蛋白P與非結(jié)構(gòu)蛋白V重組質(zhì)粒的原核表達(dá)純化 將構(gòu)建的原核表達(dá)載體轉(zhuǎn)化大腸桿菌DE3菌株,在37 ℃下,經(jīng)1 mmol/L的IPTG誘導(dǎo)培養(yǎng),使蛋白充分表達(dá)。沉淀重懸于后進(jìn)行超聲破碎,取上清加入1 mL 50%Ni-NTA樹脂。將結(jié)合有目的蛋白的Ni-NTA樹脂裝柱。用不同濃度的咪唑漂洗液(10、 20、 50、 100、 250、500 mmol/L)選擇漂洗條件。最終用500 mmol/L咪唑溶液洗脫目的蛋白。利用Ni-NTA樹脂進(jìn)行純化,用高濃度的咪唑溶液洗脫,收集不同時(shí)間組分發(fā)現(xiàn),第1次洗脫的蛋白產(chǎn)量較高,但所含雜志較多,第2次洗脫后SDS-PAGE膠顯示在55 ku處有一條明顯的條帶,但仍有少量雜質(zhì),第3次則很少收到蛋白質(zhì),因而選擇二次洗脫,濃縮后500 mmol/L咪唑洗脫液中蛋白V濃度約1.4 mg/mL, 純度約80%。見(jiàn)圖4。
圖3 蛋白質(zhì)電泳結(jié)果
M: 非預(yù)染蛋白分子量標(biāo)準(zhǔn),從上到下分別是116、 66.2,45、 35、 25、 18.4、 14.4 kD; 1~4: BL21(pET32a-P) 分別為未誘導(dǎo)前上清、沉淀和0.1 mmol/L IPTG誘導(dǎo)后上清、沉淀; 5~8:BL21(pET32a-RV) 分別為未誘導(dǎo)前上清、沉淀和1 mmol/LIPTG誘導(dǎo)后上清、沉淀
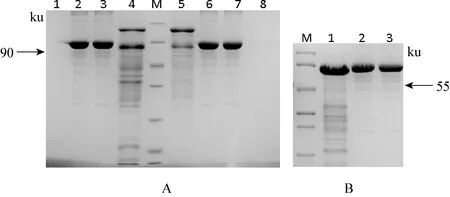
圖4 蛋白純化電泳結(jié)果
A M: 非預(yù)染蛋白分子量標(biāo)準(zhǔn), 從上到下分別是 116、 66.2、 45、 35、 25、 18.4、 14.4 ku; 1,8:分別為濃縮濾液; 2,6: 1mg/mL BSA3; 7: 0.8 mg/mL BSA: 3: 50 mmol/L咪唑洗脫液濃縮 5: 500-1mmol/L咪唑洗脫液濃縮 B M:中分子量蛋白Marker,從上到下依次為90、 66、 45、 35、 29、 20、 14.4 Ku; 1: V蛋白; 2,3: 分別為1.2, 1 mg/mL BSA標(biāo)準(zhǔn)品
2.5 表達(dá)產(chǎn)物的SDS-PAGE和Western Blot檢測(cè) 收集培養(yǎng)物,純化重組蛋白進(jìn)行Western Blot 鑒定,抗體為抗6X His 單克隆抗體,表明融合基因在E.coliBL21(DE3)中正確表達(dá),通過(guò)間接法分析融合蛋白的表達(dá)可見(jiàn)P/V基因在表達(dá),表達(dá)產(chǎn)物的分子質(zhì)量約為90 ku 及55 ku,P/V蛋白抗6His(祖蛋白)標(biāo)鑒蛋白的單抗進(jìn)行檢測(cè),檢測(cè)出特異性條帶(圖5A)。P/V純化蛋白免疫的兔血清,經(jīng)抗體為HRP標(biāo)記的山羊抗兔血清檢測(cè)出大小在90 ku 及55 ku的相應(yīng)蛋白,表明P/V兩種蛋白在細(xì)胞中均得到正確表達(dá),并能被表達(dá)的重組蛋白識(shí)別,初步具備了生物學(xué)活性。

圖5 融合蛋白的Western Blot檢測(cè)
A: 融合蛋白的P/V基因兩次純化后的重組蛋白鑒定;B: 兩次純化的融合蛋白P/V免疫兔子后制備血清抗體的Western Blot檢測(cè)
3 討論
小反芻獸疫病毒屬麻疹病毒科的一個(gè)成員,P基因編碼-含507個(gè)氨基酸、分子量為55 ku的蛋白。這樣的分子量遠(yuǎn)比根據(jù)聚丙烯酰胺凝膠電泳估計(jì)的75 ku,這是因?yàn)樵赑蛋白合成后,大量的磷酸鹽殘基加到蛋白上,造成蛋白的異常遷移[10]。V蛋白是mRNA轉(zhuǎn)錄過(guò)程中由加到其751位點(diǎn)的額外G殘基合成的,加上殘基就導(dǎo)致了原閱讀框的改變,新形成的ORF比先前的短,編碼一個(gè)含299個(gè)氨基酸、C端富含半胱氨酸、N端序列與P蛋白N端相同的蛋白V。對(duì)麻疹病毒的研究中,研究人員發(fā)現(xiàn),病毒的體內(nèi)感染能導(dǎo)致先天免疫的尚失,深入的研究表明,麻疹病毒V蛋白通過(guò)與mda-5結(jié)合從而阻止干擾素的產(chǎn)生,通過(guò)反向遺傳技術(shù)將C基因突變而V基因仍然表達(dá)的毒株能誘導(dǎo)更高水平的干擾素,表明基因在干擾素抑制過(guò)程中起到重要作用[6-7]。本次通過(guò)原核表達(dá)的兩種融合蛋白一個(gè)大小為90 ku,另一個(gè)大小55 ku,均比預(yù)期的蛋白偏大,非結(jié)構(gòu)蛋白V預(yù)計(jì)大小為35 ku左右,結(jié)果表明,該蛋白也存在一定的修飾加工,由于經(jīng)磷酸化基因編輯而來(lái),存在磷酸化效應(yīng)。
結(jié)構(gòu)蛋白P及其編碼的非結(jié)構(gòu)的表達(dá),本研究采用兩種方式得到所研究的非結(jié)構(gòu)蛋白,一種方式是通過(guò)定點(diǎn)突變得到編碼完整讀碼框的非結(jié)構(gòu)蛋白P,然后與含報(bào)告基因的真核表達(dá)質(zhì)粒pEGFP-N2連接,經(jīng)測(cè)序驗(yàn)證后轉(zhuǎn)染研究所需的細(xì)胞,本研究中構(gòu)建后的載體通過(guò)脂質(zhì)體轉(zhuǎn)染Vero細(xì)胞,利用熒光蛋白的細(xì)胞定位可觀察到這兩種尚未充分研究的蛋白的亞細(xì)胞定位,本研究中磷酸化蛋白及其編碼的非結(jié)構(gòu)蛋白V均定位于胞漿內(nèi),這種定位方式也與預(yù)期一致,由于RNA病毒不進(jìn)入細(xì)胞核復(fù)制,因此,即使負(fù)責(zé)與核蛋白結(jié)合并使后者處于可溶狀態(tài),增強(qiáng)核蛋白轉(zhuǎn)錄效率的磷酸化蛋白,其在胞內(nèi)定位均位于胞漿內(nèi),而非結(jié)構(gòu)蛋白也只在胞漿內(nèi)進(jìn)行表達(dá)。
病毒的結(jié)構(gòu)蛋白在原核表達(dá)系統(tǒng)中多以包涵體形式存在,尤其是對(duì)于分子質(zhì)量較大的蛋白,可溶性表達(dá)的幾率很低,本研究表明,小反芻獸疫磷酸化基因P及非結(jié)構(gòu)蛋白V在細(xì)菌BL21中能得到高效表達(dá),并可用鎳柱高效純化。純化蛋白免疫兔子后,免疫血清能被純化的蛋白識(shí)別,表明蛋白具有生物學(xué)活性,血清中和實(shí)驗(yàn)則表明兩種蛋白均不能產(chǎn)生中和抗體,這與現(xiàn)有文獻(xiàn)報(bào)道相一致,這也為更多蛋白功能研究奠定了基礎(chǔ)。
[1] Li J, Li L, Wu X,etal. Diagnosis of Peste des Petits Ruminants in Wild and Domestic Animals in Xinjiang, China, 2013-2016[J]. Transboundary & Emerging Diseases, 2017.
[2] Shaila M S, Shamaki D, Forsyth M A,etal. Geographic distribution and epidemiology of peste des petits ruminants viruses[J]. Virus Res, 1996,43:149-153.
[3] Wang Z, Bao J, Wu X,etal. Peste des petits ruminants virus in Tibet, China[J]. Emerg Infect Dis, 2009, 15(2): 299-301.
[4] Muthuchelvan D, Sanyal A, Sarkar J,etal. Comparative nucleotide sequence analysis of the phosphoprotein gene of peste des petits ruminants vaccine virus of Indian origin[J]. Res Vet Sci, 2006, 81(1):158-164.
[5] Devaux P, Cattaneo R. Measles virus phosphoprotein gene products: conformational flexibility of the P/V protein amino-terminal domain and C protein infectivity factor function[J]. J Virol, 2004, 78(21):11 632-11 640.
[6] Young D F, Didcock L, Goodbourn S,etal. Paramyxoviridae use distinct virus-specific mechanisms to circumvent the interferon response[J]. Virology, 2000, 269(2):383-390.
[7] Nanda S K, Baron M D. Rinderpest virus blocks type I and type II interferon action: role of structural and nonstructural proteins[J]. J Virol, 2006, 80(15):7 555-7 568.
ExpressionofP/VGeneofPestedesPetitsRuminantsVirusandtheStudiesoftheBiologicalCharacteristics
YAN Huan1,2, MA Yu-xin1,2, XIN Ai-guo1, GAO Hua-feng1
(1. Yunnan Tropical and Subtropical Animal Viral Disease Laboratory, Kunming 650224, China;2. College of Veterinary Medicine,Yunnan Agricultural University, Kunming 650201, China)
The P/V gene fragment of peste des petits ruminants vaccine strain N75/1 was amplified by PCR from cDNA library, and the purified products were cloned into pMD19-T vector. Confirmed with enzyme digestion and sequence analysis, P and V gene was subcloned into vector pEGFP-N2 and pET32a. The eukaryotic expression vector with p/v gene was constructured and finally named pEGFP-P,and pEGFP-RV, respectively. The recombinant plasmid with P/V gene and the empty vector control was transfected into Vero cells and the cells were selected with G418. The PPRV P gene was expressed only in cytoplasm. Prokaryotic Expression vector of pET32a with P/V gene was constructed and named as pET32a-P and pET32a-RV respectively. The fusion protein was induced by IPTG with the final titer 1.0 mmol/L at 37℃. Fusion protein mainly expressed in the supernatant was purified with NI-NTA spin with 500 mmol/L imidazole twice and used to immunize the rabbits to prepare polyclonal antibodies. The results showed that the molecular weight of recombinant protein was about 90ku and 55ku.The antiserum of rabbits analyzed by western blotting showed that the bands at 90ku and 55ku molecular weights were detected. It shows that the two purified proteins have biological functions.
Peste des petits ruminants virus ; P/V protein ; cellar location ; expression
GAO Hua-feng
S855.3
A
0529-6005(2017)08-0003-04
2017-01-18
國(guó)家自然科學(xué)基金項(xiàng)目(31160499)
嚴(yán)歡(1993-),女,碩士,主要從事動(dòng)物病毒學(xué)研究,E-mail:huanzai920@sina.com
高華峰,E-mail:kmghf@hotmail.com

