利拉魯肽對高脂喂養大鼠胰腺β細胞ATF4/CHOP通路的影響
王 平,郭曉宇,高 宇,劉 劍,山秀杰,張 蕊,葛曉春,馮增斌,李桂芳
(1.承德醫學院,河北承德 067000;2.承德醫學院附屬醫院內分泌科 067000 )
利拉魯肽對高脂喂養大鼠胰腺β細胞ATF4/CHOP通路的影響
王 平1,郭曉宇1,高 宇2△,劉 劍1,山秀杰2,張 蕊2,葛曉春2,馮增斌2,李桂芳2
(1.承德醫學院,河北承德 067000;2.承德醫學院附屬醫院內分泌科 067000 )
目的觀察利拉魯肽對高脂喂養大鼠胰腺GRP78、轉錄活化因子4(ATF4)、CCAAT區/增強子結合蛋白同源蛋白(CHOP)、TRB3蛋白和mRNA表達情況,探討利拉魯肽對高脂喂養大鼠胰腺ATF4/CHOP通路的影響。方法將雄性Wistar大鼠44只分為對照組、高脂組、干預組1、干預組2,每組11只,對照組給予普通飲食,其余3組給予高脂飲食喂養8周后,干預組1給予利拉魯肽100 μg·kg-1·d-1皮下注射;干預組2給予利拉魯肽200 μg·kg-1·d-1皮下注射。藥物干預2周后處死,每組取5只大鼠行清醒狀態下高胰島素-正葡萄糖鉗夾試驗計算葡萄糖輸注率(GIR),測定其余大鼠空腹血糖(FBG)、空腹胰島素(FINS)、血清游離脂肪酸(FFA)、總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)和高密度脂蛋白膽固醇(HDL-C),計算胰島β細胞功能指數(HOMA-β),Western blot和Realtime-PCR技術檢測胰腺GRP78、ATF4、CHOP和TRB3蛋白及mRNA的表達。結果與對照組相比,高脂組FBG、FFA、TC、FINS、TG、LDL-C水平顯著升高,HDL-C、GIR和HOMA-β明顯下降(P<0.05或P<0.01),與高脂組相比,干預組2 HDL-C、GIR和HOMA-β升高(P<0.05或P<0.01),其余指標明顯下降;與干預組1相比,干預組2的血FGB、FFA、TC下降,GIR和HOMA-β升高(P<0.05)。與對照組相比,高脂組GRP78、ATF4、CHOP和TRB3蛋白及mRNA的表達明顯升高;與高脂組相比,干預組1與干預組2隨利拉魯肽濃度升高,GRP78、ATF4、CHOP和TRB3蛋白及mRNA表達逐漸下降。結論利拉魯肽可呈濃度依賴性改善高脂喂養大鼠胰島素抵抗及保護胰島β細胞,其作用機制可能涉及胰腺內質網ATF4/CHOP通路。
胰島素抗藥性;內質網應激;轉錄活化因子-4;CCAAT/增強子結合蛋白同源蛋白;利拉魯肽
2型糖尿病是一種進展性疾病,胰島素抵抗(insulin resistance,IR)和胰島β細胞功能減退是兩個主要發病機制。近年來研究發現,內質網應激(endoplasmic reticulum stress,ERS)可促進IR和β細胞凋亡,導致胰島功能衰竭[1]。胰高血糖素樣多肽-1(GLP-1)類似物利拉魯肽是治療2型糖尿病的新型降糖藥,該藥物可抑制胰腺β細胞凋亡,保護胰島β細胞功能并改善IR,但具體機制不明[2]。本實驗利用利拉魯肽對高脂喂養IR大鼠進行干預,觀察其對ERS相關轉錄活化因子4(ATF4)/CCAAT區/增強子結合蛋白同源蛋白(CHOP)通路的影響,探討利拉魯肽改善IR保護胰島β細胞的可能機制,為其治療糖尿病提供理論依據。
1 材料與方法
1.1動物與飼料 Wistar雄性大鼠44只,購于北京維通利華。普通飼料組成:總熱量為337 kCal/100 g,碳水化合物64.19%,脂肪12.04%,蛋白質23.77%。高脂飼料組成:總熱量為486 kCal/100 g,碳水化合物30.01%,脂肪53.75%,蛋白質16.24%。普通飼料及高脂飼料購于北京科奧協力有限公司。
1.2實驗分組 大鼠適應性喂養3 d,分為對照組、高脂組、干預組1、干預組2,每組11只。對照組給予普通飲食,高脂組、干預組1、干預組2給予高脂飼料喂養,喂養8周后,對照組給予普通飲食+生理鹽水每日皮下注射,高脂組給予高脂飲食+生理鹽水每日皮下注射,干預組1給予高脂飲食+利拉魯肽100 μg·kg-1·d-1皮下注射,干預組2給予高脂飲食+利拉魯肽200 μg·kg-1·d-1皮下注射。藥物干預2周后各組取5只大鼠行清醒狀態下高胰島素-正葡萄糖鉗夾試驗計算葡萄糖輸注率(GIR),判定大鼠胰島素抵抗情況。腹主動脈取血處死各組其余大鼠,快速分離胰腺組織迅速置于-80 ℃液氮中隨后轉移到-80 ℃冰箱中保存,用于Western blot和Real-time PCR檢測。
1.3清醒狀態高胰島素-正葡萄糖鉗夾試驗 參照文獻[3]進行。
1.4血液相關指標的測定 全血標本室溫放置2 h,1 000 r/min離心20 min,取上清液,-80 ℃冰箱保存。使用全自動生化分析儀采用FINS法測定空腹血糖(FBG)、總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)和高密度脂蛋白膽固醇(HDL-C)。血清游離脂肪酸(FFA)用ELISA試劑盒測定(購于南京建成生物工程研究所)。
1.5胰島β細胞功能指數(HOMA-β)計算 HOMA-β=20×FINS/(FBG-3.5)。
1.6Western blot分析 將凍存的胰腺剪成小塊,取100 mg組織加入1 mL蛋白裂解液,冰上裂解30 min,4 ℃ 12 000 r/min離心10 min,取上清液,嚴格按照BCA法測定蛋白濃度。進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),每孔上樣40 μg,樣品分離后轉移至PVDF膜,設置電壓100 V,總電泳時間2 h左右。封閉、TBST洗膜分別加入GRP78一抗、ATF4一抗、CHOP一抗、TRB3一抗和β-actin一抗(購于武漢博士德生物工程有限公司)室溫搖床孵育2 h,TBST洗膜3次,分別加入二抗(購于武漢博士德生物工程有限公司)4 ℃搖床過夜,TBST洗膜3次。在暗室中,ECL發光劑在X光膠片曝光。以β-actin為內參對照,將膠片掃描后用Image J軟件分析。
1.7Real-time PCR檢測 按照 Trizol說明書從胰腺組織提取總RNA。應用Fast Quant RT kit反轉錄試劑盒(天根生化科技有限公司)反轉錄合成cDNA,反應體系20 μL,嚴格按照說明書反轉錄合成cDNA,以此為模板進行RT-PCR,以β-actin作為內參。每個循環 94 ℃變性15 s,68 ℃退火15 s,72 ℃延伸15 s。利用檢測到的熒光信號,得到每份標本的擴增曲線及熔點曲線,檢測反應的特異性,得到各自的Ct值,每組均重復3次進行。引物由Invitrogen公司設計合成,引物序列如下:GRP78上游5′-AAC CCA GAT GAG GCT GTA GCA-3′,下游5′-ACA TCA AGC AGA ACC AGG TCA C-3′;ATF4上游5′-GCA TCT GTA TGA GCC CTG AGT CC-3′,下游5′-CCA CGA GGA ACA CCT GGA GAA G-3′;CHOP上游5′-CCT CGC TCT CCA GAT TCCA-3′,下游5′-CTC ATT CTC CTG CTC CTT CTC C-3′;TRB3上游5′-TCA AGT TGC GTC GAT TTG TCT TC-3′,下游5′-CAG TCA TCA CAC AGG CAT CCT C-3′;β-actin上游5′-ATG CCA TCC TGC GTC TGG ACC TGG C-3′,下游5′- AGC ATT TGC GGT GCA CGA TGG AGG G-3′。得出Ct值通過公式2-ΔΔCt分析計算各目的基因相對表達量。
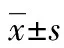
2 結 果
2.1一般項目 與對照組相比,高脂組的血FBG、FFA、TC、TG、FINS、LDL-C均顯著升高,HDL-C、HOMA-β和GIR明顯下降,差異有統計學意義(P<0.01);與高脂組相比,干預組2血FBG、FFA、TC、FINS、TG、LDL-C均明顯下降,HOMA-β和GIR升高,差異有統計學意義(P<0.05或P<0.01);干預組1血FFA下降,HOMA-β和GIR明顯升高,差異有統計學意義(P<0.05);與干預組1比較,干預組2大鼠的FBG、FFA、TC明顯下降,HOMA-β和GIR明顯升高(P<0.05),見表1。
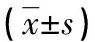
表1 4組大鼠一般項目比較
a:P< 0.05,與對照組比較;b:P<0.01,與對照組比較;c:P<0.05,與高脂組比較;d:P<0.01,與高脂組比較;e:P<0.05,與干預組1比較
2.2各組大鼠胰腺ERS相關因子mRNA的表達 與對照組相比,高脂組胰腺GRP78、ATF4、CHOP、和TRB3 mRNA顯著升高,差異有統計學意義(P<0.05或P<0.01)。與高脂組比較,干預組1和干預組2的GRP78、ATF4、CHOP和TRB3 mRNA表達下降,差異有統計學意義(P<0.05)。與干預組1比較,干預組2 GRP78、ATF4、CHOP和TRB3的mRNA表達下降,差異有統計學意義(P<0.05),見圖1。

*:P<0.05,與對照組比較;#:P<0.05,與高脂組比較;△:P<0.05,與干預組1比較
圖1各組大鼠胰腺ERS相關因子mRNA的表達
2.3各組大鼠胰腺ERS相關蛋白表達情況 Western blot檢測4組大鼠胰腺組織中GRP78、ATF4、CHOP和TRB3蛋白相對表達水平的比較:與對照組比較,高脂組GRP78、ATF4、CHOP、和TRB3的蛋白表達水平明顯高于對照組(P<0.05),經利拉魯肽干預后,干預組1和干預組2 GRP78、ATF4、CHOP、和TRB3蛋白表達均下調,明顯低于高脂組,差異有統計學意義(P<0.05)。與干預組1比較,干預組2各組蛋白減少(P<0.05),見圖2。

圖2 各組大鼠胰腺ERS相關蛋白表達情況
3 討 論
研究發現高脂飲食可導致機體代謝改變及IR和胰島β細胞功能紊亂,同時高脂環境是機體誘發IR的獨立危險因素之一[4-6]。HOMA-β是用于評價個體的胰島β細胞功能的指標,胰島β細胞功能降低則其數值降低,功能增強則其數值升高。鉗夾實驗中GIR是國際上評價IR的金標準,數值越低提示IR越明顯。本實驗結果顯示,高脂喂養大鼠與對照組相比,GIR、HOMA-β下降,FINS升高,出現了高胰島素血癥、IR及胰島β功能減退。同時出現FFA、TC、TG、LDL-C均顯著升高,HDL-C顯著性降低的血脂紊亂。利拉魯肽是一種長效GLP-1類似物,利拉魯肽干預高脂喂養大鼠2周后,GIR升高,FINS下降,HOMA-β升高,血糖、血脂降低,HDL-C升高,且與100 μg·kg-1·d-1的利拉魯肽組比較,200 μg·kg-1·d-1利拉魯肽干預效果更明顯,這表明利拉魯肽呈濃度依賴性降低高脂飲食大鼠血糖、血脂,有效改善IR和胰島β功能減退,與既往的結果相似[7]。
研究發現高糖、高脂等應激情況下,內質網平衡被打破,使內質網內蛋白質折疊錯誤并堆積在內質網腔內,持續應激引發ERS及細胞凋亡[8]。分子伴侶葡萄糖調節蛋白(GRP78)是ERS標志性蛋白。已有相關研究證實高脂條件下,大鼠胰腺發生IR,內質網應激相關因子GRP78表達升高,激活內質網應激相關通路,引起胰島功能衰退,導致糖尿病,本研究結果與之相似,高脂大鼠胰腺GRP78表達升高,這說明IR和胰島功能減退與ERS密切相關[9]。雙鏈RNA依賴的蛋白激酶樣內質網激酶(PERK)是內質網膜上的一種Ⅰ型跨膜蛋白,是ERS的3條通路之一,持續的ERS可使PERK激活下游真核起始因子2α(elF2α)和轉錄活化因子-4(ATF4)、前凋亡因子CCAAT增強結合蛋白同源蛋白(CHOP)和調解凋亡基因假性激酶Tribbles 3(TRB3),CHOP和TRB3均參與細胞凋亡[10-12]。國外學者認為,脂毒性較糖毒性更易誘發ERS,參與細胞凋亡,導致IR和胰島功能衰退,出現糖尿病[8-9]。已有研究發現,在INS-1細胞,棕櫚酸誘導GRP78、ATF4、CHOP表達升高,提示FFA引發的ERS反應可能在脂毒性所導致的β細胞凋亡的過程中發揮重要作用[13]。本實驗結果發現,在高脂情況下,血中FFA升高,脂代謝紊亂,大鼠胰腺GRP78、ATF4、CHOP和TRB3的蛋白和mRNA均明顯升高,說明高脂引起凋亡相關蛋白和基因的表達異常誘發ERS,可能參與IR和胰島細胞功能下降有關,與上述研究結果相一致。
Moffett等[14]發現利拉魯肽可減少糖尿病大鼠胰腺β細胞的凋亡,保護胰島β細胞,但是相關機制尚未闡明。本實驗發現利拉魯肽干預后,GRP78、 ATF4、CHOP的蛋白和mRNA及表達明顯下降,提示GLP-1受體激動劑利拉魯肽可能通過ATF4/CHOP通路緩解ERS來保護胰島β細胞功能。已有研究發現TRB3不僅參與動脈硬化病理變化,而且與IR、糖尿病密切相關[15]。本研究發現應用利拉魯肽后不僅改善IR,而且下調了TRB3的表達,但二者之間的具體機制尚不清楚,需進一步研究。近期臨床試驗也證實,利拉魯肽一方面調節紊亂的血脂、血糖,改善IR等心血管危險因素,另一方面也改善患者的胰島β細胞功能[16-18]。
綜上所述,高脂飲食出現脂代謝紊亂和胰島素抵抗和胰島細胞功能受損,應用利拉魯肽后改善IR,調節糖脂代謝,緩解胰腺ERS,抑制ATF4-CHOP-TRB3通路基因的表達,減少胰島細胞凋亡起到保護胰島細胞功能作用,但是利拉魯肽在其他組織中是否通過相同機制改善IR減輕內質網應激,有待進一步研究。
[1]Flamment M,Hajduch E,Ferre P,et al.New insights into ER stress-induced insulin resistance[J].Trend Endocrinol Metab,2012,23(8):381-390.
[2]Tamura K,Minami K,Kudo M,et al.Liraglutide improves pancreatic Beta cell mass and function in alloxan-induced diabetic mice[J].PLoS One,2015,10(5):e0126003.
[3]高宇,王英南,王麗紅,等.增齡對高脂喂養大鼠胰島素抵抗和骨骼肌內脂肪的影響[J].中華老年心腦血管病雜志,2013,15(6):625-627.
[4]Stelmach M,Walkowiak J.Dietary interventions and changes in cardio-metabolic parameters in metabolically healthy obese subjects:a systematic review with Meta-Analysis[J].Nutrients,2016,8(8):455.
[5]Wu Y,Wu T,Wu J,et al.Chronic inflammation exacerbates glucose metabolism disorders in C57BL/6J mice fed with high-fat diet[J].J Endocrinol,2013,219(3):195-204.
[6]Beejmohun V,Mignon C,Mazollier A,et al.Cashew apple extract inhibition of fat storage and insulin resistance in the diet-induced obesity mouse model[J].J Nutr Sci,2015,4(1):e38.
[7]Zheng J,Chen T,Zhu Y,et al.Liraglutide prevents fast weight gain and β-cell dysfunction in male catch-up growth rats[J].Exp Biol Med (Maywood),2015,240(9):1165-1176.
[8]Hirata T,Kawai T,Hirose H,et al.Palmitic acid-rich diet suppresses glucose-stimulated insulin secretion (GSIS) and induces endoplasmic reticulum (ER) stress in pancreatic islets in mice[J].Endocr Res,2016,41(1):8-15.
[9]Cerf E.High fat programming of beta cell compensation,exhaustion,death and dysfunction[J].Pediatr Diabetes,2015,16(2):71-78.
[10]Brewer W.Regulatory crosstalk within the mammalian unfolded protein response[J].Cell Mol Life Sci,2014,71(6):1067-1079.
[11]Kim J,Lee J,Kang S,et al.Ionizing radiation activates PERK/eIF2α/ATF4 signaling via ER stress-independent pathway in human vascular endothelial cells[J].Int J Radiat Biol,2014,90(4):306-312.
[12]Qin J,Fang N,Lou J,et al.TRB3 is involved in free fatty acid-induced INS-1-derived cell apoptosis via the protein kinase C δ pathway[J].PLoS One,2014,9(5):e96089.
[13]Zhu Q,Zhong J,Jin F,et al.Tauroursodeoxycholate,a chemical chaperone,prevents palmitate-induced apoptosis in pancreatic β-cells by reducing ER stress[J].Exp Clin Endocrinol Diabetes,2013,121(1):43-47.
[14]Moffett C,Patterson S,Irwin N,et al.Positive effects of GLP-1 receptor activation with liraglutide on pancreatic islet morphology and metabolic control in C57BL/KsJ db/db mice with degenerative diabetes[J].Diabetes Metab Res Rev,2015,31(3):248-255.
[15]Prudente S,Trischitta V.The TRIB3 Q84R polymorphism,insulin resistance and related metabolic alterations[J].Biochem Soc Trans,2015,43(5):1108-1111.
[16]Marso P,Daniels H,Brown-Frandsen K,et al.Liraglutide and cardiovascular outcomes in type 2 diabetes[J].N Engl J Med,2016,375(4):311-322.
[17]Zhang L,Zhang M,Zhang Y,et al.Efficacy and safety of dulaglutide in patients with type 2 diabetes:a meta-analysis and systematic review[J].Sci Rep,2016(6):18904.
[18]Díaz-Soto G,De Luis DA,Conde-Vicente R,et al.Beneficial effects of liraglutide on adipocytokines,insulin sensitivity parameters and cardiovascular risk biomarkers in patients with type 2 diabetes:a prospective study[J].Diabetes Res Clin Pract,2014,104(1):92-96.
EffectsofliraglutideonATF4/CHOPpathwayofpancreaticbetacellsinratsfedwithhigh-fatdiet
WangPing1,GuoXiaoyu1,GaoYu2△,LiuJian1,ShanXiujie2,ZhangRui2,GeXiaochun2,FengZengbin2,LiGuifang2
(1.ChengdeMedicalUniversity,Chengde,Hebei067000,China;2.DepartmentofEndocrinology,AffiliatedHospitalofChengdeMedicalUniversity,Chengde,Hebei067000,China)
ObjectiveTo observe the effects of liraglutide on GRP78,ATF4,CHOP and TRB3 protein and mRNA expression in rats which fed with high fat diet,and to explore the effect of liraglutide on ATF4/CHOP pathway of pancreas in rats fed with high fat diets.MethodsForty-four male Wistar rats were randomly divided into the control group,high fat group,intervention group 1 and intervention group 2,11 cases in each group.The control group was fed with common food,other 3 groups were fed with high fat diet for 8 weeks.Then the intervention group 1 was given with liraglutide (100 μg·kg-1·d-1) by subcutaneous injection;the intervention group 2 was given liraglutide (200 μg·kg-1·d-1) by subcutaneous injection.After 2 weeks medication intervention,the rats were killed.Five rats were taken from each group and performed the hyperinsulinemic englycemic clamp experiment under waking state for calculating the glucose infusion rate(GIR).The fasting blood glucose(FBG),fasting insulin(FINS),serum free fatty acid(FFA),total cholesterol(TC),triglyceride(TG),low density lipoprotein cholesterol(LDL-C) and high density lipoprotein(HDL) were examined,and islet beta cell function index(HOMA-β) were calculated.PCR and Western blot method were used to detect the expression of pancreas GRP78,ATF4,CHOP and TRB3 protein and mRNA.ResultsCompared with the control group,the levels of FBG,FFA,TC,FINS,TG and LDL-C in the high fat group were significantly increased,the levels of HDL-C,GIR and HOMA-β were significantly decreased(P<0.05 orP<0.01);compared with the high fat group,the levels of HDL-C,GIR and HOMA-β in the intervention group 2 were increased(P<0.05 orP<0.01),the other indicators were significantly decreased;compared with the intervention group 1,blood FGB,FFA,TC in the intervention group 2 were decreased,while the levels of GIR and HOMA-β were increased(P<0.05).Compared with the control group,expression of GRP78,ATF4,CHOP and TRB3 protein and mRNA in the high fat group were significantly increased;compared with the high fat group,the expression of GRP78,ATF4,CHOP and TRB3 protein and mRNA in the intervention group 1 and 2 were gradually decreased with the liraglutide concentration increase.ConclusionLiraglutide can improve insulin resistance and protect pancreatic beta cells in a concentration-dependent manner,its mechanisms may involve in the pancreatic endoplasmic reticulum ATF4/CHOP pathway.
insulin resistance;endoplasmic reticulum stress;ATF4;CCAAT/EBP homologous protein;liraglutide
10.3969/j.issn.1671-8348.2017.27.004
R322.57
A
1671-8348(2017)27-3755-04
2016-11-19
2017-04-07)
王平(1990-),在讀碩士,主要從事糖尿病與脂代謝方面研究。△
,E-mail:yugao815@163.com。

