甘草酸對高糖誘導的腎小球系膜細胞氧化應激損傷的影響*
侯紹章,張 婷,李 媛,伍智慧
(寧夏醫科大學:1.基礎醫學院病理系;2.護理學院,銀川 750004)
甘草酸對高糖誘導的腎小球系膜細胞氧化應激損傷的影響*
侯紹章1,張 婷1,李 媛2,伍智慧1
(寧夏醫科大學:1.基礎醫學院病理系;2.護理學院,銀川 750004)
目的探討甘草酸(GA)對高糖誘導的腎小球系膜細胞氧化應激損傷的影響。方法將HBZY-1細胞分為:正常對照組(NG組)、高糖組(HG組)、高糖+GA組(HG+GA組)。采用四甲基偶氮唑藍(MTT)法檢測細胞增殖活性。用紫外分光光度法檢測超氧化物歧化酶(SOD)和丙二醛(MDA)水平,用激光共聚焦檢測活性氧(ROS)變化。采用免疫組織化學和Western blot檢測錳超氧化物歧化酶(Mn-SOD)蛋白的表達,用Q-PCR檢測Mn-SOD mRNA。結果(1)各組HBZY-1細胞形態變化:HBZY-1細胞為菱形,NG組細胞形態正常,結構清晰可辨;HG+GA組細胞數量略增多,個別細胞胞體略肥大;HG組細胞結構不甚清晰,細胞扁平,數量明顯增多,胞體略肥大。(2)各組HBZY-1細胞的增殖效應:與NG組相比,HG組OD值明顯升高(P<0.05),HG+GA組與HG組相比OD值降低(P<0.05)。(3)RDS含量:HG組RDS相對含量較NG組有所上升,HG+GA組ROS相對含量下降(P<0.05)。(4)各組細胞中Mn-SOD的表達:與NG組相比,HG組Mn-SOD相對表達減少(P<0.05),HG+GA組與HG組相比Mn-SOD表達升高(P<0.05)。結論GA對高糖誘導的HBZY-1細胞異常增殖有一定的抑制作用,GA可通過氧化應激保護高糖誘導腎小球系膜細胞所致的細胞肥大和細胞損傷,GA能調節高糖誘導下Mn-SOD的表達。
甘草酸;腎小球系膜細胞;氧化應激
糖尿病腎病(diabetic nephropathy,DN)是最常見的糖尿病微血管并發癥之一,同時是導致終末期腎衰竭和影響糖尿病患者生活質量的重要原因之一[1]。DN的發病機制至今還未完全闡明,有大量研究證實,在DN的發病過程中,血流動力學改變、糖代謝紊亂、脂代謝紊亂、氧化應激、血管活性物質及細胞因子激活等起了重要作用[2-3]。由于糖、脂代謝紊亂,DN會導致線粒體功能紊亂和體內氧化應激水平的升高[4]。研究證實,高糖誘導細胞線粒體呼吸鏈產生過量活性氧(reactive oxygen species,ROS)是DN并發癥發生的啟動因素[5],而氧化應激表現為ROS、丙二醛(MDA)增多和抗氧化酶超氧化物歧化酶(SOD)活性下降。另外,過多的 ROS會誘導多種細胞因子表達,使腎小球濾過增加,基底膜增厚,參與DN的發病過程,因此抑制腎臟的氧化應激可有效防治DN[6]。
近年來,從中草藥中尋找治療DN可能的方法和藥物成為防治DN的研究熱點。甘草的主要成分甘草酸(glycyrrhizic acid,GA)具有明顯的抗炎、抗病毒、抗氧化、調節免疫功能等多種藥理作用[7]。已有研究表明,GA能明顯改善鏈脲佐菌素(STZ)導致的糖尿病,降低高血糖、高脂血癥及相關的氧化應激,有望成為治療糖尿病的藥物。另外GA還能明顯緩解糖尿病導致的胰臟和腎臟異常,并且降低氧化應激參數,激活糖異生酶的作用。因此,本實驗探討GA對高糖培養的腎小球系膜細胞氧化應激損傷的影響,為DN的防治提供理論依據。
1 材料與方法
1.1儀器與試劑 CO2培養箱(NUAIR-NU-5510E,美國),超凈工作臺(BCM-1300A,蘇凈安泰);GA(日本東京化成工業公司),大鼠腎小球系膜細胞株 HBZY-1(北納創聯生物技術研究院),TTC試劑盒 (南京凱基),細胞培養基DMEM、胎牛血清(FBS)、胰蛋白酶(Hyclone公司)。
1.2方法
1.2.1HBZY-1細胞培養及分組 當HBZY-1細胞生長達到80%融合時,用胰酶消化傳代,置于5% CO2培養箱內37 ℃孵育24、48 h。接種于96孔細胞培養板上,繼續培養48 h使細胞生長融合。將細胞分為:正常對照組(NG組)、高糖組(HG組)和高糖+GA組(HG+GA組)。
1.2.2采用四甲基偶氮唑藍(MTT)法進行細胞增殖檢測 取對數生長期的HBZY-1細胞,按實驗分組分別處理24 h,每孔加入50 μL 1×MTT(5 g/L)孵育4 h,鏡下觀察,MTT 摻入細胞內,吸出上清液,加入150 μL二甲基亞砜(DMSO)使細胞內甲臜溶解,用平板搖床搖勻振蕩10 min,待細胞完全溶解后,放入自動酶標儀490 nm波長讀數,并記錄光密度(OD)值。
1.2.3HBZY-1細胞中ROS的表達 按照1∶1 000用無血清培養液稀釋二氯熒光黃雙乙酸鹽(DCFH-DA)。按照原位裝載探針的方法,取出干預24 h的培養板,去除細胞培養液,加入300 μL稀釋好的DCFH-DA,陽性對照孔加入Rosup作為陽性對照。37 ℃細胞培養箱內孵育30 min,利用激光共聚焦顯微鏡觀察(488 nm激發波長,525 nm發射波長)。
1.2.4各組細胞上清液SOD和MDA測定 取對數生長期的HBZY-1細胞,24 h貼壁換液后,按實驗分組處理24 h,收集各組上清液,操作按試劑盒說明書進行。
1.2.5免疫熒光檢測GA對錳超氧化物歧化酶(Mn-SOD)表達的影響 取對數生長期的HBZY-1細胞,24 h貼壁換液后,按實驗分組處理24 h進行免疫熒光檢測。(1)多聚甲醛室溫固定30 min;(2)0.2% TritonX-100室溫處理20 min;(3)3%H2O2孵育30 min;(4)封閉血清37 ℃ 20 min;(5)Mn-SOD一抗孵育(Mn-SOD滴度為1∶300)4 ℃過夜,陰性對照用PBS;(6)熒光二抗工作液37 ℃孵育30 min;(7)DAPI 復染核。
1.2.6Western blot分析 提取蛋白后電泳,轉膜,一抗孵育,增強化學發光劑顯像,曝光。膜洗脫后再次孵育,β-actin作為內對照。用計算機圖像處理系統分析陽性強度。
1.2.7Q-PCR 使用Trizol試劑提取RNA,根據試劑說明書,使用寡聚(dT)18引物(0.5 μg/μL)以總體積為20 μL的RT試劑盒反轉錄。 使用cDNA和SYBR Green PCR Master Mix在熒光PCR儀(IQ-5)上進行實時PCR。引物為:Mn-SOD正向5′-AAG GAG CAA GGT CGC TTA CAG A-3′;Mn-SOD反向5′-CAA ATG GCT TTC AGA TAG TCA GGT C-3′;mRNA的相對量由2-△△Ct值計算確定。
2 結 果
2.1GA對高糖誘導HBZY-1細胞增殖的影響 本研究預實驗證實GA 為100 μmol/L 時對正常細胞無明顯影響,但對高糖組細胞有抑制作用,作為后續實驗的濃度。GA作用于高糖誘導的HBZY-1細胞24、48 h,MTT法檢測各組細胞的增殖情況。與NG組相比,HG組細胞增殖明顯增加(P<0.05),與HG組相比,HG+GA組細胞增殖受到抑制,差異有統計學意義(P<0.05),見圖1。
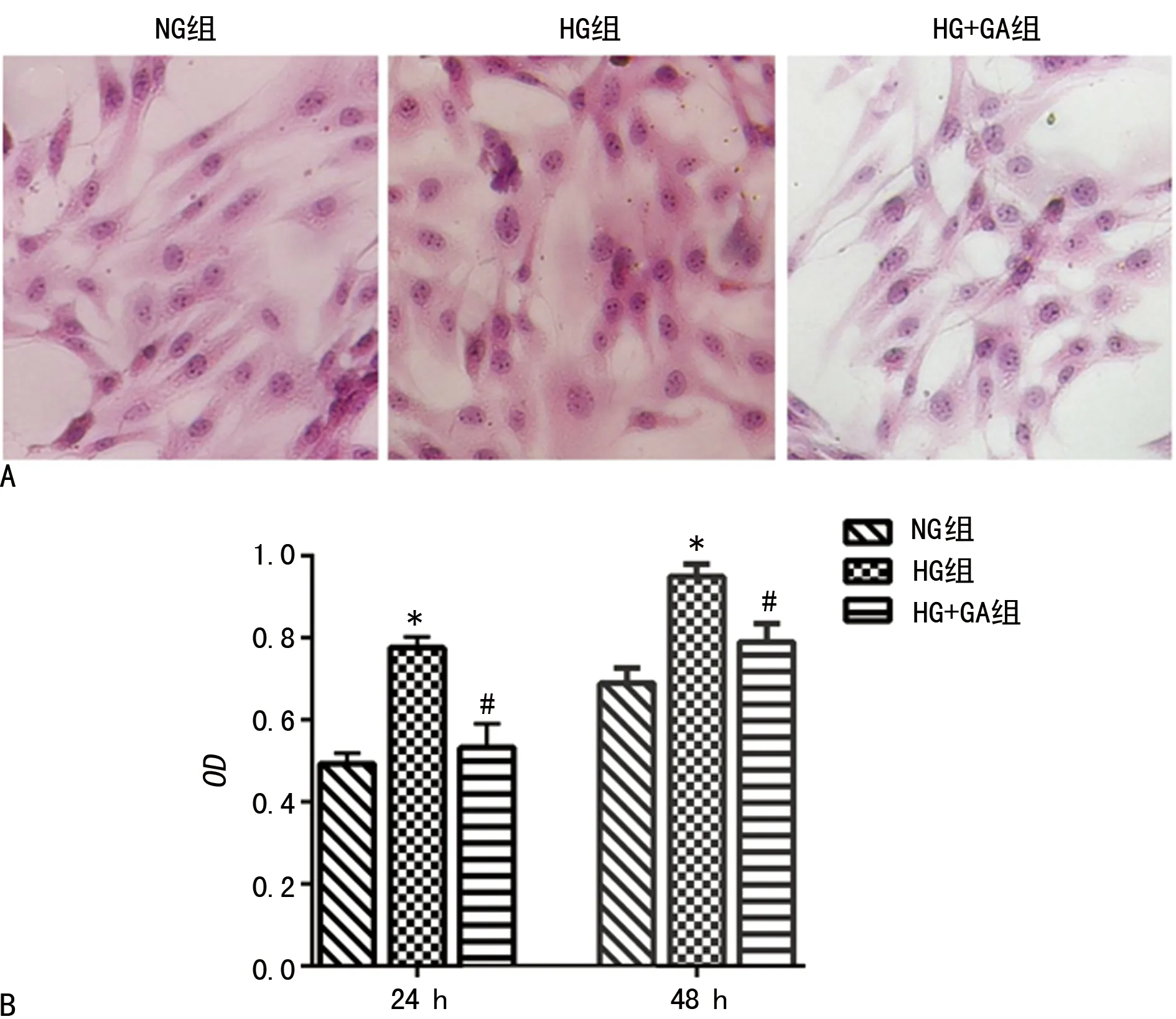
A:各組細胞HE染色(×400);B:MTT分析圖,*:P<0.05,與NG組比較;#:P<0.05,與HG組比較
圖1 GA對高糖誘導HBZY-1細胞增殖的影響
2.2GA對高糖誘導HBZY-1細胞ROS的影響 與NG組相比,HG組中高糖誘導的HBZY-1細胞ROS產生增加,處理24 h后達峰值。GA處理后,ROS降低。 這些數據表明,在給予GA后,似乎有ROS產生的損傷或內源性ROS清除/抗氧化能力的增加。GA可抑制HBZY-1在高糖刺激下ROS的產生,見圖2。
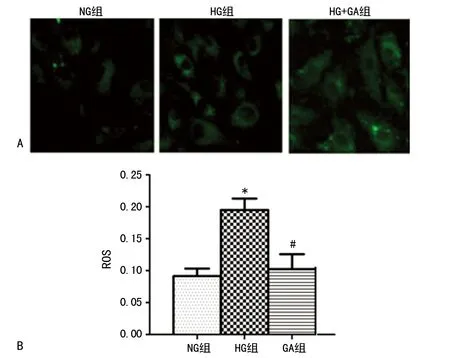
A:處理24 h各組細胞ROS水平(×400);B:激光共聚焦檢測各組細胞ROS水平;*:P<0.05,與NG組比較;#:P<0.05,與HG組比較
圖2 GA對高糖誘導HBZY-1細胞ROS的影響
2.3GA對高糖誘導HBZY-1細胞MDA水平和SOD活性的影響 HBZY-1細胞在高糖誘導下的MDA水平升高,處理24 h達峰值,而SOD活性下降,見圖3。
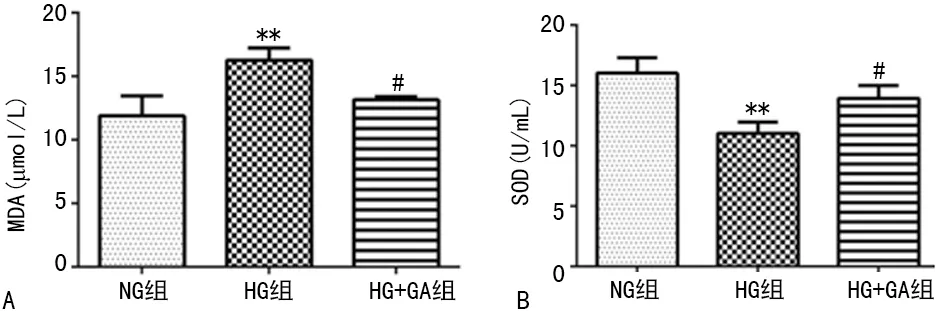
A:MDA水平;B:SOD活性,**:P<0.05,與NG組比較;#:P<0.05與HG組比較
圖3 GA對高糖誘導的HBZY-1細胞MDA水平和SOD活性的影響
2.4GA對高糖誘導HBZY-1細胞中Mn-SOD蛋白表達的影響 與NG組相比, HG組Mn-SOD的表達水平降低。相比之下,GA治療24 h內引起HBZY-1細胞的Mn-SOD蛋白表達增加。在各組中,Mn-SOD mRNA水平上變化與蛋白水平相似,見圖4。
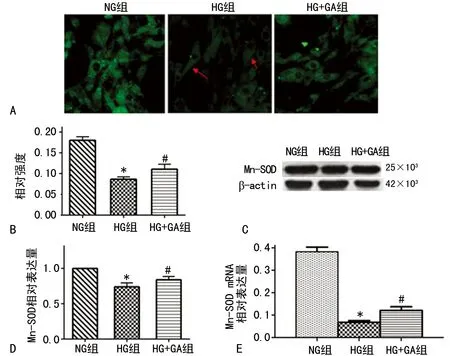
A:免疫熒光法檢測各組中Mn-SOD蛋白表達(×400);B:免疫組織化學檢測Mn-SOD的表達率;*:P<0.05,與NG組比較;#:P<0.05,與HG組比較。C:Western blot檢測各組中Mn-SOD蛋白表達;D:Mn-SOD蛋白率。E:Mn-SOD mRNA表達,*:P<0.05,與NG組比較;#:P<0.05,與HG組比較
圖4 HBZY-1細胞中Mn-SOD mRNA水平
3 討 論
DN作為糖尿病最常見的并發癥,近年來已成為糖尿病致死、致殘的主要原因,因此許多國內外腎臟病學者把關注方向定于DN致病因素及機制研究。DN發病過程包括氧化應激、血管活性物質及細胞因子、糖代謝紊亂及由此導致的非酶糖化、多元醇通路激活、蛋白激酶C信號途徑活化、血管活性物質及細胞因子等引起[2]。目前研究表明,氧化應激在DN的發病過程中起重要作用。氧化應激最主要的表現為ROS產生增多,從而引起機體一系列的損傷。糖尿病狀態下腎臟氧化應激的發生與3個方面因素有關:機體ROS 大量增加;非酶性抗氧化分子減少;腎組織內的抗氧化酶活性改變。而ROS產生過多,可激活細胞內信號傳導系統如p38/MAPK、ERK和JNK/SAPK、活化轉錄因子、表達轉化生化因子-β(TGF-β)等活性產物,使細胞外基質(ECM)蛋白合成增加,降解減少,導致DN的發生和發展[3]。在DN的發病機制中,如何有效降低氧化應激損傷成為關注熱點。本實驗通過MTT法檢測,發現GA能夠顯著提高高糖誘導產生氧化應激損傷的腎小球系膜細胞活力,提高細胞存活率,降低細胞內由高糖誘導的ROS產生。
DN的發病機制之一就是高血糖所導致的代謝異常,最終導致氧化應激反應,即線粒體電子傳遞鏈形成的超氧化物增多。而氧化應激的主要表現為ROS、MDA的增多和抗氧化酶SOD活性的下降。另外,有研究顯示,高糖所致的腎皮質損傷也與氧化應激有關。在DN的發病中,氧化應激起到了關鍵的作用。在糖尿病/高血糖狀態下,大多數組織都會產生大量的活性氧。在DN時,腎小球系膜細胞能夠產生過量的ROS。同時,腎小球系膜細胞在高糖環境下生長,氧化應激是由自由基在體內產生的一種負面作用。在高糖環境中,氧化應激反應的主要表現為ROS產生增多[8-9]。同時,ROS可以與蛋白質、核酸等發生反應,從而引起炎性反應、細胞凋亡和細胞增殖等。另外,在DN中ROS與細胞增殖和DNA合成有密切的關系。在糖尿病/高血糖中,活性氧ROS主要在線粒體產生,因此ROS也可以破壞線粒體[10]。除了ROS在氧化應激中起到重要作用外,中和降解內源性抗氧化劑在細胞內氧化應激反應中也起到了重要的作用。例如,Mn-SOD也稱作SOD2,是一種重要的抗氧化酶,Mn-SOD的主要作用是調節ROS的新陳代謝。所以,當Mn-SOD代謝紊亂時會導致ROS的產生增多,進而引起DN損傷。
另外,有研究表明,白藜蘆醇能夠改善高脂飲食引起的肥胖癥和胰島素抵抗,其主要作用也是通過調節AMPK/SIRT1通路而增加Mn-SOD的合成[11]。還有研究表明,SIRT1能夠改善糖尿病/高血糖導致的內皮細胞損傷,主要是通過上調Mn-SOD的表達而發揮作用[12]。氧化應激反應能夠導致MDA的產生過多,并且能夠導致8-OHdG相應的增加而誘導DNA氧化損傷。因此,SOD水平和MDA表達量是氧化應激反應的重要標志物,引起氧化應激標志物變化的原因之一就是抗氧化酶的活性降低,從而導致細胞損傷。另外有研究證實,GA能夠通過抗氧化作用減緩四氯化碳誘導的小鼠肝損傷。前期實驗證實GA對DN具有保護作用,其涉及的可能分子機制與氧化應激有關。本研究利用免疫組織化學及Western blot方法檢測Mn-SOD表達變化,結果表明Mn-SOD在正常腎小球系膜細胞中有表達,在高糖組中Mn-SOD蛋白表達減少,而HG+GA組中表達有所增加,說明GA能促進高糖誘導HBZY-1細胞中Mn-SOD蛋白的表達,抑制ROS,對高糖誘導的HBZY-1細胞損傷具有保護作用。
綜上所述,GA可以減輕高糖誘導的腎小球系膜細胞的氧化應激損傷,其主要機制與降低胞內 ROS 產生和增加Mn-SOD蛋白的表達有關。本實驗中GA減緩氧化應激損傷具體機制并未闡明,還有待進一步的驗證。
[1]李棟,林珊.microRNAs在糖尿病腎病發病機制中的作用[J].天津醫藥,2015,43(6):698-701.
[2]AghadavodE,KhodadadiS,BaradaranA,etal.Roleofoxidativestressandinflammatoryfactorsindiabetickidneydisease[J].IranJKidneyDis,2016,[6]Worley MJ,Liu S,Hua Y,et al.Molecular changes in endometriosis-associated ovarian clear cell carcinoma[J].Eur J Cancer,2015,360(13):1831-1842.
[7]陳安安,汪炬.腫瘤中雌激素信號轉導通路的研究進展[J].中國病理生理雜志,2012,28(3):570-576.
[8]Lai CR,Hsu CY,Chen YJ ,et al.Ovarian cancers arising from endometriosis:a microenvironmental biomarker study including ER,HNF-1β,p53,PTEN,BAF250a,and COX-2[J].J Chin Med Assoc,2013,76(11):629-634.
[9]DeLair D,Oliva E,Kobel M,et al.Morphologic spectrum of immunohistochemically characterized clear cell carcinoma of the ovary:a study of 155 cases[J].Am J Surg Pathol,2011,35(1):36-44.
[10]Tsuchiya A,Sakamoto M,Yasuda J,et al.Expression profiling in ovarian clear cell carcinoma:identification of hepatocyte nuclear factor-1 beta as a molecular marker and a possible molecular target for therapy of ovarian clear cell carcinoma[J].Am J Pathol,2003,163(6):2503-2512.
[11]Carli C,Metz CN,Al-Abed Y,et al.Up-regulation of cyclooxygenase-2 expression and prostaglandin E2 production in human endometriotic cells by macrophage migration inhibitory factor:involvement of novel kinase signaling pathways[J].Endocrinology,2009,150(7):3128-3137.
[12]Sivula A,Talvensaari-Mattila A,Lundin J,et al.Association of cyclooxygcnase-2 and matrix metallop roteinase-2 expression in human breast cancer[J].Breast Cancer Res Treat,2005,89(3):21-25.
[13]易金玲,沈艷麗,馮文廣,等.子宮內膜異位癥患者異位內膜組織中miR-556-3 p、VEGF 表達變化 [J].山東醫藥,2016,56(7):50-52.
Influenceofglycyrrhizicacidonoxidativestressinjuryofglomerularmesangialcellsinducedbyhighglucose*
HouShaozhang1,ZhangTing1,LiYuan2,WuZhihui1
(1.DepartmentofPathology,BasicMedicalCollege;2.SchoolofNursing,NingxiaMedicalUniversity,Yinchuan,Ningxia750004,China)
ObjectiveTo investigate the influence of glycyrrhizic acid (GA) on oxidative stress injury in glomerular mesangial cells (HBZY-1) induced high glucose.MethodsHBZY-1 was cultured and divided into the normal control group,high glucose group and high glucose + GA group.The cell proliferation activity was measured by MTT assay.UV spectrophotometry was used to detect the SOD and MDA levels.And the ROS changes were detected by laser confocal microscopy.Immunohistochemistry and Western blot were used to detect the expression of Mn-SOD protein in various groups.Mn-SOD mRNA was detected by Q-PCR.Results(1)The morphological changes in each group:HBZY-1 cells were diamond-shaped,cells were normal and the structure was clear in the NG group.In the HG+GA group,the number of cells was increased slightly,individual cell body was slightly hypertrophy.The cell structure in the HG group was not clear,the cells appeared flat,the number was increased significantly,the cell body was slightly hypertrophy.(2)The proliferative effect of HBZY-1 in each group:compared with the NG group,the OD value in the HG group was significantly increased,and the OD value in the HG+GA group was decreased compared with the HG group(P<0.05).(3)The relative content of ROS in the HG group was higher than that in the NG group,and which in the HG+GA group was decreased (P<0.05).(4)The expression of Mn-SOD in each group:the relative expression of Mn-SOD in the HG group was significantly lower than that in the NG group (P<0.05),and the expression of Mn-SOD in the HG+GA group was increased compared with the HG group(P<0.05).ConclusionGlycyrrhizic acid has a certain inhibiting effect on the abnormal proliferation of HBZY-1 induced by high glucose.Glycyrrhizic acid can protect the cell hypertrophy and cell damage caused by glomerular mesangial cells via oxidative stress,and glycyrrhizic acid can regulate the Mn-SOD expression induced by high glucose.
glycyrrhizic acid;mesangial cell;oxidative stress
10.3969/j.issn.1671-8348.2017.27.001
R364
A
1671-8348(2017)27-3745-03
2016-12-08
2017-05-26)
國家自然科學基金資助項目(81160106)。
侯紹章(1975-),博士,副教授,主要從事糖尿病腎病及腫瘤的基礎和臨床研究。

