談“水溶液中的離子平衡”的高效課堂模式
葉詠祝
摘 要:不管對于教還是學,水溶液中的幾大平衡一直是高中化學的難點,學生處于“一學就會,學完就混”的狀況。要解決這樣的困擾,需要教師對教學內容有一個高層次的把控。
關鍵詞:水溶液 離子平衡 高效課堂
中圖分類號:G63 文獻標識碼:A 文章編號:1003-9082 ( 2017 ) 08-0-01
當下的高中生深受灌輸模式的影響,不會主動學習與思考,只愿通過“聽講、抄板書、記背”等方式被動學習。另一方面,教師也深知學生的特點,不信任、不放心學生,包辦得太多,在課堂上講得龍飛鳳舞,知識不分巨細講得清清楚楚。這樣使得學生的學習能力和教師的教學能力得不到很好的發展,唯有改革,提高課堂效率,才能符合時代的要求。
人教版高中化學選修4第三章“水溶液中的離子平衡”這一內容,不管對于教還是學,一直是高中化學的難點。傳統教學法是將教學內容按照順序,逐個分析講練,其階段性效果較佳,但由于每一內容細化之后考點多、難,總歷時長,而幾大平衡之間既相似又有本質的區別,所以學生都是處于“一學就會,學完就混”的狀況。要解決這樣的困擾,需要教師對教學內容有一個高層次的把控,讓學生少在無謂的地方纏繞、困擾、混亂。若能從一開始就對本章的內容有高屋建瓴的認識,或許就能解決問題。
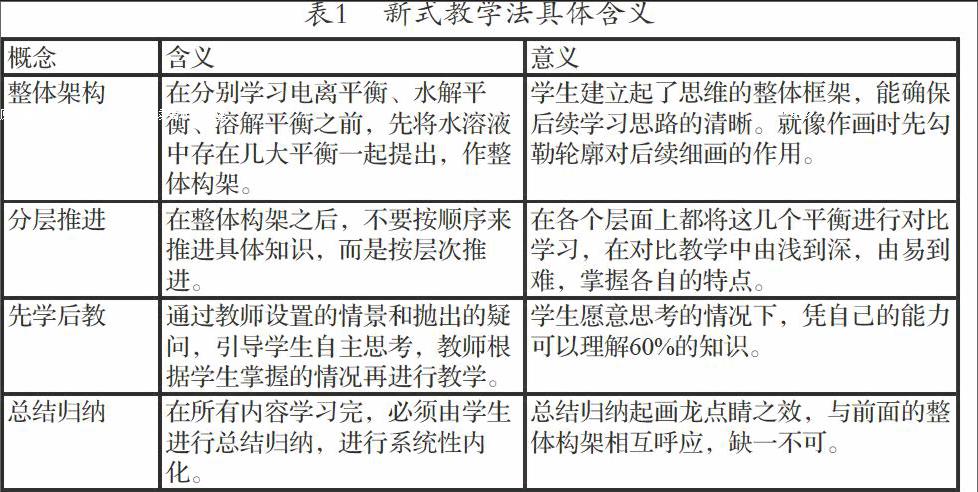
鑒于此,筆者建議使用“整體架構,分層推進,先學后教,總結歸納”的方法。其具體含義見表1。
根據其含義,分層推進的具體操作方法如下:
一、第一層次,認識(了解)幾大平衡
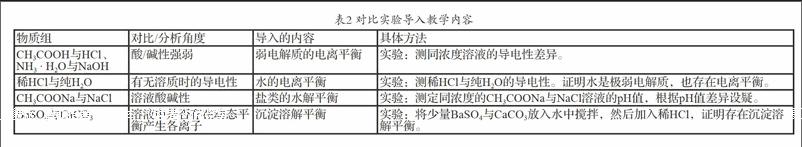
首先從物質分類的角度,舉幾種物質讓學生分析物質的組成特點,再分組探究其在水溶液中的情況,分組情況參考表2。
課堂上可通過設以下問題引導學生思考:
1.溶液的導電能力取決于什么?
2.弱酸/堿比同濃度的強酸/堿溶液導電能力弱,說明什么問題?
3.純水能導電嗎?其導電能力如何?說明什么?
4.所有鹽溶液都呈中性嗎?若鹽自身不能產生H+/OH—,為什么還會使溶液呈酸/堿性?
5.為什么CaCO3能溶于鹽酸而BaSO4不能溶于鹽酸?只有難溶物才存在沉淀溶解平衡嗎?
二、第二層次,理解(掌握)幾大平衡
水溶液中的幾大平衡均符合前面所學的化學平衡狀態的規律與特點。因而在討論它們的許多問題上,學生是有知識儲備、有能力去自己分析的,教師只需引導好學生的思考方向即可。在這一層次中要落實的內容比較多,主要有:
1.影響因素
可讓一部分學生提出具體的變量,再由另一部分學生來分析影響過程及結果,教師將學生出現散亂的地方指出,再由學生歸類并總結規律,如“同離子效應”、幾大平衡的熱效應等等。
2.平衡常數
所有平衡常數都僅是溫度的函數,而弱電解質的電離常數Ka、Kb與鹽類水解常數Kh只是普通的化學平衡常數,學生掌握其表達式的書寫及其大小所反映出的問題即可。但是難點在于Kw和Ksp,這里可由教師出面講解,重點在于二者的由來與意義,先使學生接受它們,不著急涉及計算。
3.溶液的酸堿性與pH值
溶液酸堿性的判斷與pH值的簡單計算,應以題帶練,用題目來鞏固與落實,所以教師在選題方面很關鍵。題目要考查的問題有:
(1)如何判斷溶液的酸堿性?
(2)如何計算溶液的pH值?[pH公式的運用]
(3)如何通過Kw計算c(H+)或c(OH—)?(Kw的應用)
(4)混合溶液pH值的計算。(考慮混合后溶質反不反應,培養學生思維的嚴謹性和提高計算能力)
(5)調控pH值在沉淀的生成與溶解方面的應用。(利用Ksp進行簡單計算)
三、第三層次,綜合應用
本階段涉及內容有:粒子濃度大小比較及守恒關系(建議舍棄質子守恒,以減輕學生負擔,遇到較難的式子,則聯合使用電荷守恒與物料守恒去分析),幾大平衡之間的相互影響,圖像分析,沉淀溶解平衡在生產生活中的應用等。與前面類似,教師的關鍵作用也是在于選題,而在課堂上,則可引導學生以小組形式展開競爭,選代表發言、展示,互評互糾,將這些理論性強的、難度大的內容通過各種模式將學生帶動起來,讓枯燥的啃知識型學習變為競爭型學習,化無趣為有趣。
在“整體架構,分層推進,先學后教,總結歸納”的方法中,“先學后教”應用于每一課時,而“總結歸納”主要在于最后,但在過程中也應隨時隨地讓學生進行對比分析、完成總結歸納。
這一章的內容所需的課時較多,不同的學校、不同的學生,基礎有異,教師可根據教學實際需要安排課時。與傳統教學對比,這種教學方式在學生學習某個平衡的階段性效果上,可能沒有明顯優勢、學生思維可能并沒有很清晰。但在學生學完以后,其思維混亂程度卻有很大的改善,同時學生學習能力也得以提高。

