肺腺癌組織中PI3K、p-AKT1蛋白表達的變化及意義
王言森 ,曹洪麗
(1山東省交通醫院,濟南250013;2首都醫科大學附屬北京康復醫院)
肺腺癌組織中PI3K、p-AKT1蛋白表達的變化及意義
王言森1,曹洪麗2
(1山東省交通醫院,濟南250013;2首都醫科大學附屬北京康復醫院)
目的 觀察肺腺癌組織中磷酸肌醇3激酶(PI3K)、活化的絲氨酸/蘇氨酸蛋白激酶1(p-AKT1)表達水平及微血管密度(MVD)的變化,并探討其三者之間及與患者臨床病理特征、總生存期的關系。方法 接受根治性手術切除治療的肺腺癌患者129例,取其癌組織及癌旁組織,利用免疫組化法檢測組織中PI3K、p-AKT1蛋白表達及MVD,分析各指標之間及與患者臨床病理特征、總生存期的關系。結果 癌組織與癌旁組織PI3K蛋白表達陽性率分別為66%和19%, p-AKT1蛋白表達陽性率分別為52%和11%,二者在癌組織中的表達均高于癌旁組織(P均<0.05)。癌組織MVD高于癌旁組織(P<0.01)。PI3K、p-AKT1蛋白表達水平及MVD與臨床分期、分化程度、淋巴結轉移有關(P均<0.05)。PI3K、p-AKT1蛋白高表達者總生存期短于低表達者(P均<0.05)。PI3K、p-AKT1蛋白高表達者MVD高于低表達者(P均<0.05)。結論 肺腺癌組織中PI3K、p-AKT1水平升高,其可促進腫瘤微血管形成,參與腫瘤的發生發展,且與患者預后有關。
肺腺癌;磷脂酰肌醇3激酶;蛋白激酶B;微血管密度
肺癌是人類死亡的主要原因,肺腺癌是肺癌中發病率最高的病理類型。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(也稱AKT)信號通路參與多種腫瘤發生發展過程,PI3K/AKT的活化可以引發下游信號分子的過度活化,從而促進腫瘤血管生成、細胞增殖、抑制細胞凋亡。但是該通路在肺腺癌組織中的研究相對較少。本研究中,我們了觀察肺腺癌組織中PI3K、活化的絲氨酸/蘇氨酸蛋白激酶1(p-AKT1)蛋白表達及MVD的變化,并探討了其三者之間及與臨床病理特征、總生存期的關系。
1 資料與方法
1.1 臨床資料 2008年1月1日~2011年1月1日在山東省交通醫院接受根治性手術切除治療的肺腺癌患者129例,均經病理學檢查確診,符合1999年世界衛生組織中肺腫瘤診斷標準。其中男78例、女51例,年齡33~82歲、中位年齡48.4歲。吸煙者89例、不吸煙者40例。TNM分期中Ⅰ期54例、Ⅱ期37例、Ⅲ期38例;出現淋巴結轉移77例、無淋巴結轉移52例。納入標準:初治未經放化療者;無遠處轉移、接受根治性切除手術;病理確診為肺腺癌,且本研究中復驗病理也為肺腺癌;病例資料完整、腫瘤組織蠟塊標本于本院病理科保存完整等。排除復治者;經過放化學治療者;有遠處轉移者;病例資料不完整者。
1.2 組織PI3K、p-AKT1蛋白表達及MVD的檢測 術后10 min內取患者腫瘤部位以及癌旁部位組織(距離癌組織>5 mm),經10%甲醛固定,石蠟包埋制成病理蠟塊,首先進行蘇木精-伊紅染色,閱片明確腫瘤的類型、分化程度、浸潤深度等,并與原始病理資料作比較。確定為癌以及癌旁組織后,將相應蠟塊切片進行免疫組化染色。具體步驟為:切片后恒溫60 ℃烤片12 h;二甲苯及梯度乙醇脫蠟;高壓抗原修復;過氧化氫阻斷內源性過氧化物酶活性;山羊血清封閉;分別滴加抗PI3K一抗(稀釋比例1∶200)、抗p-AKT1一抗(稀釋比例1∶200)、CD34一抗(稀釋比例1∶150),濕盒孵育;二抗孵育;滴加SP液;DAB顯色;自來水沖洗終止顯色;蘇木素復染細胞核;梯度乙醇脫水;封片;顯微鏡下觀察染色結果。高倍鏡(×200)下計數CD34染色陽性的微血管數目,計算每平方米中微血管數目,取3個數的平均數作為該病例的MVD值。將全部病例的中位MVD值17(6~42)作為分界,分為低MVD組和高MVD組。
1.3 陽性結果判定 采用雙盲法,由兩位病理科醫師分別獨立對石蠟切片在光學顯微鏡下進行觀察。PI3K蛋白陽性染色為胞質內黃色顆粒沉著,p-AKT1蛋白陽性染色為胞質和(或)細胞核著棕黃色或棕褐色,高倍視野(×400)下隨機選取3個清晰視野,計算陽性細胞占細胞總數的百分比,并取均值。依照染色強度評分:無著色為0分,著淺黃色為1分,著棕黃色為2分,著褐色為3分;依照陽性細胞百分比評分:<10%為0分,10%~25%為1分,﹥25%~50%為2分,>50%為3分。兩種分數相乘得到最終染色評分,其中PI3K評分中位數為6分,p-AKT1評分中位數為4分,分別將PI3K和p-AKT1的染色評分中位數作為分界,分為低表達和高表達組,并進行后續的數據分析。
1.4 隨訪 截止隨訪日期2016年6月23日,患者中位生存期為35.8個月,5年生存率為18%,其中Ⅰ期患者50%以上存活,Ⅱ期患者中位生存期39.1個月,Ⅲ期患者中位生存期15.8個月。截止至隨訪日期,23例患者仍生存。根據確診時間和死亡時間計算總生存期(OS)。

2 結果
2.1 癌組織與癌旁組織PI3K、p-AKT1蛋白表達及MVD的比較 癌組織與癌旁組織PI3K蛋白表達陽性率分別為66%(86/129)和19%(25/129), p-AKT1蛋白陽性率分別為52%(68/129)和11%(15/129)。癌組織中的兩種蛋白的表達高于癌旁組織(P均<0.05)。癌組織與癌旁組織MVD值分別為(17.56±6.4)、(3.56±0.2)個/mm2,癌組織中MVD高于癌旁組織(P<0.01)。
2.2 癌組織PI3K、p-AKT1蛋白表達及MVD與肺腺癌患者臨床病理特征的關系 PI3K蛋白陽性染色為胞質內黃色顆粒沉著,p-AKT1蛋白陽性染色為胞質和(或)細胞核著棕黃色或棕褐色。CD34表達于微血管內皮細胞,陽性呈棕黃色。相對于高或中分化、腫瘤分期Ⅰ~Ⅱ期及無淋巴結轉移患者,低分化、腫瘤分期Ⅲ期、有淋巴結轉移的患者中,PI3K、p-AKT1蛋白表達高,MVD高(P均<0.05)。
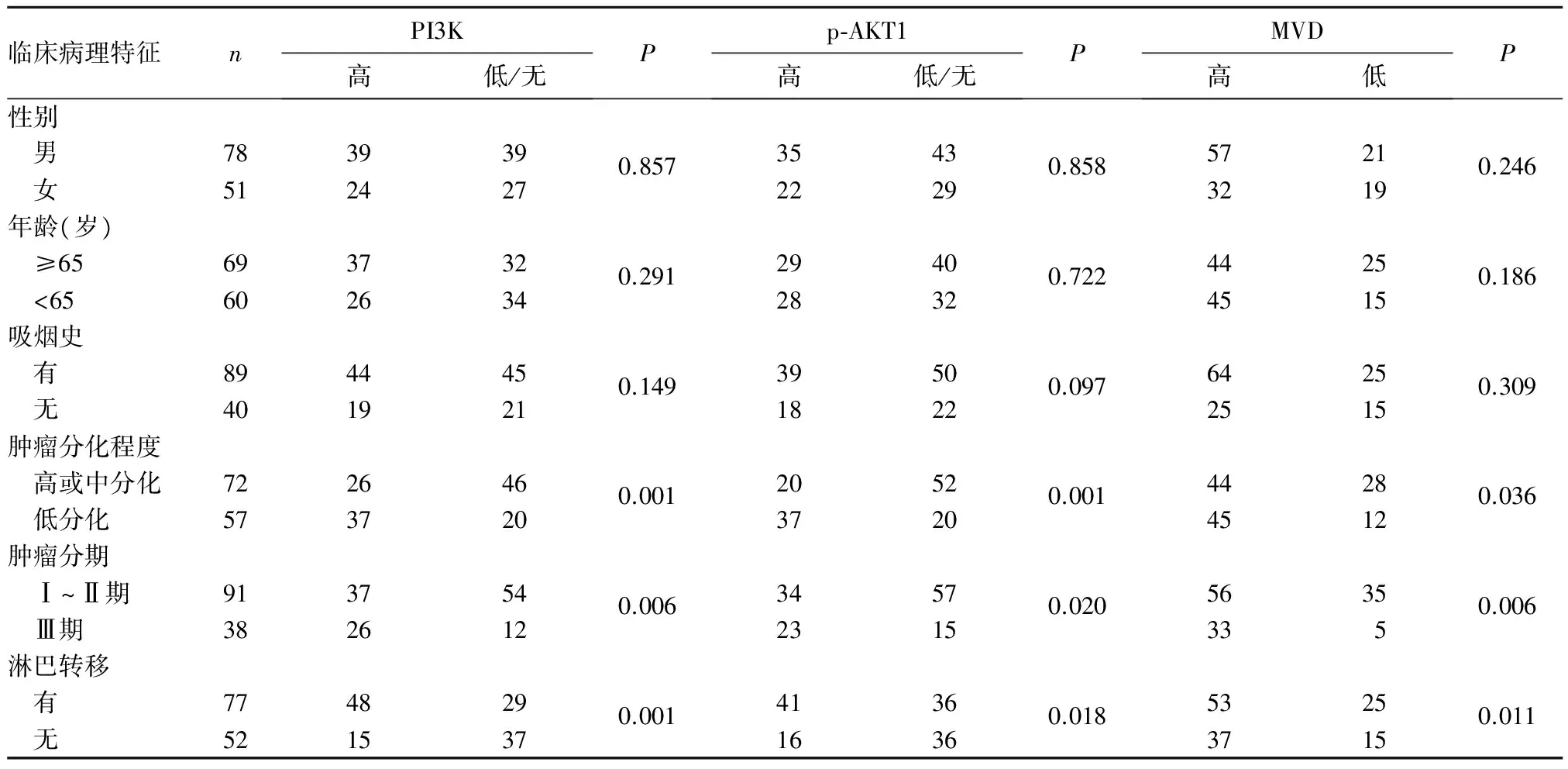
表1 癌組織PI3K、p-AKT1蛋白表達及MVD與肺腺癌患者臨床病理特征的關系(例)
2.3 不同PI3K、p-AKT1蛋白表達水平及MVD患者生存期比較 PI3K高表達組的中位總生存期為26.4個月,低表達組為36.3個月,兩組比較,P=0.013。p-AKT1高表達組的中位生存期為25.4個月,低表達組為33.7個月,兩組比較,P=0.019。高MVD組的中位生存期為24.9個月,低MVD組為38.3個月,兩組比較,P=0.001。見圖1。
2.4 不同PI3K、p-AKT1蛋白表達水平肺腺癌患者MVD比較 肺腺癌PI3K高表達者癌組織中MVD為(23.87±9.70)個/mm2,低表達者(12.37±4.50)個/mm2。PI3K高表達者MVD高于低表達者(t=-6.234,P<0.01)。肺腺癌p-AKT1高表達者癌組織中MVD為(21.54±7.90)個/mm2,低表達者(15.79±6.30)個/mm2。p-AKT1高表達者MVD高于低表達者(t=-3.234,P<0.05)。
3 討論
肺癌是世界上最常見的惡性腫瘤[1],嚴重威脅全世界人口的健康和生命。PI3K/AKT信號通路是腫瘤研究的熱門通路,在多種腫瘤組織內均發現該通路中蛋白表達失調。PI3K有兩種激活方式[2],一種是與具有磷酸化酪氨酸殘基的生長因子受體或連接蛋白相互作用, 引起二聚體構象改變而被激活;另一種是通過Ras和p110直接結合導致PI3K活化。PI3K活化的結果是在質膜上產生第二信使PIP3,PIP3與細胞內含有PH結構域的信號蛋白AKT和PDK1結合,促使AKT蛋白的Ser308位點磷酸化而被激活。既往研究證明,PI3K信號級聯反應通路在非小細胞肺癌的發生發展中起重要作用[3,4],這一通路促進多種與肺癌細胞生長和繁殖相關的細胞功能,如細胞增殖、遷移和血管生成[5]。AKT1是PI3K途徑中重要的分子,活化的AKT1可以磷酸化下游多個細胞激酶[6],從而調節細胞凋亡和蛋白質的翻譯等。PI3K/AKT途徑在肺腺癌中被激活,并與低分化、進展期和淋巴結轉移等相關。而高PI3K/AKT通路高度活化的肺腺癌患者生存率降低。本研究中,肺腺癌組織內PI3K表達與腫瘤分期、分化程度、淋巴轉移有相關性,且PI3K表達水平是影響肺腺癌患者預后的影響因素,提示PI3K與肺癌的發生發展有關。
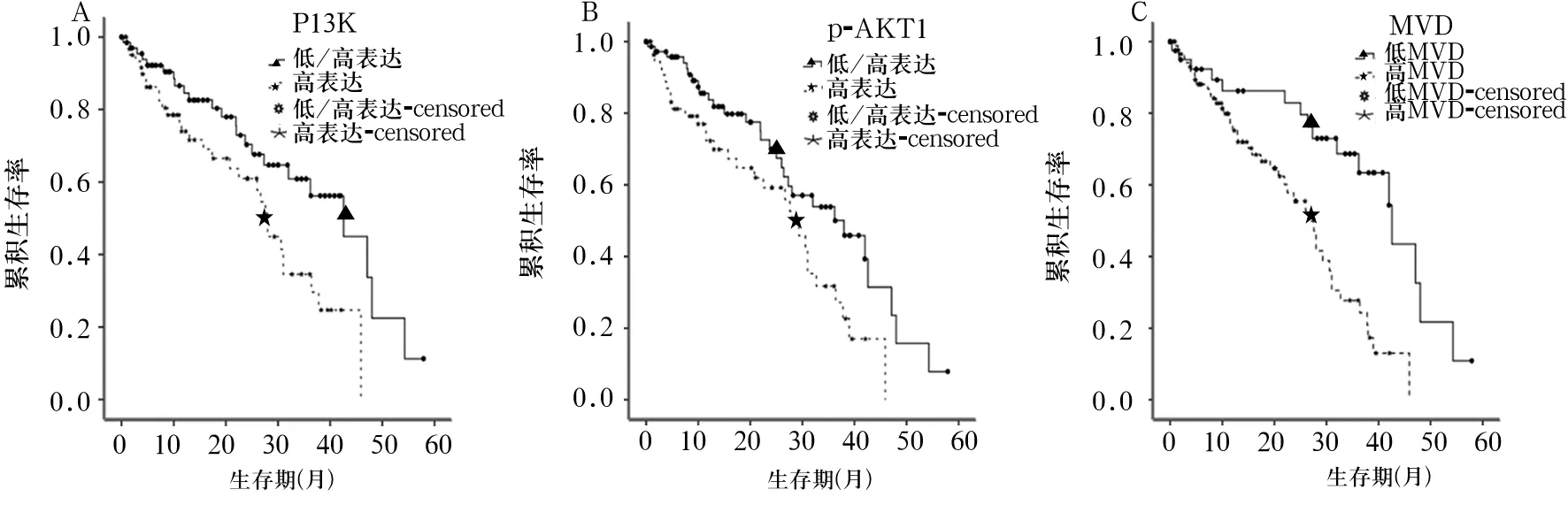
圖1 不同PI3K、p-AKT1表達水平及MVD的肺腺癌患者生存曲線(Kaplan-Meier法)
AKT是一種57 kD的絲氨酸/蘇氨酸激酶,哺乳動物體內含有3種AKT基因,分別為AKT1、AKT2和AKT3。其中AKT1基因定位于染色體14q32位置,且在腦組織、心臟組織和肺組織中表達最多,故本研究采用AKT1蛋白進行研究。磷酸化的AKT1從細胞膜附近轉移到細胞質和細胞核,可調控下游蛋白的磷酸化來控制細胞的凋亡、侵襲、血管生成等過程。有研究證實,在人支氣管上皮細胞發生惡變之前AKT的活化程度即開始增高。AKT還可通過p53上的結合蛋白磷酸化而促進p53降解,進而抑制細胞凋亡;可促使細胞周期蛋白cyclinD1降解,也可抑制p21,促進細胞從G1期進入S期,促進細胞增殖;通過抑制細胞凋亡,促進細胞增殖,從而增強腫瘤細胞的增殖能力。本研究中,p-AKT1與肺腺癌的組織分化程度、臨床分期和淋巴轉移相關,且是肺腺癌預后的影響因素之一,可見PI3K/AKT通路可促進肺腺癌的發生發展。
異常血管的形成是實體腫瘤發生發展的重要步驟。1971年Folkman首次提出腫瘤依賴新生血管生長。血管生成理論認為,腫瘤早期需要通過彌散作用獲得營養,隨著腫瘤體積增長,需要形成新生血管來獲得其生長所需要的養分。研究證明,PI3K/AKT通路參與腫瘤異常血管生成的過程。AKT激活后,促使c-Jun/AP-1蛋白耦聯并結合到COX-2啟動子相應位點上,促使COX-2轉錄表達,并促進前列腺素E2的生物合成和釋放,從而促進血管形成。AKT活化后通路還可上調氧誘導因子1α(HIF-1α),HIF-1α可促進強效促血管生成劑血管內皮生長因子的合成和分泌,促使血管形成。本研究中,PI3K和p-AKT高表達者,MVD高,提示在肺腺癌中PI3K/AKT信號轉導通路參與腫瘤新生血管生成,從而影響患者的生存期。PI3K/AKT影響肺腺癌患者異常血管生成的具體機制仍需要進一步研究,目前針對PI3K/AKT通路的抑制腫瘤藥物仍在研發過程中,需要更多的科研實驗以及臨床實驗探索達到延長肺腺癌患者生存的目的。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015,65(1):5-29.
[2] Rodrigues GA, Falasca M, Zhang Z, et al. A novel positive feedback loop mediated by the docking protein Gab1 and phosphatidylinositol 3-kinase in epidermal growth factor receptor signaling[J]. Mol Cell Biol, 2000,20(4):1448-1459.
[3] Carnero A. The PKB/AKT pathway in cancer[J]. Curr Pharm Des, 2010,16(1):34-44.
[4] Scrima M, De Marco C, Fabiani F, et al. Signaling networks associated with AKT activation in non-small cell lung cancer (NSCLC): new insights on the role of phosphatydil-inositol-3 kinase[J]. PloS One, 2012,7(2):e30427.
[5] Datta SR, Brunet A, Greenberg ME. Cellular survival: a play in three Akts[J]. Genes Dev, 1999,13(22):2905-2927.
[6] Manning BD, Cantley LC. AKT/PKB signaling: navigating downstream[J]. Cell, 2007,129(7):1261-1274.
曹洪麗(E-mail:343997118@qq.com)
10.3969/j.issn.1002-266X.2017.29.022
R734.2
B
1002-266X(2017)29-0065-03
2017-05-03)

