紫色紅曲霉液態發酵產糖化酶的工藝研究
陳景智,林 娟,葉秀云,徐美愛,李雯娟,鄧香圳(福州大學,福建省海洋酶工程重點實驗室,福建福州 350116)
?
紫色紅曲霉液態發酵產糖化酶的工藝研究
陳景智,林 娟*,葉秀云,徐美愛,李雯娟,鄧香圳
(福州大學,福建省海洋酶工程重點實驗室,福建福州 350116)
通過培養基和發酵條件的優化提高紫色紅曲霉G6液態發酵產糖化酶活力。研究接種菌齡、碳源、氮源、金屬離子、培養基初始pH、接種量、裝液量、搖床轉速以及溫度等對產酶的影響。結果表明,最佳培養基配方(w/v)為大米粉8%,蛋白胨1%,KCl 0.1%,ZnSO40.01%,FeSO40.005%,MnSO40.015%,培養基初始pH為4.0;最適發酵條件:裝液量50 mL/250 mL,轉速150 r/min,溫度32 ℃,接種量12%(v/v);在此條件下發酵10 d,糖化酶活力為1652.36 U/mL比優化前(109.54 U/mL)提高了14.08倍。
紫色紅曲霉,糖化酶,培養基,發酵條件
紅曲是一種傳統的中藥材,具有消食活血,健脾燥胃,治腳氣、哮喘、咳嗽等作用,早在宋代初期便有用紅曲煮肉的記錄[1]。紅曲菌代謝產物眾多,包括具有降膽固醇功效的Monacolin K[2-3],降血壓活性的氨基丁酸,可促進人體對鈣磷吸收的麥角甾醇和作為食用色素的紅曲色素等多種活性物質[4],還包括淀粉酶、葡萄糖淀粉酶(糖化酶)、蛋白酶、果膠酶、酯化酶等多種酶類物質[5-6]。
糖化酶是世界上生產量最大應用范圍最廣的酶類之一,已被廣泛應用于葡萄糖、果葡糖漿、釀酒、發酵食品等工業。紅曲菌發酵生產的糖化酶和淀粉酶可以作為糖化發酵劑,釀制成紅曲酒,紅曲酒在我國臺灣、福建、浙江等省享譽盛名[7],福建古田平湖鎮,生產紅曲有1000多年的悠久歷史,在國內外久負盛名。但作為釀造黃酒的古田紅曲,糖化酶活力低,很難適應現在的市場要求。
根據報道產糖化酶的曲霉以黑曲霉居多,紅曲霉相對較少,高產糖化酶的紅曲霉更為少見[8-11]。本文以古田平湖樣品中篩選、誘變得到的菌株出發,研究紅曲霉菌株產糖化酶的液態發酵工藝條件,通過優化發酵工藝提高糖化酶活力,優化后的發酵工藝參數可直接為工業化生產提供技術指導,從而降低生產成本,增加紅曲產品的市場競爭力。
1 材料與方法
1.1 材料與儀器
紫色紅曲霉G6(MonascuspurpureusG6) 由福建省海洋酶工程重點實驗室選育獲得;PDA培養基 配制方法參照文獻[12];種子培養基 不添加瓊脂的PDA培養基;液態發酵基礎培養基(MM培養基) 葡萄糖5%(w/v),蛋白胨1%(w/v),蒸餾水定容至1 L,pH自然,121 ℃滅菌20 min;液態發酵培養基(w/v,CM培養基) 大米粉8%,蛋白胨1%,KCl 0.1%,ZnSO40.01%,FeSO40.005%,MnSO40.015%,pH4.0,蒸餾水定容至1 L,121 ℃滅菌20 min;蛋白胨 購于Oxiod公司;葡萄糖、可溶性淀粉、KCl、ZnSO4、FeSO4等試劑 均來自國產分析純。
T6新世紀紫外可見分光光度計 北京普析通用儀器有限責任公司;SW-CJ-2F潔凈工作臺 蘇州安泰空氣技術有限公司;HWS24電熱恒溫水浴鍋 上海一恒科技有限公司;SHP-250生化培養箱 上海精宏實驗設備有限公司;YXQ-LS-50S11立式蒸汽滅菌器 上海博訊實業有限公司醫療設備廠;ZWYR-2102C恒溫振蕩培養箱 上海智城分析儀器制造有限公司);CF16RXII高速冷凍離心機 日本HITACHI公司。
1.2 實驗方法
1.2.1 紫色紅曲霉糖化酶的液態發酵 將紅曲菌接種于PDA平板上,在30 ℃條件下培養3~5 d。待紅曲菌長好后,用打孔器在紅曲菌平板上打出6 mm菌餅,將菌餅接種到液體種子培養基中,于恒溫振蕩培養箱中150 r/min、30 ℃培養2 d,之后以4%(v/v)的接種量接到發酵培養基中,裝液量20%(50 mL/250 mL),于恒溫振蕩培養箱中180 r/min、30 ℃培養數天,測定發酵液的糖化酶活力。
1.2.2 糖化酶活力測定 粗酶液制備:將錐形瓶中發酵液于8000 r/min離心10 min,然后取上清液,作為粗酶液。采用DNS比色法測定糖化酶活力[13]。1 mL酶液在40 ℃、pH4.6的條件下,1 h水解可溶性淀粉產生1 mg葡萄糖,定義為1個酶活力單位(U/mL)。相對酶活力:定義某個條件下,其相對酶活力為100%,其他條件下酶活力占該條件下酶活力的百分率為相對酶活力。
1.2.3 接種菌齡的確定 將培養不同時間(1~6 d)的種子液接種于液態基礎培養基(MM培養基),裝液量20%(50 mL/250 mL),接種量4%(v/v),轉速180 r/min,溫度32 ℃,于恒溫振蕩培養箱中培養8 d,之后取一定的發酵液測定糖化酶活力,研究不同接種齡對液態發酵產糖化酶相對酶活力的影響。
1.2.4 培養基確定
1.2.4.1 優化前液態發酵培養條件 葡萄糖5%(w/v),蛋白胨1%(w/v),蒸餾水定容至1 L,pH自然,121 ℃滅菌20 min。種子液培養時間2 d,溫度32 ℃,轉速180 r/min,裝液量50 mL/250 mL,接種量8%,發酵培養8 d。
1.2.4.2 碳源確定 分別用葡萄糖、蔗糖、可溶性淀粉、甘油、大米粉、玉米粉、糊精、麩皮作為MM培養基的碳源,添加量均為5%(w/v);培養基初始pH為5.0,裝液量20%(50 mL/250 mL),接種量4%(v/v),轉速180 r/min,溫度32 ℃,考察不同碳源對發酵產糖化酶相對酶活力的影響;另外,在確定最佳碳源之后,考察不同添加量4%~16%(w/v)對產糖化酶相對酶活力的影響。
1.2.4.3 氮源確定 在確定最佳碳源的基礎上,分別以谷氨酸鈉、尿素、蛋白胨、黃豆餅粉、硫酸銨、酵母膏、大米粉、大豆粉、玉米粉和硝酸鈉為MM培養基的氮源,其他培養條件同1.2.4.2,研究不同氮源對液體發酵產糖化酶相對酶活力的影響;另外,在確定最佳氮源后,考察不同添加量0.5%~5.0%(w/v)對產糖化酶相對酶活力的影響。
1.2.4.4 金屬離子優化 以最佳的碳源和氮源配制培養基,其他培養條件同1.2.4.2,分別考察添加量0、0.005%、0.010%、0.015%、0.020%、0.025%的金屬離子Mn2+、Fe2+、Zn2+,0、0.01%、0.15%、0.20%、0.30%的金屬離子Mg2+和K+對紫色紅曲霉G6產糖化酶能力的影響。進一步利用L9(34)正交表進行實驗設計確定這些金屬離子的最優配比,因素水平編碼如表1所示。
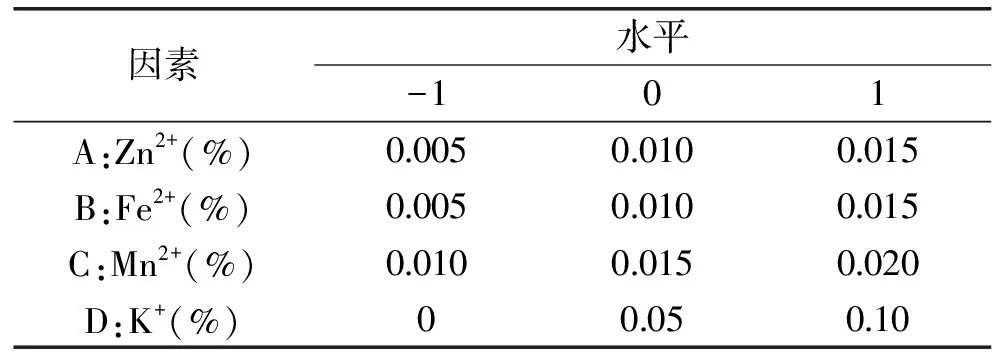
表1 正交實驗設計因素水平編碼Table 1 Factors and levels table of orthogonal experiment
1.2.4.5 培養基初始pH確定 在通過實驗研究,明確最佳培養基配方之后,調節液態發酵培養基的初始pH為2.5~6.0,考察不同初始pH對紫色紅曲霉G6產糖化酶相對酶活力的影響。
1.2.5 發酵條件研究 在優化后的液態發酵培養基(CM培養基)的基礎上,采用單因素實驗,固定裝液量50 mL/250 mL、搖床轉速180 r/min,溫度32 ℃,考察接種量(2%~16%)對紫色紅曲霉G6產糖化酶相對酶活力的影響。
固定接種量12%、搖床轉速180 r/min、溫度32 ℃,考察裝液量(30、50、70、90、110 mL/250 mL)對紫色紅曲霉G6產糖化酶相對酶活力的影響。
固定接種量12%、裝液量50 mL/250 mL、溫度32 ℃,考察搖床轉速(100、120、140、160、180、200、220 r/min)對紫色紅曲霉G6產糖化酶相對酶活力的影響。
固定接種量12%、裝液量50 mL/250 mL、搖床轉速150 r/min,考察溫度(28、30、32、35、37 ℃)對紫色紅曲霉G6產糖化酶相對酶活力的影響。
1.2.6 紫色紅曲霉G6產酶曲線的測定 采用優化后的培養條件進行發酵培養,發酵2~11 d,每隔1 d取一定量的發酵液測一次糖化酶的酶活力。
1.3 數據處理
實驗中每個處理重復3次,采用SPSS 1.70軟件進行正交實驗設計,應用Microsoft Excel 2010軟件作圖。
2 結果與分析
2.1 接種菌齡對產糖化酶的影響
圖1表明培養2 d的種子液接種發酵的糖化酶活力最高(定義為100%),這時紅曲菌處于快速生長期,菌種的生命力及適應能力都很強,因此選擇種子培養時間為2 d。
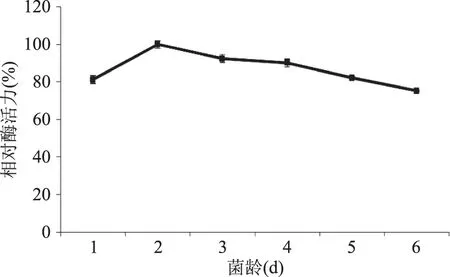
圖1 接種齡對液態發酵產糖化酶的影響Fig.1 Effect of seed age on glucoamylase production
2.2 培養基優化
2.2.1 不同碳源對液態發酵產糖化酶的影響 就曲霉而言,糖化酶是誘導酶,所以在微生物發酵過程中,作為碳源的物質除了作為微生物所需碳元素的主要來源外,又是誘導物的主要來源,所以不同的碳源對糖化酶的合成具有顯著的影響[14]。圖2結果表明,不同碳源對產糖化酶的影響差異較大,碳源為大米粉時糖化酶活力最高(定義為100%),其次是玉米粉,相對酶活為91.6%。可能是因為這類碳源中含有豐富的維生素、有機酸、氨基酸、糖類等,幾乎包含有微生物生長所需要的絕大部分營養要素,并且配比較為合適。所以,選擇大米粉為產糖化酶培養基中的最適碳源。
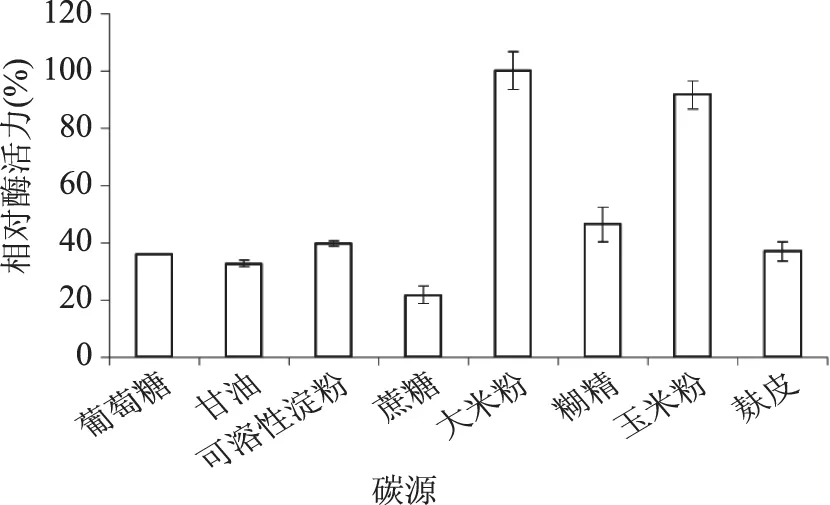
圖2 不同碳源對液態發酵產糖化酶的影響Fig.2 Effect of carbon sources on glucoamylase production
確定大米粉為最優碳源后,進一步考察不同添加量對產糖化酶的影響。由圖3可知,碳源添加量為12%時糖化酶活力最高(定義為100%),當添加量從2%增加到8%時,相對酶活從33.68%提高到97.94%;隨著添加量的增加,添加量8%以后,酶活力基本不變,所以,從成本方面考慮,確定大米粉的最適添加量為8%。
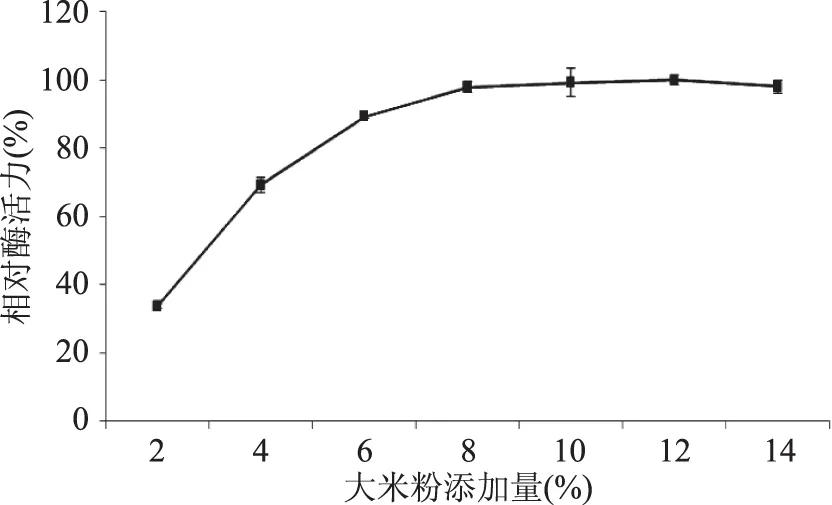
圖3 大米粉添加量對液態發酵產糖化酶的影響Fig.3 Effect of rice flour content on glucoamylase production
2.2.2 氮源對液態發酵產糖化酶的影響 在最適碳源為大米粉(添加量為8%)的基礎上,研究不同氮源對紫色紅曲霉G6產糖化酶的影響,結果如圖4所示。可以看出,選用的有機氮效果優于硫酸銨和硝酸鈉等無機氮。蛋白胨、黃豆餅粉、玉米漿干粉和大米蛋白作為氮源時的產酶量相近,其中蛋白胨糖化酶活力最高(定義為100%);豆粕由于油脂含量較高,影響了菌體對氮源的利用,使其生長受到抑制,因此糖化酶活力較低。觀察發酵液顏色,添加黃豆餅粉和玉米漿干粉的發酵液呈橙紅色,添加大米蛋白的發酵液呈暗黃色,色澤不佳,可能會影響到后續糖化酶的提取和應用。在釀造福建黃酒的過程中,紅曲霉發揮了提供色澤、風味和糖化等作用,所以對整體發酵液的色澤有一定的要求[15-16]。因此確定產酶培養基中的氮源為蛋白胨。
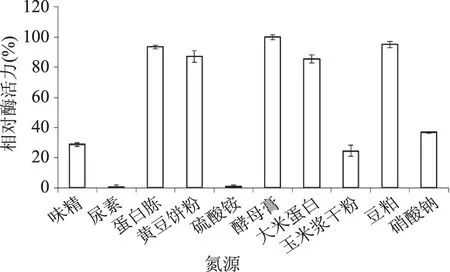
圖4 不同氮源對液態發酵產糖化酶的影響Fig.4 Effect of nitrogen sources on glucoamylase production
圖5實驗結果表明,添加量在1.0%~4.0%范圍內,產酶水平相近,添加量1.0%時糖化酶活力最高(定義為100%)。所以后續實驗以蛋白胨為氮源,添加量為1.0%。
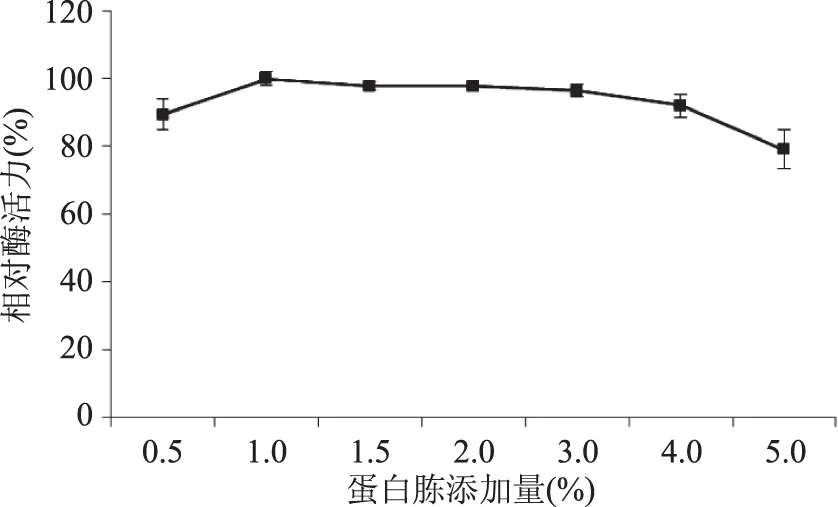
圖5 蛋白胨添加量對液態發酵產糖化酶的影響Fig.5 Effect of peptone content on glucoamylase production
2.2.3 金屬離子對液態發酵產糖化酶的影響
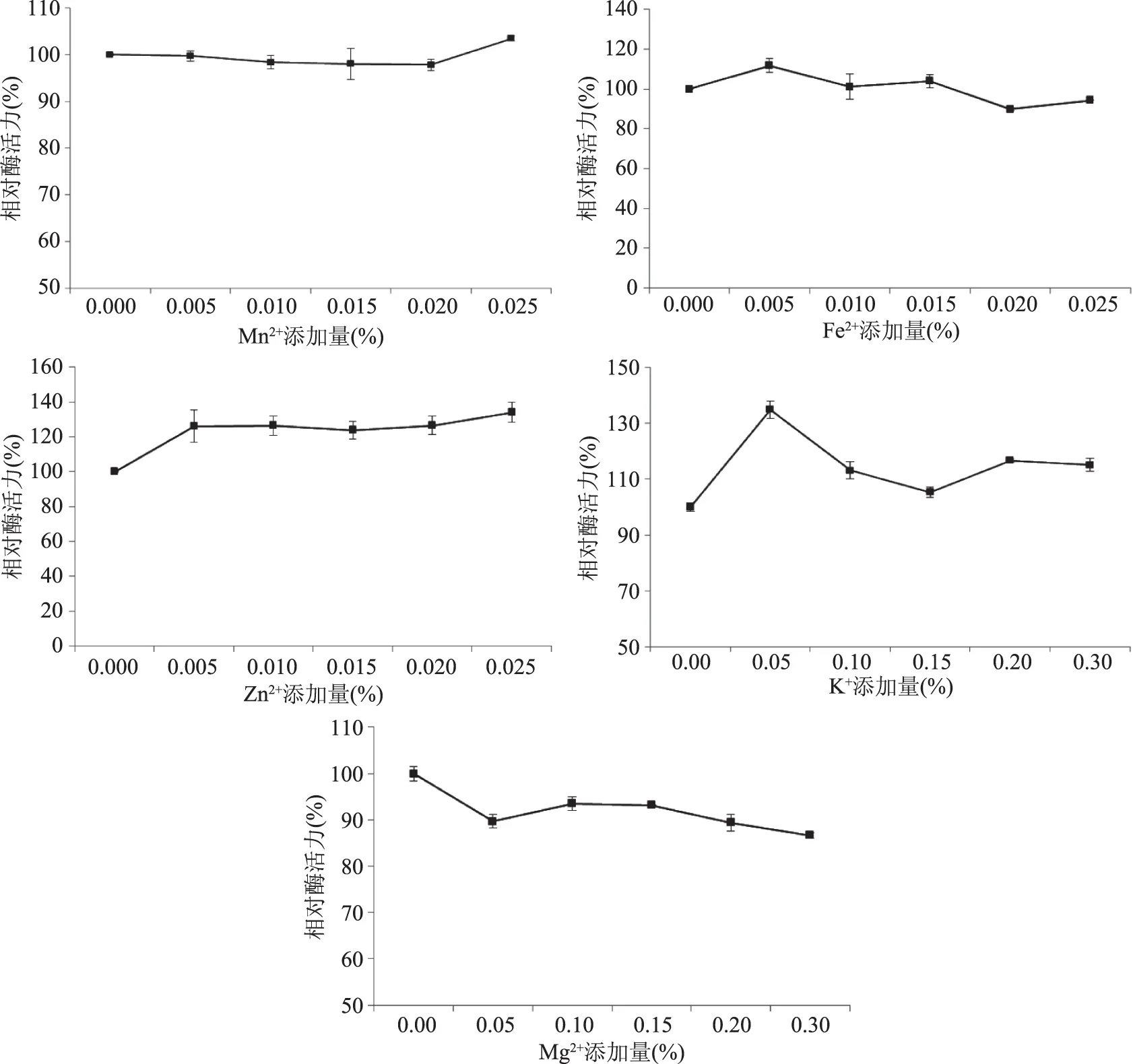
圖6 不同金屬離子對液態發酵產糖化酶的影響Fig.6 Effect of different metal ions on glucoamylase production
2.2.3.1 單因素實驗 不同金屬離子以及其不同添加濃度對產糖化酶的影響結果見圖6,無添加的對照組酶活力定義為100%。Mn2+在實驗濃度0%~0.025%范圍內對產糖化酶沒有多大影響,當添加量為0.025%時,酶活力略高,僅僅提高了2.4%;Fe2+添加量為0.005%時,相對于無添加時產酶提高了11.85%;Zn2+在添加量0%~0.025%范圍內均對產酶起到了促進作用,但隨著濃度的升高,促進作用提高不明顯,相對酶活維持在130%左右;Mg2+在添加量0%~0.3%范圍內對產酶有抑制作用,相對酶活為90%左右;當K+的添加量為0.05%時,對產酶的促進作用明顯,較無添加情況下提高了35.0%。
2.2.3.2 正交實驗 為了進一步研究金屬離子對產糖化酶的影響,選擇對酶活有一定促進作用的Zn2+、Fe2+、Mn2+和K+,通過正交實驗L9(34)優化這4種金屬離子的配比,正交實驗結果見表2。由極差R可知,影響糖化酶合成的金屬離子主次順序為A>B>D>C,最優組合為A2B1C2D3(實驗號4),即添加Zn2+0.010%、Mn2+0.015%、K+0.10%、Fe2+0.005%,紫色紅曲霉G6在該條件下發酵,糖化酶活力達到1471.95 U/mL,較優化前(109.54 U/mL)提高了13.44倍。
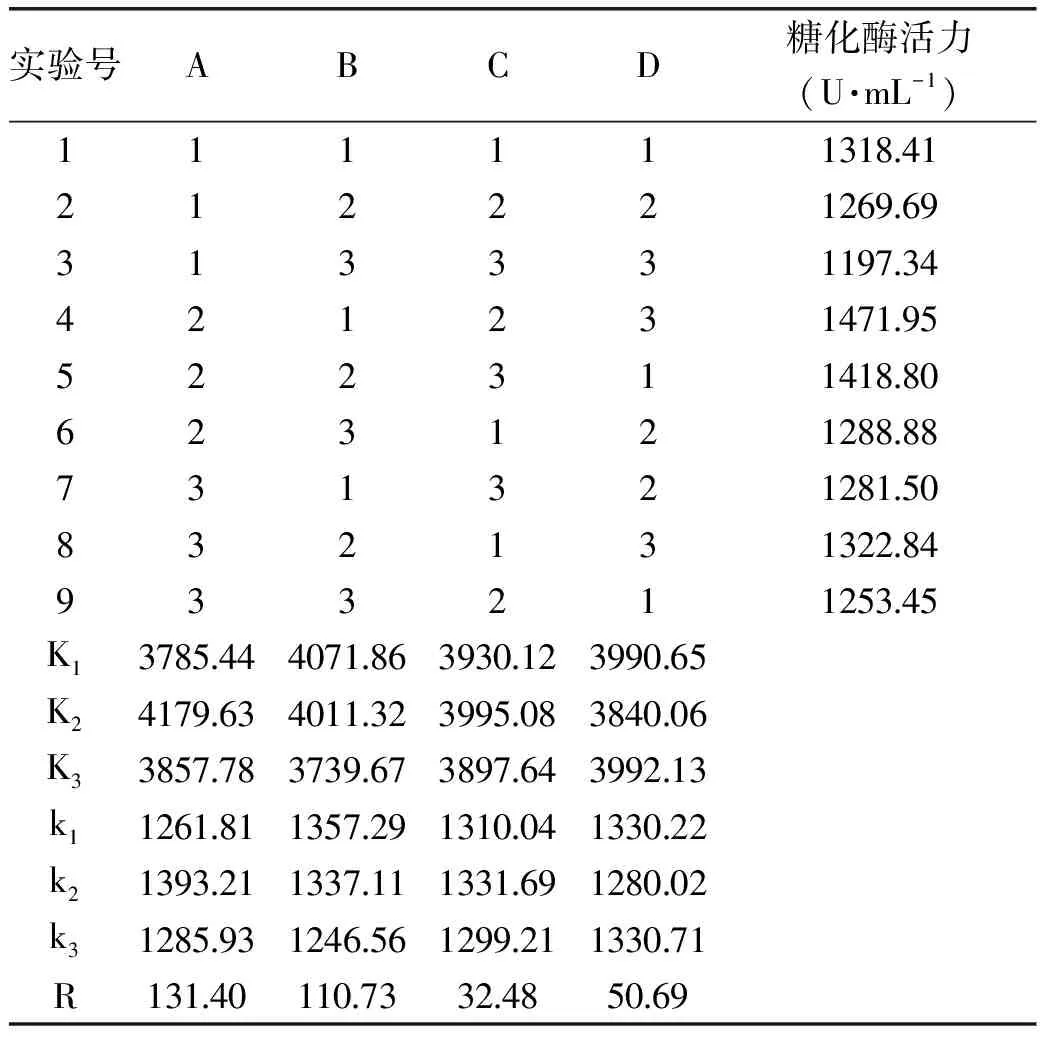
表2 金屬離子L9(34)正交實驗結果Table 2 Results of L9(34)orthogonal experiment(metal ions)
2.2.4 培養基不同初始pH對液態發酵產糖化酶的影響 由圖7可知,在pH3.5~5.0范圍內,發酵產酶活力均維持在較高水平,其pH的適應范圍較寬,以pH為4.0時的酶活力最高(定義為100%)。因此,確定培養基初始pH為4.0。
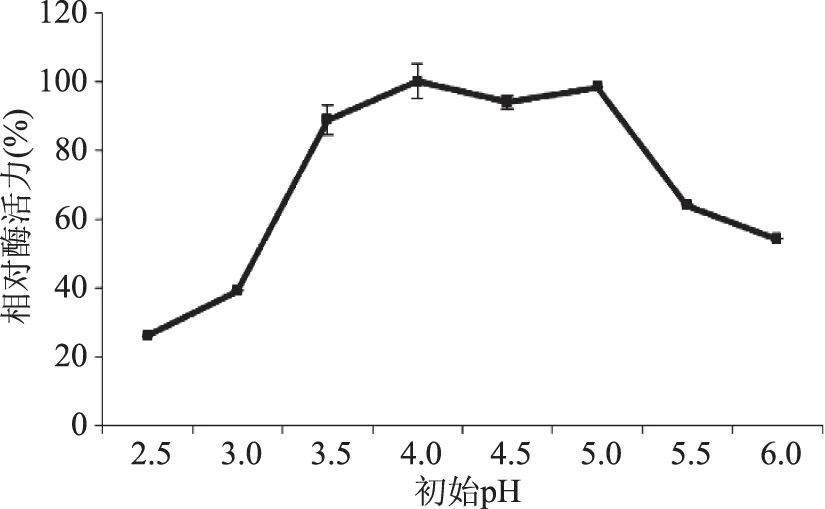
圖7 初始pH對液態發酵產糖化酶的影響Fig.7 Effect of initial pH on glucoamylase production
2.3 液態發酵產糖化酶條件優化
2.3.1 不同接種量對液態發酵產糖化酶的影響 由圖8可知,在2%~16%(v/v)接種量范圍內,糖化酶活力呈現先上升后下降的趨勢,當接種量為12%時,發酵產酶效果最好。過高的接種量使得菌體生長旺盛,快速消耗營養物質,對發酵產酶不利,所以確定接種量為12%。
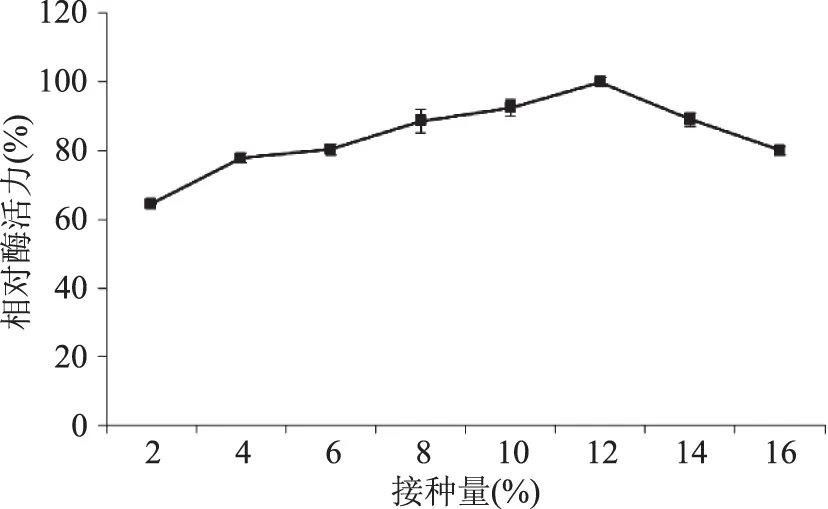
圖8 接種量對液態發酵產糖化酶的影響Fig.8 Effect of inoculation amount on glucoamylase production
2.3.2 不同裝液量對液態發酵產糖化酶的影響 搖瓶裝液量與轉速是影響通氣量的兩個主要因素。裝液量對產糖化酶的影響結果見圖9,裝液量為30 mL時,糖化酶相對酶活力最高;當裝液量為50 mL時,酶活力是裝液量30 mL時的91.32%,其余的裝液量,酶活力都較低,考慮到投入產出比,選擇搖瓶裝液量為50 mL。

圖9 裝液量對液態發酵產糖化酶的影響Fig.9 Effect of medium volume on glucoamylase production
2.3.3 不同轉速對液態發酵產糖化酶的影響 在前面的基礎上,搖床轉速控制在100~220 r/min范圍內,糖化酶活力先升后降,在150 r/min時,糖化酶相對酶活力達到最高(圖10),因此選擇搖床轉速為150 r/min。
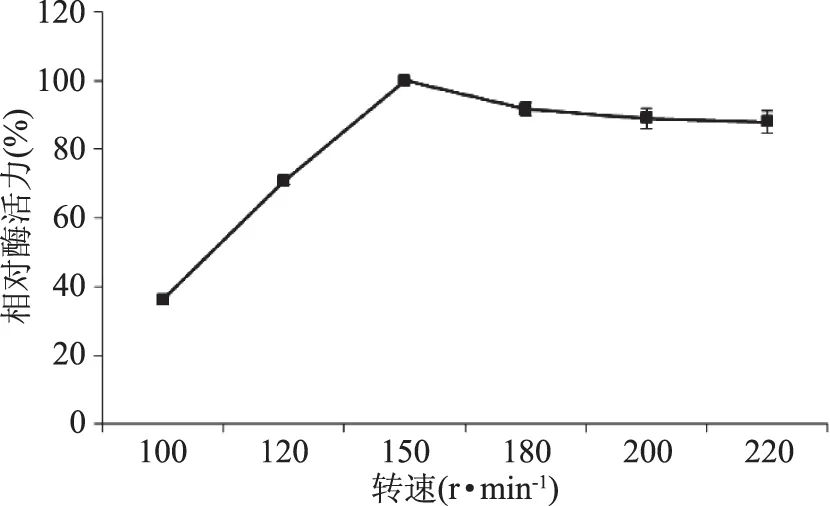
圖10 轉速對液態發酵產糖化酶的影響Fig.10 Effect of rotation speed on glucoamylase production
2.3.4 不同溫度對液態發酵產糖化酶的影響 適宜的溫度對于發酵產酶的影響較大,不同溫度條件下發酵產糖化酶情況如圖11所示,在溫度為32 ℃時糖化酶活力最高(定義為100%),在發酵溫度28 ℃下,相對酶活為71.30%;而在37 ℃下,酶活力迅速下降,相對酶活僅為41.09%,說明高溫不利于紅曲菌株產糖化酶。因此,確定液態發酵產糖化酶最適溫度為32 ℃。
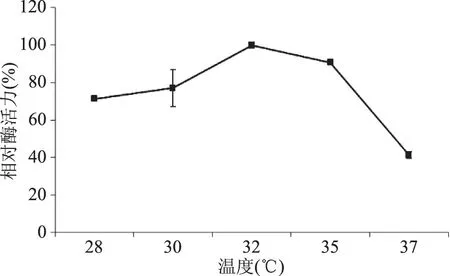
圖11 發酵溫度對液態發酵產糖化酶的影響Fig.11 Effect of fermentation temperature on glucoamylase production
2.4 紫色紅曲霉G6產酶曲線的測定
將紫色紅曲霉G6按照優化后的液態產酶工藝進行發酵,并繪制產酶曲線,如圖12所示,隨著發酵時間的延長,糖化酶活力不斷升高,在第6 d之后,上升變得相對平緩,直到第10 d達到最高(糖化酶活力為1652.36 U/mL)。與優化前(糖化酶活力為109.54 U/mL)相比,產酶能力提高了14.08倍。
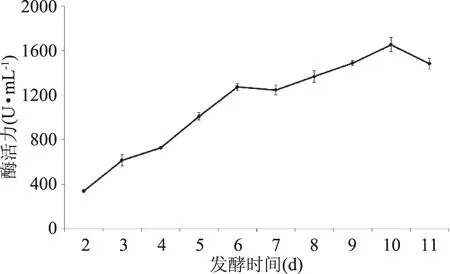
圖12 發酵時間對液態發酵產糖化酶的影響Fig.12 Effect of fermentation time on glucoamylase production
3 結論
通過對紫色紅曲霉G6液態發酵生產糖化酶的接種菌齡、培養基配方和發酵條件的研究,確定其最佳接種菌齡為2 d;最適發酵培養基成分為大米粉8%,蛋白胨1%,KCl 0.1%,ZnSO40.01%,FeSO40.005%,MnSO40.015%,pH4.0;最適發酵條件為裝液量50 mL/250 mL,轉速150 r/min,溫度32 ℃,接種量12%(v/v)。在該條件下發酵至第10 d糖化酶活力可達1652.36 U/mL,比優化前提高了14.08倍。
[1]李浩然,馮雅麗,伍軍. 降脂紅曲研究進展[J]. 北京農學院學報,2001,16(3):80-85.
[2]Panda B P,Javed S,Ali M. Optimization of Fermentation Parameters for Higher Lovastatin Production in Red Mold Rice through Co-culture ofMonascuspurpureus,andMonascusruber[J]. Food and Bioprocess Technology,2010,3(3):373-378.
[3]肖連冬,王志強. 降膽固醇紅曲霉菌株的分離及其降解性能研究[J]. 中國釀造,2015,34(5):74-77.
[4]Pattanagul P,Pinthong R,Phianmongkhol A,et al.Mevinolin citrinin and pigments of adlay angkak fer-mented byMonascussp.[J]. International Journal of Food Microbiology,2008,126(1):20-23.
[5]李麗,張文學,羅芳,等. 紅曲藥曲的制備工藝及藥曲清酒的研究[J]. 食品工業科技,2014,35(18):194-198.
[6]趙吉興,李耀,李凱. 紅曲霉固體發酵生產釀造增香發酵劑的研究與應用[J]. 中國釀造,2013,32(3):114-117
[7]王雅芬,傅月華.紅曲霉的有效生理活性物質及應用[J].杭州科技,2000(5):25-27.
[8]楊麗娟,余少文,YANGLi-juan,等. 黑曲霉高產糖化酶的分子水平研究方法概論[J]. 食品研究與開發,2016,37(8):204-208.
[9]龍茜萍,王曉丹,譚靜,等. 一株高產糖化酶菌株的篩選與鑒定[J]. 釀酒科技,2013(8):7-9.
[10]武金霞,王沛,李曉明. 糖化酶的研究進展及趨勢[J]. 自然雜志,2003,25(3):161-163.
[11]王秋辰,王昌祿,陳勉華,等. 紅曲霉固態發酵產糖化酶及酸性蛋白酶條件的優化[J]. 天津科技大學學報,2014(4):21-25.
[12]徐美愛,林娟,李亮,等. 高產紅色素及糖化酶紅曲菌株的誘變選育[J]. 中國食品學報,2015,15(12):74-82.
[13]劉洋,唐芳榮,相宏宇,等.小體系高通量比色測定糖化酶活力新方法[J].中國釀造,2012(7):140-143.
[14]夏娟. 高產糖化酶菌株的誘變育種及其發酵工藝的優化[D]. 杭州:浙江工業大學,2013.
[15]倪莉,吳智廣,張雯. 福建紅曲中的紅曲霉的生理生化特性研究[J]. 福州大學學報,2009(6):929-934.
[16]韓興林,王建耀,王廣峰,等. 清香型大曲糖化力的簡單分析[J]. 釀酒科技,2009(9):68-70.
Study on the liquid fermentation conditions of glucoamylase byMonascuspurpureus
CHEN Jing-zhi,LIN Juan*,YE Xiu-yun,XU Mei-ai,LI Wen-juan,DENG Xiang-zhen
(Fujian Key Laboratory of Marine Enzyme Engineering,Fuzhou University,Fuzhou 350116,China)
The production conditions of glucoamylase through liquid-state fermentation byMonascuspurpureusG6 were optimized. Based on results of single factor tests,the optimal conditions for glucoamylase production were 8% rice powder,1% peptone,0.1% KCl,0.01% ZnSO4,0.005% FeSO4,0.015% MnSO4,50 mL/250 mL loading medium volume(v/v),12% inoculation amount(v/v)and rotation speed of shaking incubator was 150 r/min,initial pH value of culture medium was 4.0,fermentation temperature was 32 ℃. The fermentation was carried out under these conditions for 10 days to obtain the maximum glucoamylase activity of 1652.36 U/mL,which was 14.08 times higher than that without optimization of fermentation condition.
Monascuspurpureus;glucoamylase;culture medium;fermentation conditions
2016-12-20
陳景智(1991-),男,在讀碩士研究生,研究方向:應用微生物學,E-mail:1548426184@qq.com。
*通訊作者:林娟(1970-),女,博士,教授,研究方向:應用微生物學、分子酶學,E-mail:ljuan@fzu.edu.cn。
國家863計劃課題(2013AA102101);福建省高校產學合作項目(2017N5008)。
TS201.3
A
1002-0306(2017)14-0146-06
10.13386/j.issn1002-0306.2017.14.029

