兩種不同方法制備南極磷蝦富脂蛋白的對比研究
尹利昂,薛長湖,田利利,姜曉明,尹利端,李兆杰,薛 勇,*(.中國海洋大學食品科學與工程學院,山東青島 66003; .煙臺新時代健康產業有限公司,山東煙臺 64006)
?
兩種不同方法制備南極磷蝦富脂蛋白的對比研究
尹利昂1,薛長湖1,田利利1,姜曉明1,尹利端2,李兆杰1,薛 勇1,*
(1.中國海洋大學食品科學與工程學院,山東青島 266003; 2.煙臺新時代健康產業有限公司,山東煙臺 264006)
以冷凍南極磷蝦為原料,通過優化自溶條件,采用控制自溶的方式,制備一種富含ω-3的復合物,并就其基本組成、蛋白質變化與分布、營養評價等,與等電點促溶/促沉法制備的富脂蛋白進行對比研究。優化的自溶條件為55 ℃和pH7.5條件下自溶3 h。實驗結果表明,兩種蛋白均為富含ω-3多不飽和脂肪酸的蛋白-脂質復合物,含有全部的人體必需氨基酸,超過FAO/WHO/UNU對食品蛋白質中必需氨基酸的要求,而自溶法制備的富脂蛋白在總脂、磷脂、ω-3多不飽和脂肪酸含量,以及必需氨基酸總量上均優于后者,平均值分別達到了43.88%干基、48.84%總脂、31.52%脂質和517.4 mg/g蛋白。由此可見,控制自溶是一種高效的制備富脂蛋白的方式,有助于磷蝦富脂蛋白作為功能性海洋食品的開發。
南極磷蝦,富脂蛋白,自溶,ω-3多不飽和脂肪酸
南極磷蝦是一種生活在南極海域的浮游生物,在南極食物鏈系統中擔任重要角色[1]。作為地球上生物蘊藏量最大的物種,南極磷蝦資源的開發利用引起全世界越來越多的關注。南極磷蝦,一般指南極大磷蝦(Euphausiasuperba),除了蝦油產品外,其作為人類日常食物的來源尚受到一定的成本和技術上的限制,但它有著均衡的營養組成,整蝦含有77.9%~83.1%的水分、0.4%~3.6%的脂質、11.9%~15.4%的蛋白質,以及約2%的甲殼質和碳水化合物[2]。南極磷蝦蛋白的營養高于一般畜禽肉蛋白和牛乳蛋白,含有全部的人體必需氨基酸,必需氨基酸的總量達到212.1 mg/g 蛋白質[3]。南極磷蝦脂質含有比例可觀的多不飽和脂肪酸,其中,DHA和EPA含量分別為16.6%~36.5%和11.1%~24.8%脂質[4],且多以磷脂型存在[5]。
南極磷蝦加工的限制性因素較多:含有較高比例的可溶性蛋白成分;其蛋白質在本體死亡和冷凍后極易發生變性;南極磷蝦肌肉中含有4.5~570 mg/kg的氟[6];南極磷蝦體內,尤其是頭胸部的消化系統,含有豐富的和較強活性的自溶酶系,主要是蛋白酶類和酯酶類。南極磷蝦的這些特征增加了傳統途徑的加工成本,使磷蝦資源的大宗利用受到限制,而尚未規模化的作為人類食物的來源。
有學者研究發現,等電點促溶/促沉法制備低氟南極磷蝦基料時,所形成的蛋白復合物,在一定程度發生了脂質的富集,可以認為是一種富脂蛋白[7]。本實驗意在利用南極磷蝦自溶酶的生化特點,嘗試制備一種新的富脂蛋白,以推動磷蝦加工的研究和相關產品的進一步開發。迄今,相關學者對磷蝦自溶酶的生化性質進行了較為深入的研究[8-12],但利用自溶酶作用制備南極磷蝦制品的開發尚未見文獻報道。本研究利用冷凍南極磷蝦為原料,經脫氟、優化條件和控制自溶,制備了一種富含ω-3多不飽和脂肪酸(polyunsaturatedfattyacids,PUFAs)的蛋白-脂質復合物,通過與原料蝦肉、等電點促溶/促沉法制備的富脂蛋白相比較,以期證明其是一種營養價值高、安全性好的富脂蛋白。
1 材料與方法
1.1 材料與儀器
南極磷蝦(E.superba) 2015年3月捕撈于南極FAO 48.1海域,中國水產有限公司;三羥甲基氨基甲烷(Tris) 北京索萊寶科技有限公司;對硝基苯酚(p-NP)、對硝基苯酚丁酸酯(p-NPB)、苯甲酰-L-精氨酰-對硝基苯胺(BApNA) 美國Sigma-Aldrich公司;石油醚、乙醚、乙酸、氯仿、甲醇、油酸、乙醇、十二烷基硫酸鈉(SDS) 國藥集團化學試劑有限公司;福林-酚乙液 上海君瑞生物技術有限公司;其他試劑等均為分析純。
JB-1A型磁力攪拌器 上海精密科學儀器有限公司;JJ-1精密增力電動攪拌器、HH-4型數顯恒溫水浴鍋 常州國華電器有限公司;GL-20M型高速冷凍離心機 上海盧湘儀離心機儀器廠;016-240改進型魚肉分離機 中國水產科學研究院上海漁業機械研究所;PF-1氟選擇電極、232甘汞參比電極 上海雷磁精密儀器有限公司;自動電位滴定儀 濟南海能儀器股份有限公司;Biochrom 30+全自動氨基酸分析儀 英國Biochrom公司;6980N氣相色譜儀、5973質譜儀、石英毛細管柱HP-INNOWAX(30 m×0.32 mm×0.25 μm) 美國安捷倫公司;BRUKER AV500核磁共振波譜儀 德國布魯克公司。
1.2 實驗方法
1.2.1 去殼南極磷蝦蝦肉的制備 脫氟:將冷凍南極磷蝦在4 ℃的2 mol/L磷酸溶液中解凍6 h,以降低蝦殼中的氟,防止其向蝦肉中遷移。
采肉:瀝干磷蝦表面水分,以魚肉分離機采取蝦肉,得到去殼南極磷蝦肉。
1.2.2 自溶法制備富脂南極磷蝦蛋白
1.2.2.1 南極磷蝦粗酶液的制備 收集冷凍南極磷蝦蝦頭,加入2倍質量的Tris-HCl緩沖液(0.05 mol/L,pH7.5,4 ℃),高速勻漿后,勻漿液4 ℃、10000 r/min離心30 min,收集上清液,得南極磷蝦粗酶液[13]。粗酶液于-80 ℃冰箱凍存。
1.2.2.2 內源酶最適溫度的測定 取pH7.5的粗酶液,參考Erlanger等的方法[14],以苯甲酰-L精氨酰-對硝基苯胺(BApNA)為底物,以吸光值最高的pH所對應的酶活力為100%,進行粗酶液中蛋白酶在不同溫度條件(5~65 ℃)下相對活力的測定;采用對硝基苯酚(p-NP)法[15],以對硝基苯酚丁酸酯(p-NPB)為底物,以吸光值最高的pH所對應的酶活力為100%,進行粗酶液中脂肪酶在不同溫度條件(5~65 ℃)下相對酶活力的測定。
1.2.2.3 內源酶最適pH的測定 以55 ℃為反應溫度,BApNA為底物,以吸光值最高的pH所對應的酶活力為100%,進行粗酶液中蛋白酶在不同pH(pH3~11)下相對活力的測定;以p-NPB為底物,以吸光值最高的pH所對應的酶活力為100%,進行粗酶液中脂肪酶在不同pH(pH3~11)下相對酶活力的測定。
1.2.2.4 自溶過程及自溶時間選擇 準確稱取8~10 g的去殼南極磷蝦肉,加入3倍體積的Tris-HCl緩沖液(0.05 mol/L,pH7.5,4 ℃),于冰浴條件下高速勻漿。保持pH穩定,加入南極磷蝦肉質量1/20的上述南極磷蝦粗酶液,分別于55 ℃水浴、溫和攪拌條件下自溶1、2、3、4 h,快速升溫滅酶(90 ℃保持5 min),并于冷卻后離心(5000 r/min,10 min),收集沉淀部分即自溶法制備的富脂蛋白。
以Folch方法[16]提取其中的脂質,以薄層色譜法(TLC)分析不同的自溶時間節點時,游離脂肪酸(FFA)、溶血卵磷脂(LPC)等脂質品質劣化代表產物含量的變化趨勢。以油酸(C18∶1)為參照,中性展開劑為石油醚∶乙醚∶乙酸=85∶15∶1(v/v/v),極性展開劑為氯仿∶甲醇∶水=65∶25∶4(v/v/v)。
1.2.3 等電點促溶/促沉法制備富脂南極磷蝦蛋白 準確稱取8~10 g的去殼南極磷蝦肉,加入3倍體積的4 ℃的蒸餾水,高速勻漿。以10 mol/L和4 mol/L NaOH調節勻漿液pH至11.5,在冰浴條件下攪拌30 min以溶解南極磷蝦蛋白,5000 r/min離心10 min,收集沉淀部分,重復一次以上的蛋白溶解操作。將先后兩次離心的上清混合,以10 mol/L和4 mol/L HCl調節混合液pH至4.5,冰浴靜置30 min,5000 r/min離心10 min,收集沉淀部分,得等電點促溶/促沉法制備的富脂蛋白[7]。
1.2.4 基本成分分析 水分含量:采用直接干燥法測定,參照GB/T 5009.3-2010。總脂含量:參照Folch[16]的方法,采用氯仿/甲醇(2/1,v/v)提取磷蝦油,以蝦油質量除以樣品質量,即得總脂含量;該磷蝦油用于脂肪酸組成分析和磷脂、游離脂肪酸含量測定。蛋白質含量:采用凱氏定氮法測定,參照國標GB/T 5009.5-2010。灰分含量:參照國標GB/T 5009.4-2010測定。總氟含量:精確稱量2 g樣品,采用堿熔固定-高溫灰化-氟離子選擇電極法測定[17],以0.1 mol/L高氯酸為氟的提取試劑。
1.2.5 蛋白質的雙向二維電泳分析 提取和純化兩種富脂蛋白,采用雙向二維電泳(2-DE)分析幾種蛋白的分布特征[18]。
1.2.5.1 電泳樣品的制備 在研缽中倒入液氮預冷,然后將樣品置于研缽中,再次迅速加入液氮,待液氮揮發完之后再倒一次液氮,至研缽中液氮停止沸騰后迅速研磨,直至組織變成粉末,均勻而沒有明顯顆粒。在研缽中加入800 μL RB(使用前加入1×PMSF),充分溶解粉末后轉移至1.5 mL EP管中。
將EP管中樣品以超聲破碎儀進行超聲破碎,頻次為8次/輪,共超聲8~9輪。每完成一輪的超聲破碎,將樣品立即冰浴1 min,然后進行離心(4 ℃,12000 r/min,20 min),收集上清液。將上清液分裝成3管,每管約250 μL,每管再加入4倍樣本體積丙酮-20 ℃沉淀過夜。沉淀完的蛋白質進行離心(4 ℃,12000 r/min,20 min),倒去上清液后,平放于干凈的紙巾上自然干燥,即可得到處理后的蛋白質團塊,-80 ℃保存備用。
1.2.5.2 二維電泳條件 一向等電聚焦電泳(IEF):pH3~10;二向垂直電泳(SDS-PAGE):15~170 kDa;染色:銀染。以ImageMaster 2D platinum 5.0進行圖像分析。
1.2.6 氨基酸組成分析 參照GB/T5009.124-2003。
1.2.7 脂肪酸組成分析 蝦油脂肪酸甲酯化條件:取磷蝦油10 mg,加入1 mL 10%濃硫酸-甲醇溶液(或濃鹽酸∶甲醇=1∶5),于90 ℃水浴甲酯化30 min,冷卻后加入正己烷1 mL振蕩,靜置分層,取上清液供GC/MS分析[19]。
色譜條件:HP-INNOWax石英毛細管柱(30 m×0.32 mm×0.25 μm),高純氦氣為載氣,采用恒壓模式,壓力為54 kPa,分流比為25∶1。進樣口溫度為230 ℃,檢測器溫度為250 ℃,柱溫以3 ℃/min由140 ℃升到210 ℃,然后在210 ℃下保持10 min,整個分析過程為33 min。
質譜條件:GC/MS接口溫度280 ℃,EI離子源,電離能量70 eV,離子源溫度230 ℃,掃描周期2.84次/s,質量掃描范圍m/z 50~500 u。
1.2.8 磷脂和游離脂肪酸含量測定 磷脂含量測定[20]:核磁共振法(31PNMR)。以三氯甲烷∶氘代甲醇(2∶1)溶劑為溶劑,磷酸三苯酯(TPP)為內標物進行核磁共振分析。
游離脂肪酸含量測定:采用自動電位滴定法[21],以石油醚∶乙醇(2∶1)為混合溶劑,0.1 mol/L NaOH溶液為滴定試劑。
1.3 數據處理
各數據均平行測定三次。運用分析軟件SPSS 18.0進行統計分析,采用one-way ANOVA算法進行方差分析。多重比較分析采用Tukey’s test算法判斷顯著性差異(p<0.05)。表2~表3同。
2 結果與分析
2.1 自溶條件的優化
2.1.1 自溶溫度和pH的選擇 南極磷蝦自溶酶系主要由蛋白酶和脂肪酶構成,為探索最佳的自溶效果,本實驗驗證了在不同溫度和pH條件下兩種酶類的相對活性。如圖1所示,南極磷蝦蛋白酶系的最高相對活性對應的溫度為55 ℃、pH為7.5,體現了其類胰蛋白酶的屬性。這與以往研究者報道的結果一致,Kubota等[22]認為對自溶起主要作用的是消化道內的蛋白酶,這些酶最適pH為6~8;Osnes等[9]也認為磷蝦自溶酶中起著決定作用是類胰蛋白酶,整體自溶酶活性在中性至弱堿性條件下最強;Kimoto等[10]研究顯示南極大磷蝦的類胰蛋白酶對其自溶起主要的作用;Konagaya[23]通過分離鑒定南極磷蝦體內的蛋白酶,也認為其主要的蛋白酶為類胰蛋白酶。
就脂肪酶類而言,由圖1可以看出,南極磷蝦脂肪酶系為低溫酶,其較適宜的溫度為5~40 ℃,最高相對活性對應的溫度為35 ℃、pH為7.5。Turkiewicz等[24]的研究表明,磷蝦酯酶在pH4.6和37 ℃下具有最大活性,55 ℃下5 min熱處理可以使其完全失活。尚憲明[12]進行了反應溫度和反應pH對酶促反應速率影響的實驗,結論認為,南極磷蝦脂肪酶最佳反應pH為8.0左右,其對較高溫度的穩定性差,在35 ℃具有最佳反應速率,具有低溫脂肪酶的催化特性,并分析這可能與其生活環境相關。
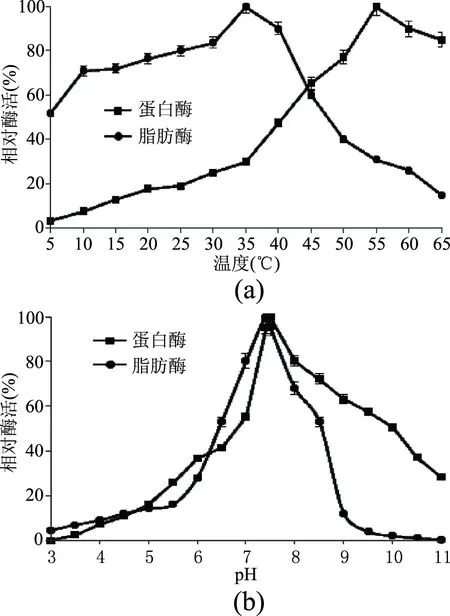
圖1 冷凍南極磷蝦自溶酶的相對活性Fig.1 Relative activity of autoenzyme from frozen Antarctic krill注:(a)和(b)分別表示自溶酶在不同溫度和pH條件下相對活性的變化。
脂肪酶類在自溶過程中,容易導致脂質的酶促降解,引起游離脂肪酸(FFA)和溶血卵磷脂(LPC)水平的上升,使自溶產物的脂質發生品質的劣化,因此有必要采取合適的自溶條件,在促進蛋白酶類作用的同時,抑制脂肪酶類的活性。鑒于蛋白酶在55 ℃和pH7.5分別顯現最高的相對活性,而在55 ℃反應溫度下,脂肪酶類的相對活性只有最高時的20%~30%,本實驗采用的自溶溫度和pH分別為55 ℃和7.5。
2.1.2 自溶時間的選擇 一般來說,隨著自溶時間的延長,脂肪酶作用對自溶產物的不利影響會逐漸增大,如圖2所示,在不同時間(1、2、3、4 h)的平行自溶產物中,隨著自溶時間的延長,作為脂質劣化標志性產物的FFA、LPC呈現增加的趨勢,在1~3 h的自溶中,二者含量的增加比較緩慢,而自溶4 h時則呈現急劇增加的特點。為避免脂質劣化給自溶產物帶來不利影響,優化的自溶時間以3 h為宜。因此,結合自溶效果,本實驗選擇自溶時間為3 h的反應產物為富脂蛋白。

表1 南極磷蝦肉和兩種富脂蛋白的基本成分Table 1 Basic composition of AKM,OEP-A and OEP-ISP
注:AKM,南極磷蝦肉;OEP-A,自溶3 h制備的富脂蛋白;OEP-ISP,等電點促溶/促沉法制備的富脂蛋白。表2~表3同
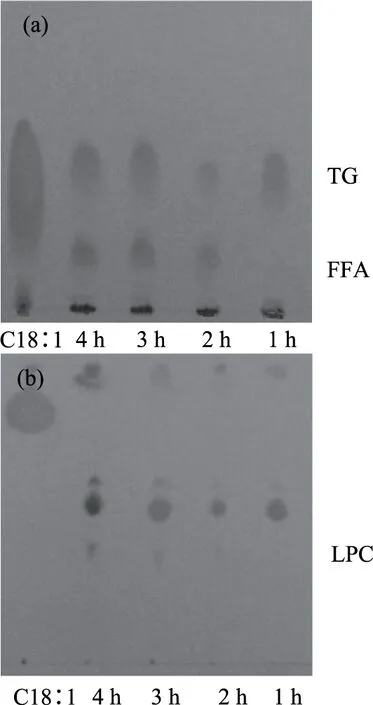
圖2 不同自溶時間所對應脂質的薄層色譜分析Fig.2 TLC analysis oflipid from OEP with different autolysis time注:(a)中性展開;(b)極性展開;TG-甘油三酯。
2.2 基本成分分析
所制備OEP-A的干物質得率平均為40.53%,OEP-ISP的干物質得率平均為41.16%。去殼南極磷蝦肉及兩種富脂蛋白的基本組成見表1。原料中蛋白質含量(68.05%±0.45%干基)遠高于總脂含量(19.72%±0.32%干基)。自溶過程中,蛋白酶能夠有效的降解蛋白質,而在溶解/等電沉淀法中,在等電點pH4.5處,半數以上的蛋白能夠析出而形成沉淀[25],這也是自溶方法的干物質得率略低于后者的原因。
由表1可知,OEP-ISP中的蛋白、總脂的比例接近2∶1,這與王靈昭等[25]使用等電點溶解-沉淀法(ISP方法)所制備的低氟南極磷蝦基料中蛋白、總脂的比例相接近。OEP-A中的蛋白、總脂的比例略高于1∶1,就總脂含量而言,自溶方式比等電點促溶/促沉方式對脂質的富集能力更強,這可能是由于在酶解過程中,蛋白酶作用較強而脂肪酶作用較弱,有相當比例的非水溶性蛋白質經酶解后,以多肽、氨基酸的形式進入到上清液中。兩種富脂蛋白中的平均干基氟含量分別為35.27 mg/kg和24.81 mg/kg,符合美國FDA對食品中氟含量100 mg/kg的限定標準要求,ISP法對氟的脫除效果較自溶方式稍好。這可能是由于ISP過程中,除了經歷水洗作用,蛋白質的完全溶解使氟釋放的比較充分,相關研究結果證實酸處理更能加速氟的脫除[6,26-28]。表1數據對比說明,自溶是有效的富集脂質的方式。同時,自溶過程所產生的上清液,含有蛋白質、多肽、氨基酸及部分脂質,經有效的脫氟后,可以作為后續開發風味類產品的原料。
2.3 蛋白質的分布情況
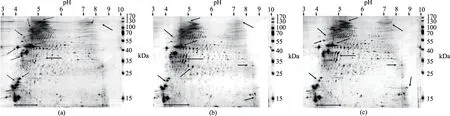
圖3 南極磷蝦蛋白與兩種富脂蛋白的雙向二維電泳圖譜Fig.3 2-DE spectrum of protein from AKM,OEP-A and OEP-ISP注:(a)、(b)、(c)分別為AKM、OEP-A和OEP-ISP蛋白的雙向二維電泳圖。
由于制備原理的不同,OEP-A及OEP-ISP的蛋白分布情況有所差異,如圖3所示。由圖3可以看出,南極磷蝦蛋白的2-DE圖譜上的斑點集中在pH4~5,尤其以pH4.5處最為集中,說明南極磷蝦蛋白的等電點在pH4.5附近,這與已報道的南極磷蝦蛋白等電點pH4.6相近[25],同時說明實驗中制備OEP-ISP所采用的等電點是正確的。南極磷蝦蛋白的分子量集中在35~55 kDa和70~100 kDa。由圖3(a)~圖3(c)對比可以看出,南極磷蝦肉蛋白(圖3(a))在170 kDa處有少量斑點(spots),該斑點通常被認為是魚類、對蝦和磷蝦肌原纖維蛋白中的肌球蛋白重鏈(myosin heavy chain,MHC)的所在[29-30]。MHC斑點或條帶的弱化,是其所在的蛋白質凝膠性和ATPase活性減弱的表征。這說明,南極磷蝦在經歷了死亡和長期凍藏后,其蛋白質可能發生了較嚴重的降解和變性。在圖3(b)及圖3(c)中,MHC的斑點幾乎完全消失,并且代表肌動蛋白的40~55 kDa的斑點也明顯的減少和弱化,這可能是肌原纖維蛋白受溫度、酸堿作用的影響,發生了進一步的降解[31-32]。據文獻報道,在自溶過程中,肌球蛋白與肌動蛋白是蛋白酶作用的主要對象[33]。與此同時,低于35 kDa的小分子量蛋白斑點增加,圖3(c)的增加尤其明顯,說明酸堿對南極磷蝦蛋白質的降解作用較強。
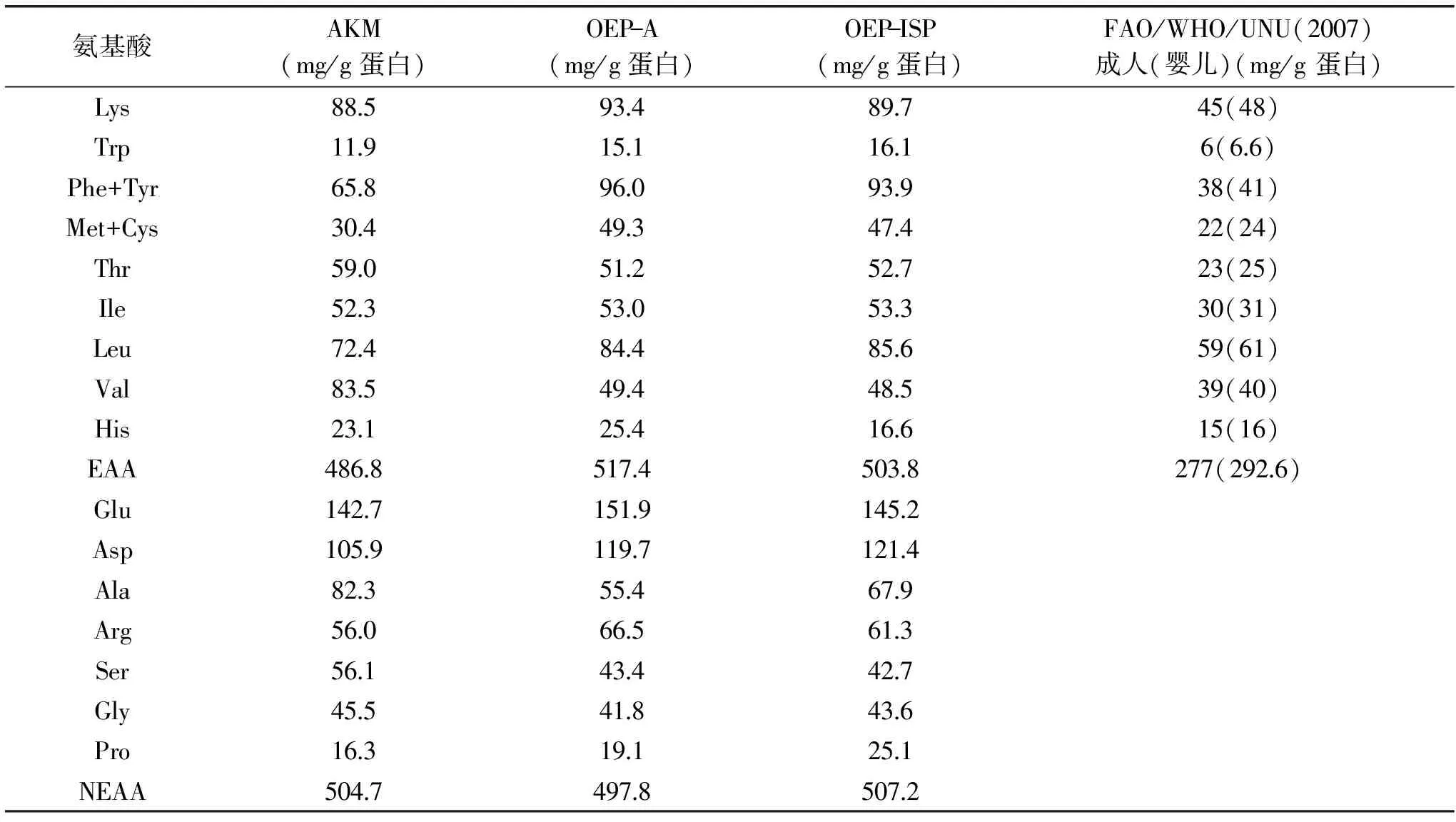
表2 南極磷蝦肉蛋白和兩種富脂蛋白的氨基酸組成Table 2 Amino acid composition of protein from AKM,OEP-A,and OEP-ISP
注:Lys,賴氨酸;Trp,色氨酸;Phe,苯丙氨酸;Tyr,絡氨酸;Met,甲硫氨酸;Cys,半胱氨酸;Thr,蘇氨酸;Ile,異亮氨酸;Leu,亮氨酸;Val,纈氨酸;His,組氨酸;Glu,谷氨酸;Asp,天冬氨酸;Ala,丙氨酸;Arg,精氨酸;Ser,絲氨酸;Gly,甘氨酸;Pro,脯氨酸;EAA,必需氨基酸;NEAA,非必需氨基酸。
2.4 氨基酸組成分析
氨基酸組成特別是必需氨基酸(EAA)的含量,是衡量蛋白質營養價值的重要指標。由表2可以看出,3種南極磷蝦蛋白中必需氨基酸的含量,分別達到486.8、517.4和503.8 mg/g蛋白,均超過FAO/WHO/UNU對成人(嬰兒)食品蛋白中必需氨基酸的要求[277(292.6) mg/g蛋白][34]。OEP-A和OEP-ISP蛋白的必需氨基酸總量在AKM蛋白的基礎上得到提升,OEP-A蛋白的必需氨基酸總量更高。經過兩種方式的處理,賴氨酸、谷氨酸、天冬氨酸和精氨酸的含量增加明顯,其中標志蛋白質營養價值的賴氨酸(Lys),在OEP-A中的含量達到93.4 mg/g蛋白,高于在AKM和OEP-ISP中的含量(88.5、89.7 mg/g蛋白)。
2.5 脂肪酸組成分析
3種脂質的脂肪酸組成如表3所示。OEP-A的PUFAs含量超過了其它2種脂質,其中EPA(C20∶5 n-3)和DHA(C22∶6 n-3)的含量之和達到30.44%,明顯高于AKM的28.39%和OEP-ISP的28.50%,ω-3 PUFAs(C18∶3 n-3、C20∶5 n-3、C22∶6 n-3)含量達31.52%,這說明OEP-A的脂質含有豐富的ω-3 PUFAs,考慮到OEP-A中的總脂含量達到43.88%干基,故本實驗將自溶法制備的脂質-蛋白復合物稱為ω-3富脂蛋白(omega-3-enriched protein,OEP)。
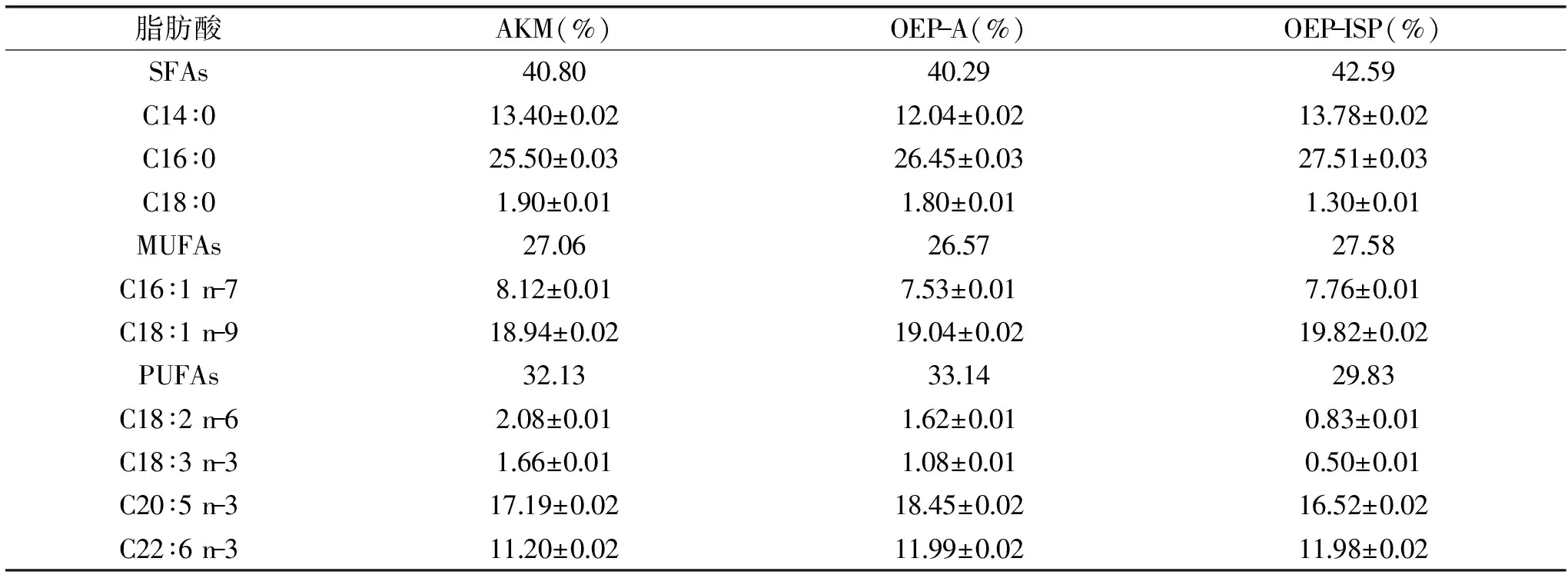
表3 南極磷蝦肉和兩種富脂蛋白脂質的脂肪酸組成Table 3 Fatty acid composition of lipids from AKM,OEP-A,and OEP-ISP
注:SFAs,飽和脂肪酸;MUFAs,單不飽和脂肪酸;PUFAs,多不飽和脂肪酸。
2.6 磷脂和游離脂肪酸含量分析
本實驗采用核磁共振方法(31P NMR)以準確定量脂肪中的磷脂含量,結果見圖4。
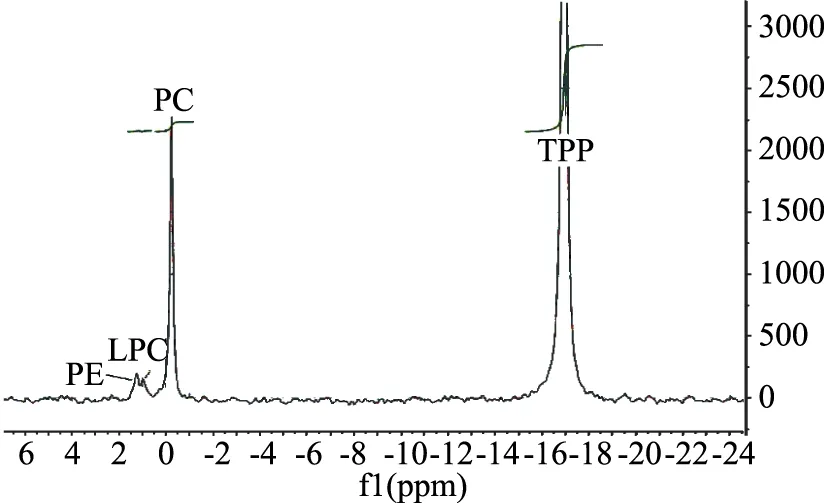
圖4 自溶法所制備的富脂蛋白脂質的31P NMR譜圖Fig.4 31P NMR spectrum of lipid from OEP prepared with autolysis
3種脂質的磷脂和游離脂肪酸含量如表4所示,OEP-A脂質的磷脂含量(48.84%±0.57%總脂)比AKM脂質中磷脂含量(33.16%±0.41%總脂)和OEP-ISP脂質中磷脂含量(34.97%±0.48%總脂)明顯提高,說明OEP-A是一種富含磷脂結合型脂質的復合物。自溶酶解法提高脂質中磷脂含量的作用機制尚未見報道,故這一發現將作為后續研究的重點。OEP-A所含的脂質,可以對人體的神經系統和心血管系統健康起到良好的維護作用[35],不僅是由于其含有豐富的ω-3 PUFAs,還有重要一點是,其脂肪酸主要以磷脂結合的形式存在,據相關研究證實,磷脂型脂質在人體內的吸收效率和安全程度更高[36-37]。因此,OEP-A可以認為是一種富含磷脂型PUFAs的復合物。OEP-A脂質中的游離脂肪酸含量較AKM的略有增加,這可能是自溶過程中脂肪酶的分解作用所致。
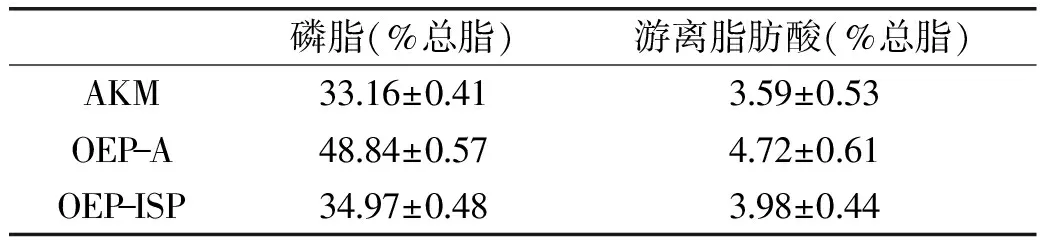
表4 三種脂質的磷脂和游離脂肪酸含量Table 4 Phospholipid and free fatty acid content of lipid from AKM and two OEP
3 結論
本研究的結果表明,可以通過優化的自溶方法:于55 ℃、pH7.5條件下經自溶酶3 h的作用,制備得到富含ω-3的蛋白-脂質復合物。該復合物具有優異的氨基酸及脂肪酸組成,其EAA、ω-3 PUFAs分別達到517.4 mg/g蛋白和31.52%脂質,并含有較高的磷脂含量(48.84%總脂),安全的氟含量(35.27 mg/kg干重)以及合理的游離脂肪酸含量(4.72%總脂)。該富脂蛋白制備過程中產生的副產物可以用于開發磷蝦風味產品,為南極磷蝦的綜合利用提供新途徑。自溶法制備的富脂蛋白對人體健康有積極的意義,具有開發功能性海洋食品的潛在價值。
[1]SuzukiT,Shibata N. The utilization of Antarctic krill for human food[J].Food Reviews International,1990,6:119-147.
[2]Grantham G J. The Southern Ocean:The Utilization of krill[M]. Rome:FAO,1977:1-61.
[3]Chen Y C,Tou J C,Aczynskia J. Amino acid and mineral composition of protein and other components and their recovery yields from whole Antarctic krill(Euphausiasuperba)using isoelectric solubilization/precipitation[J]. Journal of Food Science,2009,74:H31-H39.
[4]Virtue P,Johannes R E,Nichols P D,et al. Biochemical composition ofNyctiphanesaustralisand its possible use as an aquaculture feed source:lipids,pigments and fluoride content[J]. Marine Biology,1995,122:121-128.
[5]Nie Y C,Zhang B,Zhao X Y,et al. Seasonal Variation in Lipids and Protein Content of Antarctic Krill(Euphausiasuperba)[J]. Progress in Fishery Sciences,2016,37:1-8.
[6]Jung H R,Kim M A,Seo Y S,et al. Decreasing effect of fluoride content in Antarctic krill(Euphausiasuperba)by chemical treatments[J]. International Journal of Food Science and Technology,2013,48:1252-1259.
[7]Wang L Z,Xue C H,Wang Y M,et al. Extraction of proteins with low fluoride level from Antarctic krill(Euphausiasuperba)and their composition analysis[J]. Journal of Agricultural and Food Chemistry,2011,59:6108-6112.
[8]Sjo?dahl J,Emmer ?,Vincent J,et al. Characterization of proteinases from Antarctic krill(Euphausiasuperba)[J]. Protein Expression and Purification,2002,26:153-161.
[9]Osnes K K,Mohr V. Peptide hydrolases of Antarctic krill,Euphausiasuperba[J]. Comparative Biochemistry and Physiology B:Biochemistry and Molecular Biology,1985,82:599-606.
[10]Kimoto N. Classification of proteases in Antarctic krill[J]. Agric Biol Chem,1983,47(11):2577-2583.
[11]任艷.南極磷蝦蛋白加工利用的初步研究[D]. 青島:中國海洋大學,2009.
[12]尚憲明.南極大磷蝦脂肪酶提取純化及其酶學性質研究[D]. 青島:中國海洋大學,2011.
[13]杭虞杰,李學英,楊憲時,等.南極磷蝦自溶酶性質的初步研究[J].食品科學,2011,32(13):198-200.
[14]Erlanger B F,Kokowsky N,Cohen W. The preparation and properties of two new chromogenic substrates of trypsin[J].Archs Biochem Biophys,1961,95:271-278.
[15]鄭毅,葉海梅,吳朝娟,等.脂肪酶活力測定研究進展[J].工業微生物,2005,35(9):36-40.
[16]Folch J,Lees M,Sloane-Stanley G H. A simple method for the isolation and purification of total lipids from animal tissues[J].J Biol Chem,1957,226:497-509.
[17]Marian Kjellevold Malde,Kjell Bjorvatna,K?re Julshamn. Determination of fuoride in food by the use ofalkali fusion and fuoride ion-selective electrode[J].Food Chemistry,2001,73:373-379.
[18]O’Farrell PH. High resolution two-dimensional electrophoresis of proteins[J]. J Biol Chem,1975,250:4007-4021.
[19]樓喬明.幾種海洋動物脂質分析及EPA磷脂的活性[D]. 青島:中國海洋大學,2011.
[20]崔常樂,滕英來,汪勇,等. 核磁共振磷譜內標法測定磷脂酰膽堿的含量[J].中國糧油學報,2016,31(5):158-162.
[21]薛斌,曹文明,包杰,等.自動電位滴定法測定米糠油酸值的研究[J].中國油脂,2014,39(11):33-37.
[22]KubotaM,Sakai K. Autolysis of Antarctic krill protein and its inactivation by combined effects of temperature and pH[J]. Trans Tokyo Univ Fish,1978,2:53-63.
[23]Konagaya S.Protease activity and autolysis of Antarctic krill[J].Nippon Suisan Gakkaishi,1980,46(2):175-183.
[24]Turkiewicz M,Kalinowska H,Krystynowicz A,et al. Lipolytic activity of Antarctic krill,EuphausiasuperbaDana[J]. Polish Polar Res,1995,16:185-198.
[25]王靈昭.南極磷蝦(Euphausiasuperba)蛋白質深加工新技術的研究[D]. 青島:中國海洋大學,2012.
[26]Sands M,Nicol S,McMinn A. Fluoride in Antarctic marine crustaceans[J]. Marine Biology,1998,132:591-598.
[27]AdelungD,Buchholz F,Culik B,et al. Fluoride in tissues of krillEuphausiasuperbadana andMeganyctiphanesnorvegicaM. sars in relation to the moult cycle[J]. Polar Biol,1987,7:43-50.
[28]Xie C L,Kim H S,Shim K B,et al. Organic acid extraction of fluoride from Antarctic krillEuphausiasuperba[J]. Fish Aquat Sci,2012,15:203-207.
[29]Yoshikawa K,Inoue N,KawaiY,et al. Changes of the Solubility and ATPase activity of carp myofibrils during frozen storage at different temperatures[J].Fisheries Science,2011,61(5):804-812.
[30]Martinez I,Friis T J,Careche M. Post mortem muscle protein degradation duringice-storage of Arctic(Pandalusborealis)andtropical(PenaeusjaponicusandPenaeusmonodon)shrimps:a comparative electrophoretic and immunological study[J].J Sci Food Agric,2001,81:1199-1208.
[31]Inger V H Kjaersg?rd,Mette R N?rrelykke,Flemming Jessen. Changes in cod muscle proteins during frozen storagerevealed by proteome analysis and multivariate dataanalysis[J].Proteomics,2006,6:1606-1618.
[32]Li T T,Li J R,Hua W Z,et al. Protein changes in post mortem large yellow croaker(Pseudosciaenacrocea)monitored by SDS-PAGE and proteome analysis[J]. Food Control,2014,41:49-55.
[33]Sun L C,Chen Y L,Zhong C,et al. Autolysis of krill protein from North Pacific krillEuphausiapacificaduring protein recovery via isoelectric solubilization/precipitation[J]. Fish Sci,2014,80:839-847.
[34]WHO/FAO/UNU. Protein and amino acid requirements in human nutrition. Report of a joint WHO/FAO/UNU expert consultation[R]. WHO Technical Report Series 935,2007.
[35]Sally T,Rosanna W S,Chung E W,et al. Dietary Krill Oil Supplementation Reduces Hepatic Steatosis,Glycemia,and Hypercholesterolemia in High-Fat-Fed Mice[J].J Agric Food Chem,2009,57:9339-9345.
[36]Ruxton C,Reed S,Simpson M,et al. Health benefits of omega-3 polyunsaturated fatty acids:a review of the evidence[J]. J Hum Nutr Diet,2004,17:449-459.
[37]Gigliotti J C,Davenport M P,Beamer S K,et al. Extraction and characterisation of lipids from Antarctic krill(Euphausiasuperba)[J]. Food Chemistry,2011,125:1028-1036.
Comparative research of two omega-3-enriched protein prepared from Antarctic krill(Euphausiasuperba)with different methods
YIN Li-ang1,XUE Chang-hu1,TIAN Li-li1,JIANG Xiao-ming1,YIN Li-duan2,LI Zhao-jie1,XUE Yong1,*
(1.College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China; 2.Yantai New Era Health Industry Co.,Ltd.,Yantai 264006,China)
Omega-3-enriched protein(OEP)was prepared with controlled autolysis from Antarctic krill(Euphausiasuperba)meat(AKM)with optimization,and compared with OEP prepared with isoelectric solubilization/precipitation(ISP)from basic composition,nutritional evaluation,and variations and distributions of proteins. The optimized condition was that autolysis at 55 ℃ and pH7.5 for 3 h,either protein was demonstrated to be a protein-lipid complex which was rich in ω-3 polyunsaturated fatty acids(ω-3 PUFAs),and exhibited excellent amino-acid composition in all the essential amino acids,exceeding the requirements of the FAO/WHO/UNU for food protein. Total lipid,phospholipid,ω-3 PUFAs and essential amino acids were richer in the OEP prepared with autolysis,and the average values reached 43.88% dry basis,48.84%total lipid,31.52% lipid and 517.4 mg/g protein. This study indicated that controlled autolysis was an efficient way of preparation of ω-3-enriched protein,promotingits development as a functional seafood product in future.
Antarctic krill;ω-3-enriched protein;autolysis;ω-3 PUFAs
2016-12-20
尹利昂(1983-),男,博士研究生,工程師,研究方向:水產品加工,E-mail:yinliang2011@163.com。
*通訊作者:薛勇(1976-),男,博士,教授,研究方向:水產品加工,E-mail:xueyong@ouc.edu.cn。
山東省科技重大專項海洋食品現代加工與產業鏈質量控制體系研究(2015ZDZX05003)。
TS254.4
A
1002-0306(2017)14-0075-07
10.13386/j.issn1002-0306.2017.14.015

