凝結芽孢桿菌RY237β-半乳糖苷酶酶學性質研究
李文婷,邊 斐,王翠萍,陳 高,張 燕,朱友峰,王世榮,岳壽松,*(.山東省農業科學院生物技術研究中心,山東濟南 25000; 2.天津科技大學食品工程與生物技術學院,天津 300450)
?
凝結芽孢桿菌RY237β-半乳糖苷酶酶學性質研究
李文婷1,2,邊 斐1,王翠萍1,陳 高1,張 燕1,朱友峰1,王世榮1,岳壽松1,*
(1.山東省農業科學院生物技術研究中心,山東濟南 250100; 2.天津科技大學食品工程與生物技術學院,天津 300450)
為研究乳品中具有應用價值的乳糖酶,以乳糖為唯一碳源,用鄰硝基苯酚-β-D-半乳糖苷(ONPG)法,從產乳酸的細菌中篩選出了產乳糖酶活力高的菌株RY237,其活性達4.98 U/mL,鑒定為凝結芽孢桿菌。研究了乳糖酶的酶學性質,該酶最適反應溫度和最適pH分別為50 ℃和6.0。該酶在溫度40~50 ℃具有良好的穩定性;pH5.5~8.0表現穩定,pH7.0出現酶活峰值。金屬離子Ca2+、K+、Zn2+、Mn2+、Na+、Mg2+對酶活具有抑制作用,Cu2+對酶活具有完全抑制作用,EDTA對酶活具有激活作用。凝結芽孢桿菌RY237乳糖酶活性高、性能優良,具有應用價值。
凝結芽孢桿菌,分子鑒定,β-半乳糖苷酶,酶學性質
乳糖酶又稱為β-半乳糖苷酶,廣泛存在于植物、微生物以及哺乳動物腸道中。乳糖酶可催化乳糖水解為半乳糖和葡萄糖,對解決人體普遍存在的乳糖不耐具有重要意義,引起了廣泛關注[1-4]。目前只有來源于微生物的乳糖酶有工業應用價值。產乳糖酶微生物種類具有多樣性,包括曲霉菌、酵母菌、放線菌、芽孢桿菌、乳酸菌等[5-9]。不同來源的乳糖酶性能有很大不同,用途也不一樣。霉菌產生的乳糖酶最適pH偏酸性(pH2.5~5.0),可應用于酸性乳清和奶酪的水解;酵母菌和細菌所產乳糖酶最適pH近中性(分別為pH6~7和pH6.5~7.5),適于牛乳和鮮乳清的水解[10]。
凝結芽孢桿菌(Bacilluscoagulans)既能產乳酸又能形成芽孢,是一種重要的益生菌。近年有凝結芽孢桿菌產乳糖酶研究的報道[11-14]。Batra等研究了從溫泉中分離的凝結芽孢桿菌RCS3乳糖酶性質,該菌在50 ℃產酶量最大,65 ℃酶活性最高,酶的最適pH6~7,在pH5~8范圍酶活表現穩定,該酶良好的性能具有在乳品業開發的潛力[13]。宋春雷等對凝結芽孢菌桿菌L42產乳糖酶條件進行優化,總酶活力提高了10.8倍,達到7.1 U/mL,L42產酶最佳發酵溫度為50 ℃,該酶的最適反應溫度為65 ℃,最適pH6.0[12]。Levin等報道,凝結芽孢桿菌L4的最適溫度為55 ℃,其最適pH在30 ℃和55 ℃分別為6.0和6.5[14]。由此可見,凝結芽孢桿菌乳糖酶性質因菌株不同特點不同。因此,篩選具有高活性乳糖酶的凝結芽孢桿菌資源,研究乳糖酶性質,具有理論和實踐意義。
本研究對實驗室保存的產乳酸菌株進行乳糖酶篩選,鑒定了產乳糖酶能力強的菌株,并研究了乳糖酶性質,為該菌種的開發利用提供理論依據。
1 材料與方法
1.1 材料與儀器
產乳酸菌株LP1119、LP777、LP738、LC544、LC 868、LC 727、RY 237和大腸桿菌(Escherichiacoli)DH5α本實驗室保存;pMD18-T載體 TakaRa公司;pET28a(+) Novagen公司;鄰硝基苯酚-β-D-吡喃半乳糖苷(ONPG,色譜純) Bio Basic Inc公司(上海生物工程有限公司分裝);鄰硝基苯酚(ONP,色譜純) 國藥集團化學試劑有限公司;ONPG磷酸鹽緩沖液 0.6025 g ONPG溶于100 mL磷酸鹽緩沖溶液;pH7.0磷酸鹽緩沖溶液 13.6 g磷酸二氫鈉、0.06 g硫酸鎂、0.126 g氯化錳溶于1L水;檸檬酸-磷酸氫二鈉緩沖溶液 0.1 mol/L檸檬酸與0.2 mol/L磷酸氫二鈉混合;0.1 mol/L醋酸-醋酸鈉緩沖溶液 0.2 mol/L的醋酸和0.3 mol/L的醋酸鈉混合后稀釋一倍;0.05 mol/L甘氨酸-氫氧化鈉緩沖溶液 0.2 mol/L的甘氨酸和0.2 mol/L的氫氧化鈉混合;乳糖MRS(L-MRS)培養基(g/L) 牛肉膏10,酵母膏5,蛋白胨10,檸檬酸氫二銨2,磷酸氫二鉀2,乳糖20,MnSO4·H2O 0.23,MgSO4·7H2O 0.58,無水乙酸鈉5 g,吐溫-80 1 mL,pH6.4。
冷凍高速離心機 美國Thermo Fisher公司;PCR儀 日本Takara公司;UP200s型超聲波破碎儀 德國Dr.Hielscher公司;TSQ-280型立式搖床 上海精宏實驗設備有限公司;723型可見分光光度計 上海光譜儀器有限公司。
1.2 標準曲線繪制
取6支試管分別加入200 μg/mL的ONP溶液0、0.2、0.4、0.6、0.8、1.0 mL,用磷酸鹽緩沖液補足至1 mL。37 ℃水浴10 min。分別加入4 mL 0.5 mol/L Na2CO3。以第一只試管為空白,測OD420。以ONP濃度(mmol/L)為縱坐標,OD420為橫坐標繪制標準曲線。
1.3β-D-半乳糖苷酶活性的測定
1.3.1 酶的發酵與提取 將菌株接種于L-MRS培養基,37 ℃、150 r/min振蕩培養24 h。取培養液4 mL,4 ℃、7000 r/min離心15 min,棄上清。菌體用0.1 mol/L磷酸鹽緩沖溶液(pH7.0)洗滌、7000 r/min離心15 min。重復兩次。收集菌體并用0.1 mol/L磷酸鹽緩沖溶液(pH7.0)添加至4 mL,60 W超聲破碎15 min后于4 ℃、12000 r/min離心5 min,取上清液測酶活。
1.3.2 酶活性測定 取1 mL酶提取液,37 ℃水浴預熱5 min,加入已預熱至37 ℃的含20 mmol/L ONPG磷酸鹽緩沖液1.0 mL,37 ℃水浴反應10 min,然后立即加入3 mL 0.5 mol/L Na2CO3終止反應,測OD420。以65 ℃加熱失活的酶液作為空白對照。一個酶活力單位(U)定義為:37 ℃條件下,1 min水解產生1 μmol ONP所需要的酶量。乳糖酶活力計算公式如下:
X=(C×20×N)/10,其中,X為乳糖酶活力;C為標準曲線上對應的ONP濃度;N為稀釋倍數。
1.4 菌株生理生化反應
生理生化特性測定參照《常見細菌系統鑒定手冊》中的方法[15]。
1.5 16S rDNA基因的克隆、測序
菌株基因組DNA提取參照《精編分子生物學指南》[16]的方法略有改動。擴增細菌16S rDNA通用引物。上游P1:5′-AGAGTTTGATCCTGGCTCAG-3,下游P2:5′-TACGGCTACCTTGTTACGACT-3。以菌株基因組為模板,P1、P2為引物,PCR擴增16S rDNA。PCR擴增條件為:95 ℃ 5 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 2 min,30個循環;最后72 ℃ 10 min。PCR擴增產物經膠回收后克隆至pMD18-T載體,轉化E.coliDH5α,選取正確的陽性克隆送上海生工測序。
1.6 系統發育樹構建
將16S rDNA序列與GenBank里的已知核酸序列進行BLAST分析。選取與該序列同源性較高的已知菌株的16S rDNA序列,利用MEGA6.0軟件進行多序列比和系統發育樹構建。
1.7β-D-半乳糖苷酶酶學性能
1.7.1 最適反應溫度與熱穩定性 最適反應溫度:200 μL磷酸鹽緩沖液(pH7.0)稀釋的酶液,30、40、50、60、70 ℃保溫5 min,同時將200 μL ONPG溶液依次在相同溫度下保溫5 min,將ONPG加入到酶液中,在各溫度下反應10 min,加入600 μL Na2CO3終止反應。計算各時間酶活與最高酶活的百分比,確定酶最適反應溫度。
酶的熱穩定性:200 μL磷酸鹽緩沖液稀釋的酶液,40、50、60、65 ℃保溫0、10、20、30、40、50 min。同時將200 μL ONPG溶液依次在相同溫度下進行保溫,將ONPG加入到粗酶液中,37 ℃反應10 min,加入600 μL Na2CO3終止反應,測OD420,以65 ℃加熱失活的酶液作為空白對照,以0時間酶活為100%,計算各時間酶活與最高酶活百分比。
1.7.2 最適pH和pH穩定性 最適pH:在最適溫度下,按1.3.2酶活測定方法,測定pH4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0條件下酶活性。計算各pH酶活與最高酶活的百分比,確定酶最適反應pH。
pH穩定性:將酶液分別置于pH為4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0的緩沖溶液中,37 ℃放置18 h,測定各pH條件下的酶活,以最高酶活為100%,計算各pH酶活與最高酶活百分比,測定酶的pH穩定性[17-18]。
1.7.3 金屬離子和EDTA對酶活的影響 在酶促反應體系中加入1 mol/L的Mn2+、Mg2+、Na+、K+、Ca2+、Cu2+、Zn2+、EDTA溶液,使最終反應體系中金屬離子的濃度為1 mmol/L,測定酶活力以加熱失活的酶液作為空白對照。不加金屬離子溶液的酶活作為對照,計算相對酶活。
2 結果與分析
2.1 ONPG標準曲線
以光密度OD420為橫坐標,ONP濃度為縱坐標繪制乳糖酶活標準曲線,相關系數R2=0.998(圖1),說明該標準曲線可用于乳糖酶的測定。
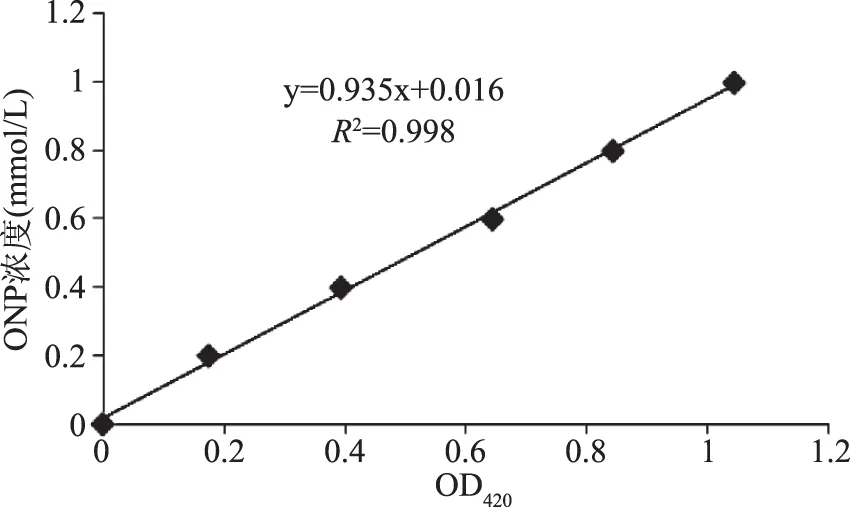
圖1 β-半乳糖苷酶活性測定標準曲線Fig.1 Standard curve of β-galactosidase
2.2 產乳酸菌株的乳糖酶活性

圖3 基于16S rDNA序列的系統發育樹Fig.3 Unrooted phylogenetic tree based on the 16S rDAN sequence
將RY237、LC777、LP272、LP119、LC868,LP554和LC738菌株L-MRS培養基液體培養24 h,由于不同菌株培養液的光密度OD600存在差異,以光密度最低的菌株OD值0.7為標準,把各菌株培養液的OD600調節為0.7,然后利用1.3.1中酶的提取方法收集菌體,磷酸緩沖液洗滌兩次,重新懸浮,超聲波破碎,離心取上清液測定各菌株酶活。結果表明,各菌株酶活高低依次為RY237(4.98 U/mL)、LC777(0.34 U/mL)、LP272(0.28 U/mL)、LP119(0.11 U/mL)、LC868(0.08 U/mL),LP554和LC738沒有檢測到乳糖酶活性(圖2)。關于乳酸菌乳糖酶報道較多,酶活一般在5 U/mL以下[17-20],RY237乳糖酶活性明顯高于已報道的乳糖酶,說明具有潛在的開發應用價值。
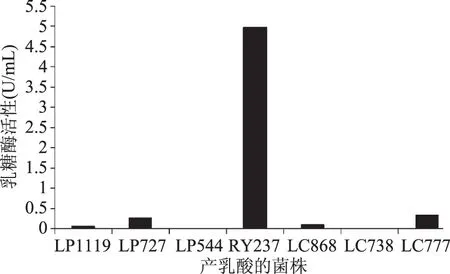
圖2 不同菌株乳糖酶活性Fig.2 Activity of β-galactosidase in different strains
2.3 菌株鑒定
2.3.1 生理生化特征 菌株生長特征為:可以在15~55 ℃下生長,NaCl 7%時生長被抑制。生理生化反應結果表明,RY237菌株能發酵葡萄糖產酸,明膠不液化,能水解酪素和淀粉,不能利用檸檬酸鹽和丙酸鹽,V-P實驗陽性,接觸酶和過氧化氫酶陽性,卵黃反應和吲哚產生實驗陰性,可發酵甘露糖、阿拉伯糖。菌株RY237生長特征和生理生化特性與凝結芽孢桿菌的特征吻合[15]。

表1 菌株RY237生理生化特征Table 1 Biological and physiological characteristics of strain RY 237
注:“+”,陽性反應;“-”,陰性反應。
2.3.2 分子鑒定 測序結果表明,RY237菌株16S rDNA序列全長1450 bp。將該序列提交NCBI進行BLAST,結果發現其與凝結芽孢桿菌(Bacilluscoagulans)同源性最高,達99%。根據同源性比對結果,選出相關性較高和芽孢桿菌屬內相關菌株的16S rDNA序列構建系統發育樹,結果顯示其與Bacilluscoagulans聚為一族(圖3)。結合生理生化特征及16S rDNA分子鑒定結果,將RY237鑒定為凝結芽孢桿菌,命名為BacilluscoagulansRY237。
2.4 RY237乳糖酶最適反應溫度與熱穩定性
酶最適反應溫度是酶的重要性能,乳糖酶商業應用中一般要求酶的最適溫度為37 ℃或更高[21]。本研究在pH7.0條件下,按照1.3.1對RY327提取乳糖酶,測定30~70 ℃范圍內乳糖酶活性變化。結果表明,酶活性隨溫度升高而先增加后減少,40 ℃酶活上升到較高水平(最高值的90.6%),50 ℃酶活最高,60 ℃酶活為最高值的72.8%,之后快速下降,至70 ℃已檢測不到酶活(圖4)。由此可以確定菌株R237乳糖酶的最適溫度為50 ℃。該值與已報道的凝結芽孢桿菌乳糖酶的最適反應溫度有所不同,鄭兆娟等報道凝結芽孢菌桿菌L42最適反應溫度為65 ℃[11],另有最適反應溫度為63 ℃[13]和55 ℃[14]的報道。說明RY327乳糖酶的性能與已報道的菌株性能不同。
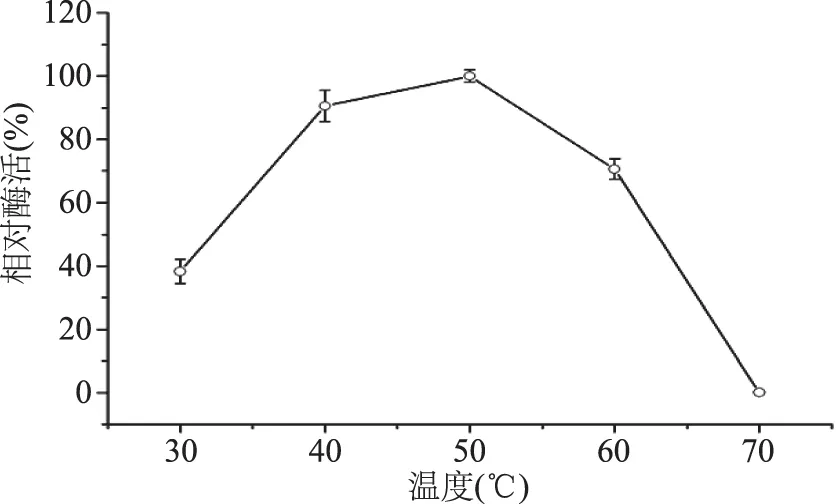
圖4 不同溫度下乳糖酶活性變化Fig.4 Effect of temperature on activity of β-galactosidase
將酶分別置于40、50、60、65 ℃不同時間(10~50 min)測定酶活性。以最高值為100%,計算各溫度不同保溫時間的相對酶活。結果表明,乳糖酶活性在40 ℃和50 ℃具有較好的穩定性,保溫30 min,酶活仍保持最高值90%以上(分別為92.1%和90.1%)。60 ℃穩定性下降,保溫30 min,酶活只有最高值的62.8%;65 ℃酶活急劇下降,保溫20 min酶活僅為最高值的2.5%,至30 min已檢測不到酶活,說明該酶對熱敏感(圖5)。

圖5 乳糖酶熱穩定性Fig.5 Termostability of β-galactosidase
2.5 RY237乳糖酶最適pH與pH穩定性
按照1.3對RY327提取乳糖酶和乳糖酶的活性測定,圖6表明酶最適pH為6.0。乳糖酶最適pH決定了其不同用途,霉菌產生的乳糖酶最適pH偏酸性(pH2.5~5.0),可應用于酸性乳清和奶酪的水解;酵母菌和細菌所產乳糖酶的最適pH近中性(分別為pH6~7和pH6.5~7.5),適于牛乳(pH6.6)和鮮乳清(pH6.1)的水解[10]。該結果說明凝結芽孢桿菌RY237在乳制品水解領域具有應用價值。
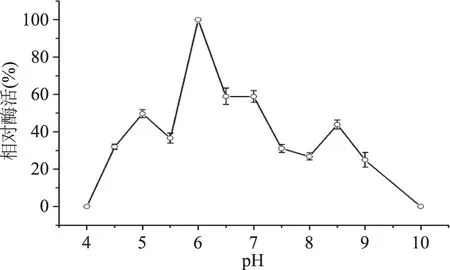
圖6 不同pH條件下乳糖酶酶活變化Fig.6 Effect of pH on activity of β-galactosidase
將酶液在不同的pH緩沖溶液中37 ℃保溫18 h,測定各pH條件下的酶活性,計算相對酶活。結果表明,酶在pH7.0酶活最高,最穩定。37 ℃、pH5.5~8.5維持18 h,酶活保持80%以上(圖7),說明該酶在pH5.5~8.0范圍內具有較高的穩定性,該酶pH適應范圍寬泛,具有潛在的應用價值。
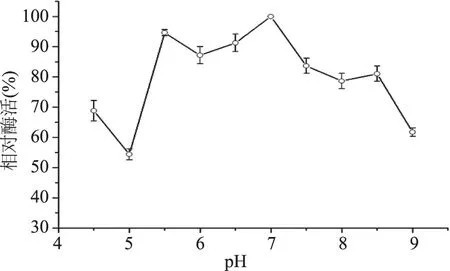
圖7 乳糖酶pH穩定性Fig.7 pH stability of β-galactosidase
2.6 金屬離子和EDTA對乳糖酶活性的影響
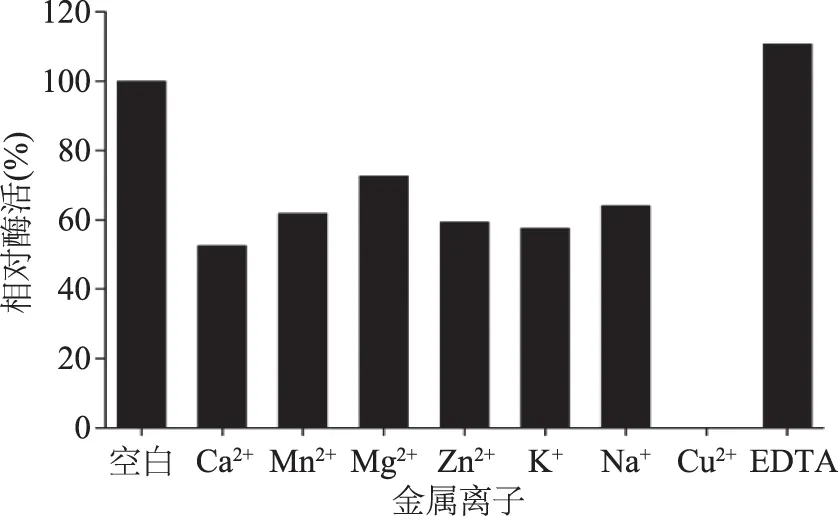
圖8 金屬離子和EDTA對乳糖酶活力的影響Fig.8 Effect of metalic ions and EDTA on β-galactosidase activity
金屬離子對酶活具有激活或抑制作用,按照1.3.1對RY327提取乳糖酶,測定了金屬離子Mn2+、Mg2+、Na+、K+、Ca2+、Cu2+、Zn2+對乳糖酶活性的影響。結果表明,上述7種金屬離子對酶活均有抑制作用,其中Cu2+對酶活具有完全抑制作用,剩余酶活依次分別為Ca2+(52.6%)、K+(57.6%)、Zn2+(59.4%)、Mn2+(61.8%)、Na+(64.1%)、Mg2+(72.7%)。EDTA對乳糖酶活具有激活作用(110.8%),可能在于EDTA對酶活性位點具有保護作用(圖8)。高曉峰研究植物乳桿菌產生的乳糖酶,金屬離子Mg2+、Mn2+對酶活性具有顯著的激活作用,而Cu2+、EDTA對酶活有較強的抑制作用[22]。說明酶的來源不同,性能不同。上述結果可作為酶活性調節與控制的理論依據。
3 結論
本研究以乳糖為唯一碳源,利用ONPG作為底物,從產乳酸的細菌中篩選出了產乳糖酶活力高的菌株RY237,鑒定為凝結芽孢桿菌(Bacilluscoagulans)RY237。研究了RY237乳糖酶的性質,結果表明,該酶在溫度40~50 ℃具有較高的酶活性(酶活為90.6%~100%),最適反應溫度為50 ℃,低于已報道的凝結芽孢桿菌乳糖酶的最適反應溫度,而且該酶在40~50 ℃具有很強的穩定性,說明其在高酶活區保持穩定的性能,具備良好生產潛力。該酶的最適pH為6.0,7.0最穩定,適于牛乳和乳清的水解。金屬離子對酶活抑制作用的影響為Cu2+>Ca2+>K+>Zn2+>Mn2+>Na+>Mg2+,Cu2+對酶活具有完全抑制作用,EDTA對乳糖酶活具有激活作用。因此,凝結芽孢桿菌RY237乳糖酶具有新穎性和較好的應用潛力,實驗結果為研究和開發乳糖酶提供了理論依據。
[1]Husain Q.β-Galactosidases and their potential applications:a review[J]. Critical Reviews in Biotechnology,2010,30(1):41-62.
[2]張敏文,顧取良,張博,等.乳糖酶研究進展[J].微生物學雜志,2011,31(3):81-86.
[3]Mlichova Z,Rosenberg M. Current trends ofβ-galactosidase application in food technology[J]. Journal of Food and Nutrition Research,2006,45(2):47-54.
[4]Park AR,Oh DK. Galacto-oligosaccharide production using microbial beta-galactosidase:current state and perspectives[J]. Appl Microbiol Biotechnol,2010,85(5):1279-1286.
[5]何熹,王彥寧,李超,等. 乳酸菌與乳糖酶[J]. 食品研究與開發,2016,36(16):202-205.
[6]Hsu CA,Yu RC,Chou CC. Production ofβ-galactosidase byBifidobacteriaas influenced by various culture conditions[J]. International Journal of Food Microbiology,2005,104(2):197-206.
[7]Nagy Z,Kiss T,Szentirmai A,et al. Beta-galactosidase ofPenicilliumchrysogenum:production,purification,and characterization of the enzyme[J]. Protein Expr Purif,2001,21(1):24-29.
[8]Zagustina NA,Tikhomirova AS,Biokhimiia. Purification and properties of beta-galactosidase from fungusCurvulariainaequalis[J]. Biokhimiya,1976,41(6):1061-1066.
[9]Fischer L,Scheckermann C,Wagner F. Purification and characterization of a thermotolerant beta-galactosidase fromThermomyceslanuginosus[J]. Appl Environ Microbiol,1995,61(4):1497-1501.
[10]張紅艷,劉成更.乳糖酶的酶學特性及其研究進展[J].食品研究與開發,2004,25(6):34-36.
[11]鄭兆娟,徐穎,石磊,等.凝結芽孢桿菌中β-半乳糖苷酶基因的克隆及表達[J].南京林業大學學報:自然科學版,2015,39(6):35-39.
[12]宋春雷,閆巧娟,江正強,等.凝結芽孢桿菌產β-半乳糖苷酶條件的優化[J].中國農業大學學報,2010,15(5):110-114.
[13]Batra N,Singh J,Banerjee UC,et al. Production and characterization of a thermostable beta-galactosidase fromBacilluscoagulansRCS3[J]. Biotechnol Appl Biochem,2002,36(1):1-6.
[14]Levin RE,Mahoney RR. Purification and characterization ofβ-galactosidase from a strain ofBacilluscoagulans[J]. Antonie Van Leeuwenhoek,1981,47(1):53-64.
[15]東秀珠,蔡妙英,等編著. 常見細菌系統鑒定手冊[M].北京:科學出版社,2001:62-63.
[16]Osborn F,Blinder R,Justin RE,et al. 顏子穎,王海林譯. 精編分子生物學實驗指南[M].第一版. 北京:科學出版社,2001:39-40.
[17]張衛兵,張炎,文鵬程,等.EnterobacterSYA2乳糖酶酶學性質研究[J].中國釀造,2012,31(11):93-98.
[18]Vivek DF,Susan TLH,Aniruddha BP. Improved cavitational cell disruption following pH pretreatment for the extraction ofβ-galactosidase fromKluveromyceslactis[J]. Biochemical Engineering Journal,2006(31):25-30.
[19]盧麗麗,肖敏,徐曉東.EnterobactercloacaeB5產轉糖基β-半乳糖苷酶發酵條件優化[J]. 應用與環境生物學報,2008,14(1):118-121.
[20]李玉梅,盧麗麗,肖敏. 產轉糖基β-半乳糖苷酶菌株 F3的鑒定、產酶條件及轉糖基活性研究[J].山東大學學報,2009,44(1):1-6.
[21]Karasov P,Spiwok V,Mal KR,et al. Beta-galactosidase activity in psychrotrophic microorganisms and their potential use in food industry[J]. Czech J Food Sci,2002,20:43-47.
[22]高曉峰,周穎,霍貴成.一株植物乳桿菌乳糖酶性質的研究[J].食品工業,2014(11):260-264.
Characterization ofβ-galactosidase fromBacilluscoagulansRY237
LI Wen-ting1,2,BIAN Fei1,WANG Cui-ping1,CHEN Gao1,ZHANG Yan1, ZHU You-feng1,WANG Shi-rong1,YUE Shou-song1,*
(1.Bio-Tech Research Center,Shandong Academy of Agricultural Sciences,Jinan 250100,China; 2.College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300450,China)
A novel lactase-producing bacterium RY237 was selected based onβ-galactosidase activity using lactose as sole carbon media,and was identified asBacilluscoagulansRY327. The activity of lactase reached 4.98 U/mL. The optimum temperature and optimum pH ofβ-galactosidase were 50 ℃ and 6.0,respectively. The enzyme was stable at pH5.5~8.0,with peak activity at pH7.0,and it was also stable at 40~50 ℃. The activity ofβ-galactosidase was inhibited by Ca2+,K+,Zn2+,Mn2+,Na+,Mg2+and completely inhibited by Cu2+. Its activity was promoted by ethylene diamine tetraacetic acid(EDTA). The high activity,thermostability and pH-stability make this enzyme potentially useful in dairy industry.
Bacilluscoagulans;molecular identification;β-galactosidase;enzymatic characterization
2017-01-03
李文婷(1992-),女,碩士研究生,研究方向:發酵食品與微生物資源開發,E-mail:liwentinghaoye@163.com。
*通訊作者:岳壽松(1965-),男,博士,研究員,研究方向:微生物資源,E-mail:yueshousong@163.com。
山東省農業科學院農業科技創新工程(CXGC2017A01和CXGC2016B13);山東省重點研發計劃項目(2016GGH3111)。
TS201.3
A
1002-0306(2017)14-0111-05
10.13386/j.issn1002-0306.2017.14.022

