一種新型可降解藍光固化醫用粘合劑的合成及其性能研究
王 敏, 龔文輝, 黃 鵬, 李 森, 葉曉峰*, 游正偉*
(1. 東華大學 材料科學與工程學院 纖維材料改性國家重點實驗室,上海 201620;2. 上海交通大學 醫學院附屬瑞金醫院 心臟外科, 上海 200025)
·快遞論文·
一種新型可降解藍光固化醫用粘合劑的合成及其性能研究
王 敏1, 龔文輝2, 黃 鵬1, 李 森2, 葉曉峰2*, 游正偉1*
(1. 東華大學 材料科學與工程學院 纖維材料改性國家重點實驗室,上海 201620;2. 上海交通大學 醫學院附屬瑞金醫院 心臟外科, 上海 200025)
臨床外科手術縫合費時費力,且容易留下疤痕,醫用粘合劑為解決這些問題提供了一種有效手段。本文基于在生物材料領域廣泛應用的可降解材料聚癸二酸甘油酯(PGS),研制了一種新型的可降解藍光固化醫用粘合劑。以PGS為基體與甲基丙烯酸(2-異氰基乙基)酯反應制得聚癸二酸甘油酯接枝甲基丙烯酸(2-異氰基乙基)酯(PGS-IM)粘結劑,其結構和性能經1H NMR, ATR-FTIR, TGA和DSC表征。并測試了其藍光固化后的粘結性能,考察了其生物相容性。結果顯示:PGS-IM的玻璃化轉變溫度為-30.6 ℃;玻璃和PET板的粘結強度分別為0.84±0.12 MPa和0.39±0.07 MPa。 RAECs培養實驗顯示其具有良好的生物相容性。
聚癸二酸甘油酯; 甲基丙烯酸(2-異氰基乙基)酯; 接枝; 醫用粘合劑; 合成; 藍光固化; 生物相容性
縫合技術是外科手術成功的關鍵,具有相當的技術難度,且耗時較長,技術均一性差。對于外科手術縫合而言,如果縫合不嚴密,可能會引起局部組織出血、感染甚至不愈合。醫用粘合劑作為一種新的閉合技術,簡便易用、操作快捷,同時具有止血等作用,受到人們日益廣泛的關注。目前,臨床上可用的粘合劑主要包括醫用級氰基丙烯酸酯(CA)和纖維蛋白封閉劑,前者在體內使用有一定的毒性,后者粘結性弱易被沖洗掉,因而這兩類粘合劑的應用均受到限制[1-2]。近年來,新型醫用粘合劑的研究越來越多,已開發出如改性聚(乙烯醇)粘合劑[3]、多糖類生物粘合劑[4]和膠原類粘合劑[5-6]等。這些粘合劑通常是通過化學反應實現粘結組織的,往往存在涂上后固化快、不便于實現細微的調整或固化慢、粘結作用較弱等問題。光固化醫用粘合劑由于其施膠方便、固化速度快、粘結強度高,受到研究人員的日益青睞[7-12]。然而,這些粘合劑多是親水性的,在體內易吸水膨脹或被沖水快速沖走[13]。
聚(癸二酸甘油酯)[poly(glycerol sebacate), PGS][14-15]是一種生物相容性良好、可生物降解的疏水性聚合物。眾所周知,PGS是由生物相容性良好的癸二酸和甘油制備的,具有較好的生物相容性、可調控的力學性能和降解性能,因此PGS廣泛應用于組織工程、生物膠以及藥物緩釋中。研究表明,以PGS為基體結合丙烯酰氯制備的丙烯酸化聚癸二酸甘油酯(PGSA),將其涂覆在組織病患處,在紫外光照條件下可以使組織粘結在一起,時間短、粘結強度高[16]。然而在制備PGSA的過程中,具有揮發性和腐蝕性的丙烯酰氯和三乙胺,以及制備過程中產生的有毒氣體氯化氫對人體均有一定的損傷,實驗不易控制,操作較為復雜。另外,當前光固化醫用粘合劑的研究多集中于紫外光固化方面,由于紫外光對組織和細胞有一定損傷,因此使其應用受到限制。
為了克服上述問題,本文以PGS為基體結合甲基丙烯酸(2-異氰基乙基)于80 ℃(油浴)反應20 min,制備一種新的酯接枝PGS(PGS-IM)粘結劑(Scheme 1),其結構經1H NMR和ATR-FTIR表征。通過熱重分析(TGA)和差示掃描量熱分析(DSC)考察了其熱學性能,測試了其藍光固化后的粘結性能,并在其上培養SD大鼠的胸主動脈內皮細胞(RAECs),考察了其生物相容性。
該研究中PGS-IM的制備方法較為簡單,并且不會產生有毒氣體副產物;PGS-IM的側鏈較PGSA的長,容易在光照條件下發生交聯固化,并證實其是一種可藍光固化的醫用粘合劑。PGS已被證實具有良好的生物可降解性[17],可以預見這種基于PGS的生物膠也具有較好的生物降解性。
1 實驗部分
1.1 儀器與試劑
Bruke AM-400(400 MHz)型核磁共振儀(acetone-d6為溶劑,TMS為內標);Nicolet 6700型紅外光譜儀;Discovery型熱重分析儀(TGA); 204 F1 Phoenix型差示掃描量熱儀(DSC);藍光光固化機(波長:430~485 nm, 1500 Mw·cm-2); 20KN/WDW3020型微控電子萬能試驗機(配備200 N傳感器);OLYMPUS IX71型倒置相差顯微鏡。
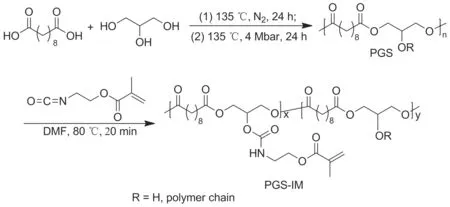
Scheme 1
癸二酸(≥99%)、無水N,N-二甲基甲酰胺(DMF, 99.8%)和甲基丙烯酸(2-異氰基乙基)酯(98%),百靈威科技有限公司;甘油(≥99.5%),西格瑪奧德里奇中國公司;THF(≥99.9%),國藥集團化學試劑有限公司;樟腦醌(98%)和2.4-二甲氨基-苯甲酸乙酯(98%),百靈威;DMEM(11965-092)培養基,美國Gibco公司。
1.2 制備
(1) PGS的制備[18]
將重結晶純化后的癸二酸20.257 4 g(0.1 mol)和甘油9.203 7 g(0.1 mol)加入三口燒瓶中,于135 ℃熔融,通N2反應24 h;于135 ℃抽真空(4 Mbar)48 h。冷卻至室溫得淡黃色蠟狀固體PGS。
(2) PGS-IM的制備
PGS-IM的合成中加料在手套箱中(水含量≤0.1 mg·L-1,氧含量≤0.1 mg·L-1)進行。在反應瓶中依次加入PGS 1.21 g(4.69 mmol)和無水DMF 1.6 mL,氮氣保護下于80 ℃(浴溫)攪拌使PGS完全溶解;加入甲基丙烯酸(2-異氰基乙基)酯359.5 mg(2.35 mmol),于80 ℃(浴溫)反應20 min。用去離子水沉淀除去DMF,用四氫呋喃溶解,重復操作三次,得白色黏稠半固體PGS-IM 1.038 g,產率70%。
1.3 PGS-IM的熱學性能表征
PGS-IM的熱學性能通過TGA和DSC測試所得。TGA測試在氮氣氛圍中,以10 ℃·min-1升溫速率從40 ℃升至500 ℃。 DSC測試在氮氣氛圍中,以10 ℃·min-1的速率從室溫升溫至150 ℃消除熱歷史,然后降溫至-70 ℃,再從-70 ℃升溫至150 ℃,進行測試。玻璃化轉變溫度(Tg)按玻璃化轉變過程中的中點溫度確定,由儀器自帶的分析軟件得出。
1.4 PGS-IM粘結性能實驗
PGS-IM的粘結實驗由透光性較好的玻璃板和可作心臟補片的材料聚(對苯二甲酸乙二醇酯)(PET)板材完成,光源為一臺藍光光固化機,參考國標(GB/T 7124-2008)中膠黏劑的測試方法。將藍光光固化催化劑樟腦醌和2.4-二甲氨基-苯甲酸乙酯按1 ∶4(m∶m)混合后,按1%(w/w)當量加入PGS-IM中,混合均勻,避光存放。一端帶孔(便于力學測試)的玻璃板(100 mm×35 mm×5 mm)另一端均勻涂上20 mg混有催化劑的PGS-IM,涂膠面積35 mm×12 mm,將另一塊玻璃板壓緊固定,用藍光光固化機照射60 s。用鐵絲穿過玻璃板的孔,將鐵絲固定在萬能試驗機夾具上,以5 mm·min-1拉伸速度進行拉伸測試。PET板測試采用8 mm厚的PET板,將其裁剪成100 mm×20 mm的長條,每兩片PET板間均勻涂上10 mg混有催化劑的PGS-IM,涂膠面積20 mm×10 mm,固定后,藍光光固化機照射60 s。將PET板樣條直接夾在萬能試驗機夾具上以5 mm·min-1速度進行拉伸測試。玻璃和PET板均測試5個樣品,剪切強度取平均值。
1.5 PGS-IM的生物相容性測試
將混有催化劑的PGS-IM配制成1 g·L-1的四氫呋喃(THF)溶液,取100 μL均勻涂在細胞爬片(φ18 mm)上,待溶劑揮發后,藍光光固化機照射30 s,固化后用蒸餾水水沖洗掉殘余溶劑。將含有新合成的生物膠涂層的玻璃片和對照的純玻璃片各三塊,放在含有DMEM的6孔平底板中,然后,將按參考文獻中[19-20]描述的方法培養的RAECs重新懸浮在上述6孔細胞培養板中培養24 h。用倒置相差顯微鏡觀察細胞生長情況。
2 結果與討論
2.1 PGS-IM的合成
首先由癸二酸和甘油在真空加熱條件下發生縮聚反應制得PGS,然后將具有甲基丙烯酸結構的甲基丙烯酸(2-異氰基乙基)酯通過異氰酸酯基和羥基的反應接枝到PGS上,合成可光固化的PGS-IM。 PGS-IM具有一個高度不對稱的雙鍵結構,活性較高,可通過藍光誘導交聯。另外,其側鏈具有氨基甲酸結構,可與組織形成氫鍵,提高其與組織間的粘結力。
2.2 表征
從PGS-IM的1H NMR譜圖(圖1)可以觀察到PGS的癸二酸部分的質子信號分別標為a1, a2, a3(δ1.35, 1.62和2.35),積分比為2 ∶1 ∶1,驗證了癸二酸部分的結構。標記為b(δ1.93)的信號峰是甲基丙烯酸(2-異氰基乙基)酯中甲基的質子信號,標記為c1(δ5.61)和c2(δ6.12)的信號峰歸屬甲基丙烯酸(2-異氰基乙基)酯雙鍵中氫質子,三者積分比為3 ∶1 ∶1,與結構完全符合,從而證實了甲基丙烯酸(2-異氰基乙基)酯的成功接枝。根據接枝側基的特征峰c1(1個烯氫質子)和主鏈的特征峰a2(癸二酸結構中的4個亞甲基氫質子)的積分比為0.08 ∶1,計算得接枝率為32%。
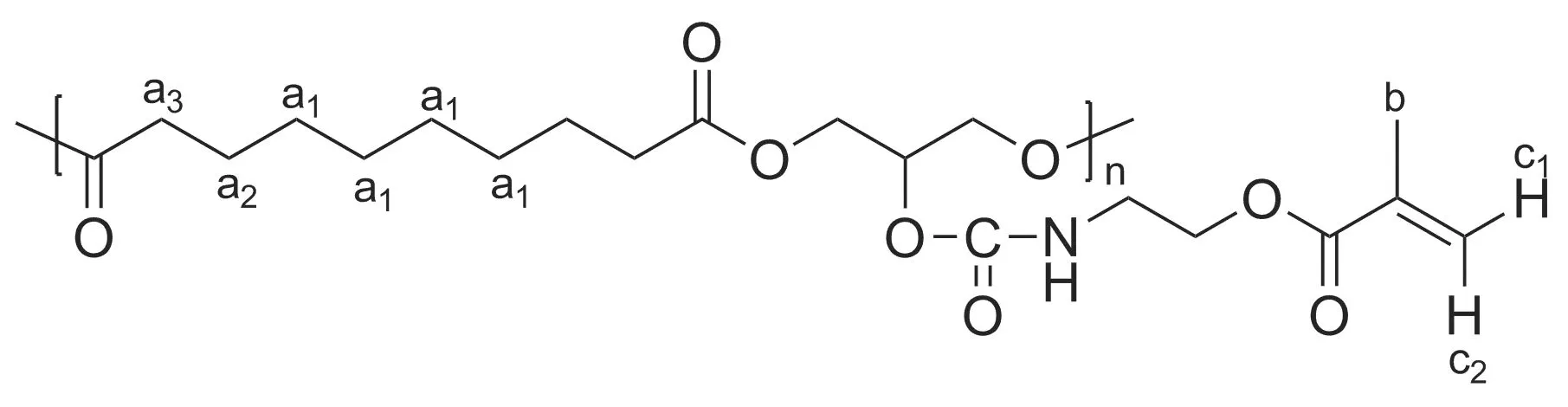
δ
圖2為PGS-IM的FT-IR譜圖。由圖2可以看出,3 400 cm-1處的寬峰對應PGS-IM上剩余的未接枝的羥基吸收峰,2 928 cm-1和2 855 cm-1處吸收峰為甲基、亞甲基和次甲基中的C—H吸收峰,1 738 cm-1處尖而強的吸收峰對應羰基的雙鍵伸縮振動峰,1 642 cm-1處吸收峰對應PGS-IM結構中的雙鍵(CH=CH2)吸收峰,1 540 cm-1是酰亞胺基(CONH)的吸收峰,進一步證實了PGS-IM的結構。
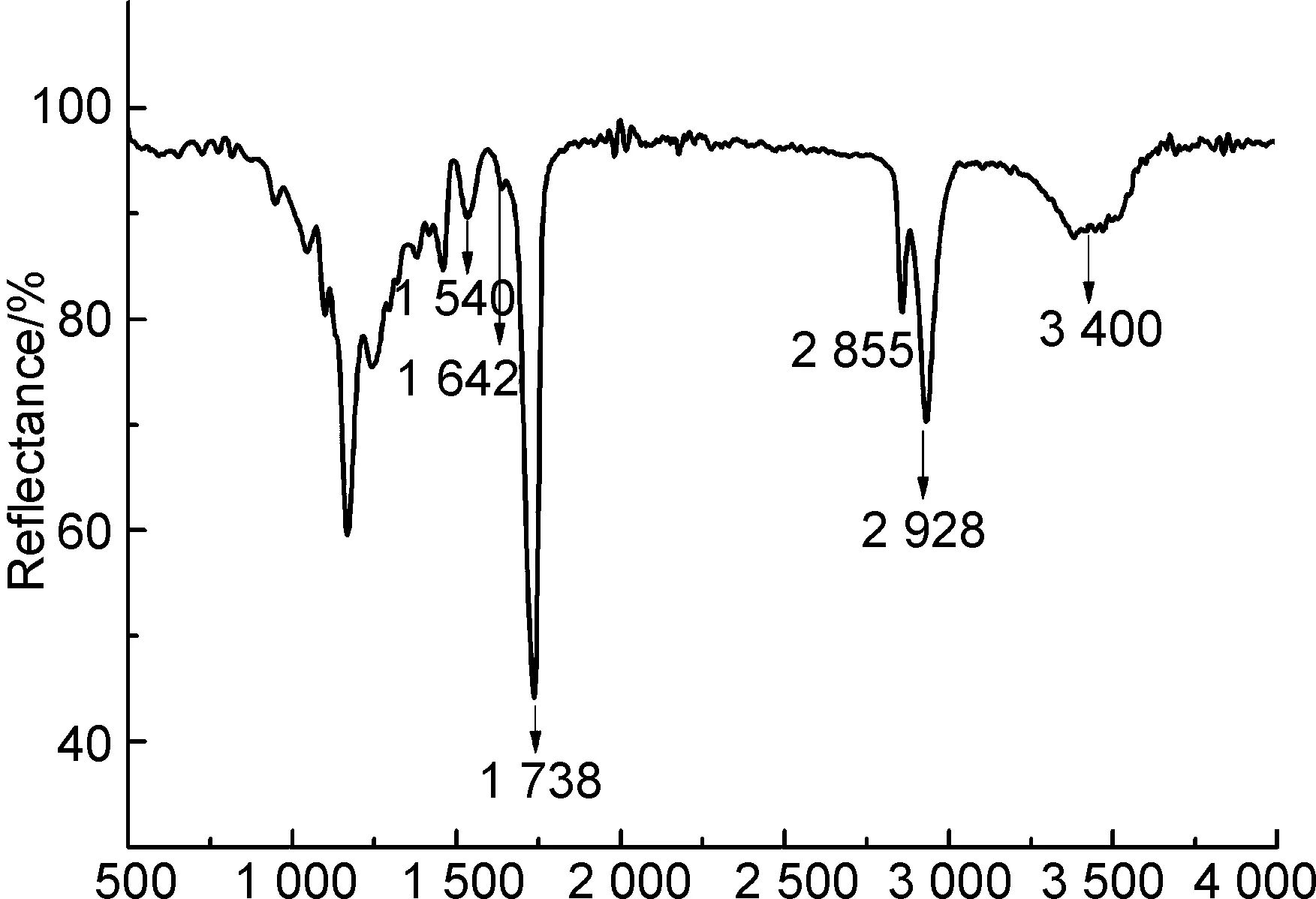
ν/cm-1
2.3 PGS-IM的熱學性能
PGS-IM的熱學性能通過TGA(圖3)和DSC(圖4)曲線表征。從圖3可以看出PGS-IM在200 ℃內無重量減少,說明它具有比較廣的溫度使用范圍。從圖4可以得出PGS-IM的玻璃化轉變溫度(Tg)為-30.6 ℃。在測試溫度范圍(-70~150 ℃)內沒有觀察到其熔融和結晶峰,說明在其使用的體溫附近,PGS-IM為玻璃化溫度之上的無定型狀態,具有一定的流動性,便于其涂覆在待粘接底物的表面。
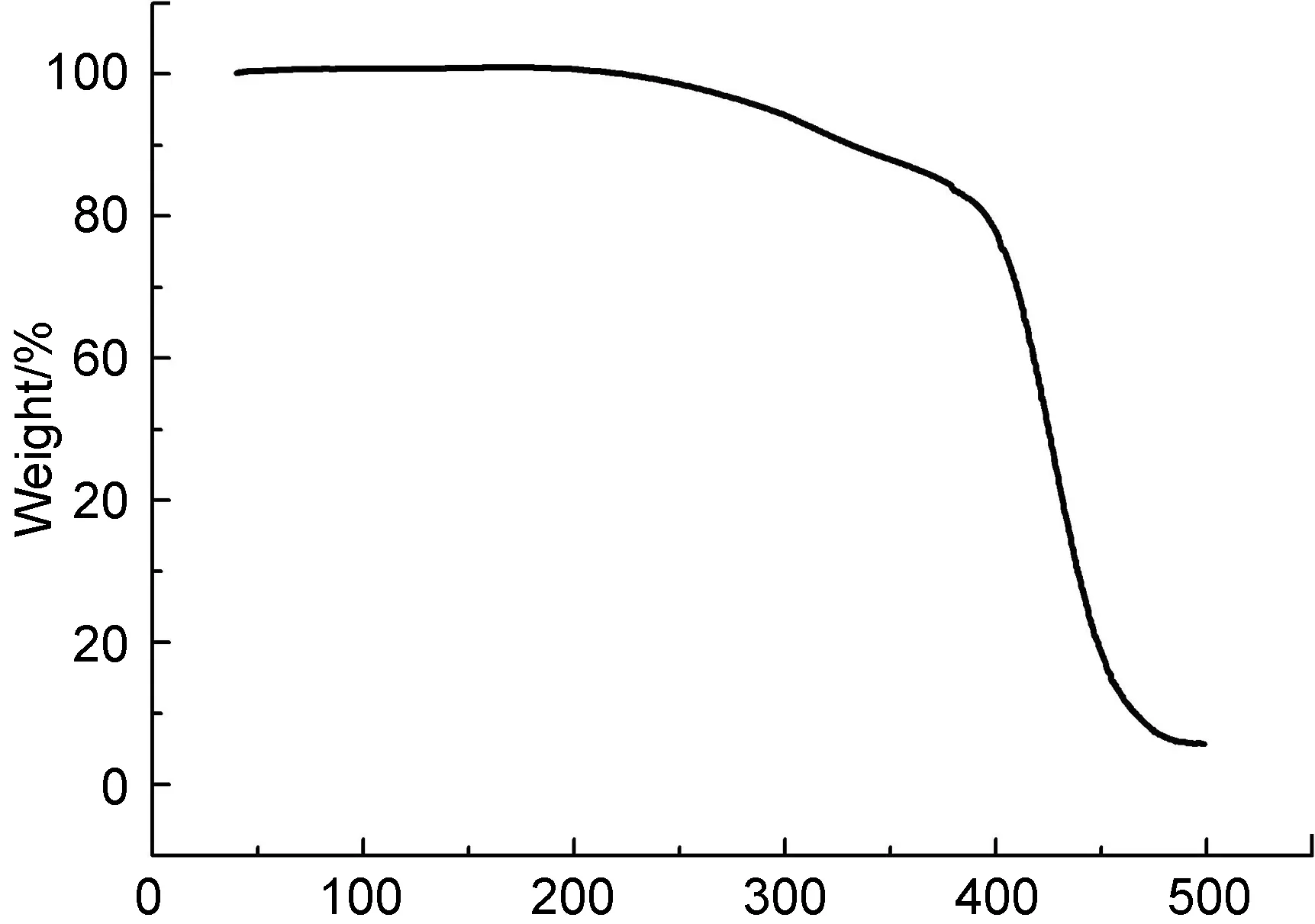
Temperature/℃
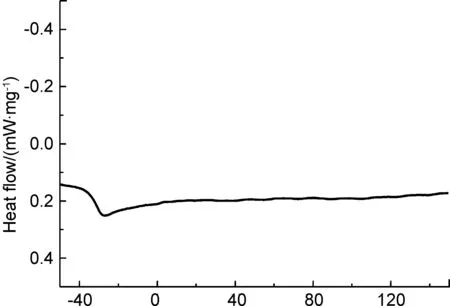
Temperature/℃
2.4 PGS-IM的粘結性能
選用玻璃板和PET板(常用的心臟補片材料)作為被粘接材料對PGS-IM的粘結性能進行了測試。首先用PGS-IM將兩塊測試的板材初步粘接到一起,然后用對組織基本無損傷的藍光對其進行原位即時固化。固化30 s后即達到較好的粘接性,兩塊被粘接的板材作為整體可以任意移動,不發生相對移位,而后對其抗剪切拉伸情況進行量化的測試,結果見圖5,其中圖5A和5B分別為粘接玻璃和PET板的測試結果。結果顯示藍光固化的PGS-IM粘合劑對二者均有較好的粘接性,對玻璃和PET板的粘結強度分別達到0.84±0.12 MPa和0.39±0.07 MPa。

Strain/%

Strain/%
2.5 PGS-IM的生物相容性測試
分別在普通玻片和含有藍光固化PGS-IM涂層的細胞爬片上培養RAECs。培養兩天后,用倒置相差顯微鏡觀察兩組細胞的生長情況(圖6)。從圖中可以看出大鼠主動脈內皮細胞在藍光固化的PGS-IM膠層上生長良好,在涂層及其放置的細胞培養皿上看不出明顯的差異(圖6B)。總體生長情況和無涂層的對照組(圖6A)相當。說明PGS-IM具有良好的細胞相容性。

圖6 大鼠胸主動脈內皮細胞(RAECs)培養2 d后的倒置相差顯微鏡圖像:(A)普通玻片細胞爬片的對照組,(B)涂有藍光固化PGS-IM涂層的細胞爬片*
設計并合成了一種新型的可降解藍光固化醫用粘接劑聚癸二酸甘油酯接枝甲基丙烯酸(2-異氰基乙基)酯(PGS-IM)。PGS-IM常溫下為粘稠的半固體,施膠方便,可藍光固化,對組織無損傷,固化迅速,固化后粘結性能良好。RAECs培養實驗證實其具有良好的生物相容性。綜上我們預期PGS-IM有望發展成為有效的醫用粘結劑。
[1] Mizrahi B, Stefanescu C F, Yang C,etal. Elasticity and safety of alkoxyethyl cyanoacrylate tissue adhesives[J].Acta Biomater,2011,7(8):3150-3157.
[2] Duarte A P, Coelho J F, Bordado J C,etal. Surgical adhesives:Systematic review of the main types and development forecast[J].Prog Polym Sci,2012,37(8):1031-1050.
[3] Strehin I, Nahas Z, Arora K,etal. A versatile pH sensitive chondroitin sulfate-PEG tissue adhesive and hydrogel[J].Biomaterials,2010,31(10):2788-2797.
[4] Lih E, Lee J S, Park K M,etal. Rapidly curable chitosan-PEG hydrogels as tissue adhesives for hemostasis and wound healing[J].Acta Biomater,2012,8(9):3261-3269.
[5] Jeong J H, Hong S W, Hong S,etal. Surface camouflage of pancreatic islets using 6-arm-PEG-catechol in combined therapy with tacrolimus and anti-CD154 monoclonal antibody for xenotransplantation[J].Biomaterials,2011,32(31):7961-7970.
[6] Rafat M, Li F F, Fagerholm P,etal. PEG-stabilized carbodiimide crosslinked collagen-chitosan hydrogels for corneal tissue engineering[J].Biomaterials,2008,29(29):3960-3972.
[7] Nakayama Y, Okuda K, Takamizawa K,etal. Preparation of well-defined poly(ether-ester) macromers:Photogelation and biodegradability[J].Acta Biomater,2011,7(4):1496-1503.
[8] Matteini P, Ratto F, Rossi F,etal. Emerging concepts of laser-activated nanoparticles for tissue bonding[J].J Biomed Opt,2012,17(1):010701-1-010701-9.
[9] Lauto A, Foster L J R, Ferris L,etal. Albumin-genipin solder for laser tissue repair[J].Laser Surg Med,2004,35(2):140-145.
[10] O’neill A C, Winograd J M, Zeballos J L,etal. Microvascular anastomosis using a photochemical tissue bonding technique[J].Laser Surg Med,2007,39(9):716-722.
[11] Hoogeboom J E, Ranger W R, Leibold W C. Pneumostasis of experimental air leaks with a new photopolymerized synthetic tissue sealant-Discussion[J].Am Surgeon,1997,63(9):795-795.
[12] Elvin C M, Brownlee A G, Huson M G,etal. The development of photochemically crosslinked native fibrinogen as a rapidly formed and mechanically strong surgical tissue sealant[J].Biomaterials,2009,30(11):2059-2065.
[13] Spencer H T, Hsu J T, Mcdonald D R,etal. Intraoperative anaphylaxis to gelatin in topical hemostatic agents during anterior spinal fusion:A case report[J].Spine J,2012,12(8):E1-E6.
[14] Wang Y D, Ameer G A, Sheppard B J,etal. A tough biodegradable elastomer[J].Nat Biotechnol,2002,20(6):602-606.
[15] Rai R, Tallawi M, Grigore A,etal. Synthesis,properties and biomedical applications of poly(glycerol sebacate)(PGS):A review[J].Prog Polym Sci,2012,37(8):1051-1078.
[16] Lang N, Pereira M J, Lee Y,etal. A blood-resistant surgical glue for minimally invasive repair of vessels and heart defects[J].Sci Transl Med,2014,6(218):218-216.
[17] Pomerantseva I, Krebs N, Hart A,etal. Degradation behavior of poly(glycerol sebacate)[J].Journal of Biomedical Materials Research Part A,2009,91A(4):1038-1047.
[18] Gao J, Crapo P M, Wang Y D. Macroporous elastomeric scaffolds with extensive micropores for soft tissue engineering[J].Tissue Eng,2006,12(4):917-925.
[19] Wu X H, Li L. Rosiglitazone suppresses lipopolysaccharide-induced matrix metalloproteinase-2 activity in rat aortic endothelial cellsviaRas-MEK1/2 signaling[J].Int J Cardiol,2012,158(1):54-58.
[20] Mcguire P G, Orkin R W. Isolation of rat aortic endothelial-cells by primary explant techniques and their phenotypic modulation by defined substrata[J].Lab Invest,1987,57(1):94-105.
Synthesis and Properties Research of A Novel Biodegradable Blue Light-crosslinkable Medical Adhesive
WANG Min1, GONG Wen-hui2, HUANG Peng1,LI Sen2, YE Xiao-feng2*, YOU Zheng-wei1*
(1. State Key Laboratory for Modification of Chemical Fibers and Polymer Materials, College of Materials Science and Engineering, Donghua University, Shanghai 201620, China; 2. Department of Cardiac Surgery,Ruijin Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200025, China)
Suturing is an important tissue closure technique. However it is time-cosuming, induces additional damage and scars on the tissue. Medical adhesive can overcome these disadvantages and have emerged as a promising alternative to suture. Here, we designed a new biodegradable medical adhesive. Poly(sebacic glycerides) grafted 2-isocyanateoethyl methacrylate(PGS-IM) based on PGS and 2-isocyanateoethyl methacrylate was synthesized by polyaddition. The structure and properties were characterized by1H NMR, ATR-FTIR, TGA, and DSC. Its adhesive properties on glass and poly(ethylene terephthalate) plates after blue light induced crosslinking were tested. Furthermore, its cytocompatiblity was evaluated by the culture of rat aortic endothelial cells. The results revealed that the glass-transition temperature(Tg) of PGS-IM was -30.6 ℃. The adhesive strength were 0.84±0.12 MPa(glass pane) and 0.39±0.07 MPa(PET pane), respectively, and PGS-IM was a biocompatible material.
poly(sebacic glycerides); 2-isocyanateoethyl methacrylate; graft; medical adhesive; synthesis; photo-crosslinking; blue light; biocompatibility
2016-12-22;
2017-05-24
國家自然科學基金資助項目(21574019, 81571826); 中央高校基本科研業務費專項資金資助項目(2232014A3-01);“東華大學"勵志計劃"(B201303); 上海交通大學醫學院臨床潛力學科(瑞金心臟外科)基金資助項目
王敏(1993-),女,漢族,河南鹿邑人,碩士研究生,主要從事醫用高分子材料的合成研究。 E-mail: 735248450@qq.com
游正偉,教授,博士生導師, E-mail: zyou@dhu.edu.cn; 葉曉峰,副主任醫師,碩士生導師, E-mail: xiaofengye@hotmail.com
O63
A
10.15952/j.cnki.cjsc.1005-1511.2017.07.16320

