scFv-RBP4融合蛋白的構建
李紅俠,劉崇東,曹廣明,婁 彤,張震宇*
(1.民航總醫院 婦產科,北京100123;2.首都醫科大學附屬北京朝陽醫院 婦產科,北京100020)
scFv-RBP4融合蛋白的構建
李紅俠1,劉崇東2,曹廣明2,婁 彤2,張震宇2*
(1.民航總醫院 婦產科,北京100123;2.首都醫科大學附屬北京朝陽醫院 婦產科,北京100020)
目的 構建scFv-RBP4融合蛋白。方法 采用德泰生物最新開發的密碼子優化軟件MaxCodonTM Optimization Program (V13)對提供的scFv- RBP4蛋白氨基酸序列進行優化,設計全長拼接引物,通過雙酶切法將scFv- RBP4基因插入到表達載體proEM中,并通過酶切法和測序確認最終表達載體的準確性,最終轉到DH5a克隆菌株中,通過質粒大抽試劑盒提取轉染級質粒,之后將質粒通過轉染試劑轉染到哺乳動物細胞HEK293T中進行瞬時表達,再通過Ni-IDA親和層析純化scFv- RBP4蛋白。結果 酶切和測序結果顯示,scFv-RBP4蛋白構建正確,目標蛋白純度>90%。結論 構建的scFv-RBP4融合蛋白可以在HEK293T細胞內獲得穩定表達,為后期融合蛋白的提取及功能研究打下基礎。
RBP4;融合蛋白;scFv;HEK293T;構建
(ChinJLabDiagn,2017,21:1082)
子癇前期(preeclampsia,PE)是一種妊娠相關的疾病,通常因妊娠20周后出現高血壓及蛋白尿等癥狀,占妊娠總數的3-8%[1]。臨床上處理子癇前期主要是終止妊娠和對癥處理,由于缺乏有效的預測手段和防治對策,使子癇前期成為孕產婦死亡的主要原因。其發病機制尚不十分明確,現在被廣泛接受的假說是具有侵襲性的絨毛外滋養細胞侵襲母體子宮內膜及肌層,并重塑子宮螺旋動脈,最終提供有效穩定的胎盤血流,在胎盤形成過程中,發揮至關重要的作用。因此,如果絨毛外滋養細胞侵襲不足,誘發螺旋動脈重塑失敗,最終可導致胎盤淺著床[2],引起子癇前期。人絨毛膜促性腺激素(human chorionic gonadotropin,hCG)是胎盤滋養細胞分泌的一種由α和β兩個亞基組成的糖蛋白激素,它為胚胎的子宮內著床和維持妊娠所必需。視黃醇結合蛋白-4(retinol-binding protein 4,RBP4)最初被認為是肝臟和脂肪組織分泌的一種維生素A的特異性轉運蛋白。近期大量研究提示其參與了肥胖和胰島素抵抗的發生發展,因此被認為是一種新的脂肪因子[3,4]。本課題前期研究中,利用蛋白質組學方法發現子癇前期發病機制中RBP4含量較正常孕婦低并存在明顯差異[5],并驗證了血清及胎盤組織中RBP4含量低于正常組[6],因此提出RBP4在子癇前期發病機制中可能起作用的假設。融合蛋白是通過重組DNA技術將兩個或多個不同蛋白結構域融為一個蛋白分子的一類蛋白的總稱,融合蛋白技術的目的主要是使不同蛋白功能協同作用從而擁有更好的性能、實現新的功能[7]。本研究通過制備RBP4與抗HCG抗體融合蛋白,以抗HCG抗體為介導,使RBP4靶向聚集于胎盤組織,提高胎盤局部RBP4濃度,為子癇前期的治療提供新的思路。
1 材料與方法
1.1 主要生化試劑和材料
表達載體proEM由系由德泰生物技術(南京)有限公司自主研發, 大腸桿菌Escherichia coli DH5a克隆菌株、HEK293T細胞來源于美國模式培養物集存庫(ATCC);質粒提抽試劑盒、DNA回收試劑盒(天根生化科技有限公司);T4 DNA連接酶、Taq DNA聚合酶(寶生物工程大連有限公司);酵母提取物、蛋白胨(OXOID)。
1.2 方法
1.2.1 scFv-RBP4融合蛋白的構建 從NCBI上獲得RBP4、anti-hCG scFv的序列,采用串聯融合方式,與德泰生物技術(南京)有限公司合作,進行全基因合成,利用密碼子優化軟件對序列進行優化,合成模板DNA,通過雙酶切法將RBP4/anti-hCG scFv基因插入到表達載體proEM中,并通過酶切法和測序確認最終表達載體的準確性。1.2.2 HEK293細胞的培養 轉染前2天將HEK293T細胞懸浮培養至1L,接種密度為4-5*105cells/ml,置于培養箱中110 rpm,37℃,5% CO2培養。
1.2.3 轉染級質粒抽提擴增 采用Qiagen的轉染級質粒抽提試劑盒,提取表達質粒并用1%瓊脂糖凝膠分析。
1.2.4 scFv- RBP4質粒轉染HEK293T細胞
將抽提后的scFv- RBP4質粒通過轉染試劑轉染到1L的HEK293T細胞中,置于培養箱中110 rpm,37℃,5% CO2培養;轉染當天使細胞密度控制在1.5-2.106cells/ml;將轉染緩沖液、PEI等試劑提前放入培養箱或水浴鍋37℃預熱(10-20 min);DNA-PEI混合物(質量比1∶5),向轉染緩沖液中加入DNA和PEI混勻,37℃,5%CO2培養;轉染后約4-6天,取出細胞培養物,離心,收集上清和細胞。
1.2.5 scFv- RBP4蛋白純化 取轉染培養6天后的細胞培養液離心,上清用0.22 μm膜過濾,在4℃環境下透析至緩沖液(25 mM Tris,150 mM NaCl,pH8.0)中,透析結束后再用Ni-IDA柱純化。經Ni-IDA親和層析純化,收集目標蛋白,并將其透析到1*PBS,10% Glycerol,pH7.4中,透析結束后用0.22 μm膜過濾,并分裝凍于-80℃。
1.2.6 scFv- RBP4蛋白穩定性測試(凍融實驗) 取一支分裝后凍于-80℃的scFv- RBP4蛋白,放置于冰水混合物中待其緩慢融化,融化后無異常現象,說明scFv- RBP4蛋白凍融實驗是正常的。
1.2.7 scFv- RBP4蛋白濃度測定 采用Bradford法測定蛋白濃度。用電子天平稱量1.0 g BSA溶于去離子水中,配成100 ml的原液,然后根據表2-1配置得到一組濃度為1.0 mg/ml、0.8 mg/ml、0.6 mg/ml、0.4 mg/ml、0.2 mg/ml的BSA溶液。另外量取1 ml的PBS溶液(BSA溶液濃度為0 mg/ml)作對照試驗。用移液槍分別移取50 μl配好的一組BSA溶液,滴加到96孔板中,另起一行加入同樣體積待測蛋白,再分別加入200 μl的考馬斯亮藍(CBB)。靜置10 min后,用酶標儀測得這組BSA溶液OD595 nm值。繪制標準曲線,計算蛋白濃度。
1.2.8 scFv- RBP4蛋白SDS-PAGE及WB檢測
SDS-PAGE及Western Blot免疫印記檢測scFv-RBP4蛋白表達 細胞貼壁長滿瓶底后收集細胞,用細胞裂解液(RIPA)加蛋白酶抑制劑裂解細胞后提取總蛋白,采用BCA 法測定蛋白含量。稀釋蛋白樣品為3 μg,加入上樣緩沖液后煮沸10 min 后離心,進行10 % SDS-PAGE 凝膠電泳。電泳后將凝膠放于一潔凈的玻璃容器中加入5倍于凝膠體積的考馬斯亮藍,室溫下孵育1 h,排干液體,搖動考馬斯亮藍G-250染液,使大顆粒膠體分散,加至凝膠內。室溫下振搖溫育過夜,用水清洗凝膠并觀察脫色效果。電泳后電轉至NC膜上,PBS封閉緩沖液封閉2 h 后滴加一抗scFv-RBP4(1∶1 000)。4 ℃孵育過夜,二抗孵育2 h,PBST 洗膜4次,每次5 min后,置于ECL化學發光試劑中反應1-3 min顯影。ChemiDoc XRS 化學發光成像系統檢測蛋白印記條帶,Quantity One 圖像分析軟件進行分析。
2 結果
RBP4融合蛋白全長453個氨基酸,目標序列:VL+VH+RBP4scFv- RBP4 protein Length=453 MW=50242.7 Predicted I=6.581 DIVMSQSPSS LAVSVGEKVT MTCKSSQSLL YSSNQMNYLA WYQQKPGQSP KLLIYWASTR61 ESGVPDRFTG SGSGTDFTLT ISSVEAEDLA VYYCQQYHSY PFTFGSGTKL EIKRGGGGSG 121 GGGSGGGGSE VNLEESGGGL VQPGGSMKLS CVASGFTFSN YWMNWVRQSP EKGLEWVADI181 RLKSNNYATL YAESVKGRFT ISRDDSKSSV YLQMNNLRAE DTGIYYCTRG AYYRYDYAMD241 YWGQGTSVTV SSGGGGSGGG GSERDCRVSS FRVKENFDKA RFSGTWYAMA KKDPEGLFLQ 301 DNIVAEFSVD ETGQMSATAK GRVRLLNNWD VCADMVGTFT DTEDPAKFKM KYWGVASFLQ361 KGNDDHWIVD TDYDTYAVQY SCRLLNLDGT CADSYSFVFS RDPNGLPPEA QKIVRQRQEE421 LCLARQYRLI VHNGYCDGRS ERNLLHHHHH HHH
2.1 轉染級質粒擴增抽提結果
表達質粒雙酶切后用1%瓊脂糖凝膠分析。電泳結果顯示目的條帶位置正確,見圖1。
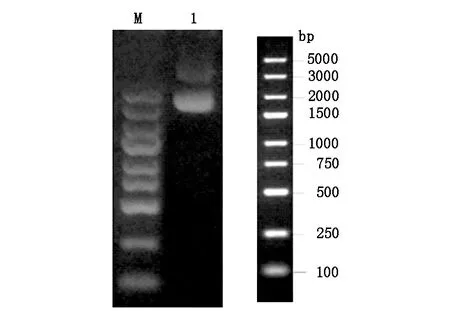
Lane M:DNA marker Lane 1:轉染級質粒圖1 瓊脂糖凝膠分析scFv- RBP4抽提質粒
2.2 scFv- RBP4蛋白純化結果
目標蛋白scFv- RBP4主要存在于洗脫組分Lane 5-7中,目的條帶位于40-60 kD之間,分子量大約為50 kD,見圖2。
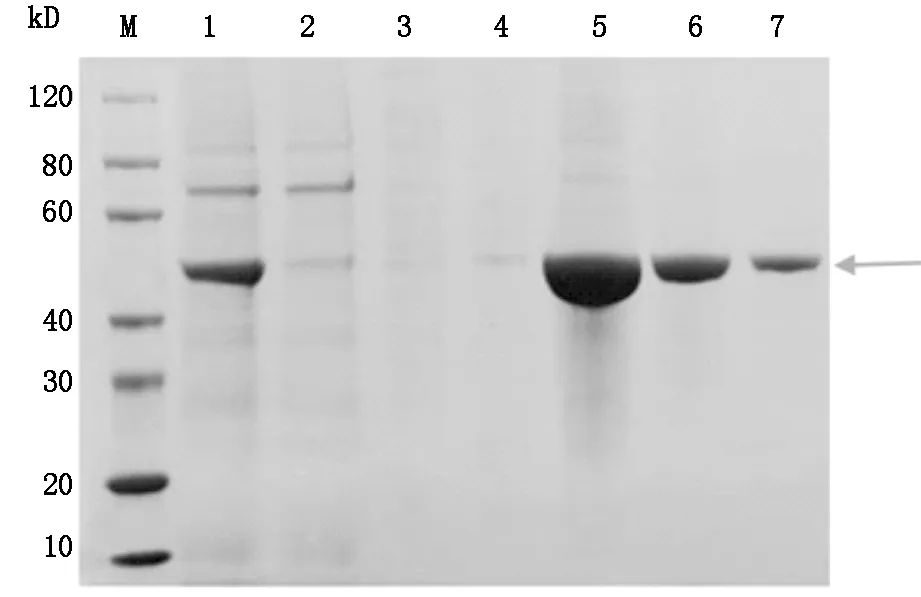
Lane M:SDS-PAGE Protein marker Lane 1:離心后上清 Lane 2:上清同Ni-IDA孵育后流出液 Lane 3-4:30 mM Imidazole洗脫組分 Lane 5-7:300 mM Imidazole洗脫組分
圖2 SDS-PAGE 分析scFv- RBP4蛋白純化
2.3 蛋白濃度測定 應用BSA做標準品,采用Bradford法測定蛋白濃度,最終濃度為1.04 mg/ml。蛋白純度>90%,評估來源于R250染色的SDS-PAGE膠。
2.4 scFv-RBP4蛋白、SDS-PAGE及WB檢測結果 SDS-PAGE蛋白測定:用考馬斯亮監對SDS-PAGE膠進行染色,結果顯示,純化得到的scFv-RBP融合蛋白純度高,分子量為40-60 kD之間。對scFv-RBP4融合蛋白進行Western Blot定性驗證:一抗為兔抗人RBP4單抗(Abcam,1∶50);二抗為辣根過氧化物酶標記的山羊抗兔二抗(Abcam,1∶2000),曝光后的條帶位于40-60 kD之間。
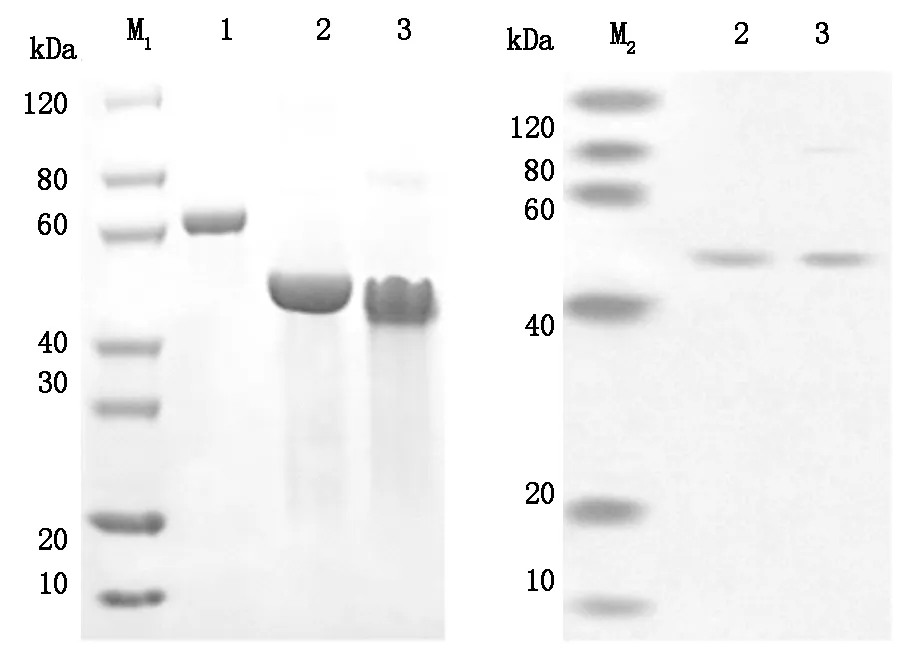
Lane 1:BSA (1.0 μg) Lane 2:scFv-RBP4 protein(3.0 μg) (Reduced) Lane 3:scFv-RBP4 protein(3.0 μg) (Non-Reduced) M1:SDS-PAGE Marker M2:Western Blot Marker Using Anti-His tag antibody
圖3 SCFv-RBP4蛋白,SDS-PAGE及WB檢測結果
3 討論
正常妊娠過程中,在胎盤發育的早期階段,絨毛外滋養細胞向母體蛻膜和子宮肌層侵襲遷移。部分絨毛外滋養細胞侵入母體子宮螺旋動脈內并替代血管壁中的內皮細胞,將高阻低容性的子宮螺旋動脈轉化成為高容低阻性的子宮胎盤血管,完成子宮螺旋動脈重鑄過程,使子宮螺旋動脈容受性增加,增加胎盤的血流灌注。有研究表明子癇前期患者絨毛外滋養細胞向母體蛻膜和子宮肌層的侵襲很淺,而且范圍非常局限,幾乎沒有血管內絨毛滋養細胞的侵襲[8]。因此,滋養細胞侵襲能力下降是子癇前期發生的關鍵因素。
單鏈抗體(single chain fragment,scFv)是利用基因工程技術將免疫球蛋白的重鏈可變區和輕鏈可變區通過一段肽鏈連接成重組蛋白而得到的,具有完全抗原結合位點的微小抗體片段,其免疫原性較小,能在細菌中表達,易于基因操作和基因工程大量生產,并可用基因工程方法構建與其他效應分子鏈接的融合蛋白,因此,在疾病治療方面有著廣泛的應用前景。scFv對腫瘤組織的穿透力強,可以與其他效應分子連接成抗腫瘤融合蛋白,是保護抗體親和性和特異性的最小功能性抗體片段[9]。
RBP4屬于RBP家族,RBP是在體內負責結合并轉運維生素A(ⅥtA)視黃醇類活性代謝物的一類蛋白質[10,11],RBP4分子質量21 000 ku[12],主要由肝細胞合成,其次為脂肪組織。RBP4廣泛分布于人體血液、腦脊液、尿液及其他體液中[13]。以往,人們僅認識到,RBP4功能障礙會導致VitA儲存、轉運、分布及代謝異常,進而引發各種疾病,并影響上皮和骨組織的生長、分化、繁殖與胚胎發育。但在2005年美國哈佛大學醫學院Yang等[14]利用基因芯片技術比較脂肪組織的基因表達譜,提出RBP4是一種新的脂肪因子,與糖代謝的調節及胰島素抵抗有重要關系。
目前,scFv融合蛋白的最主要的臨床應用是免疫導向。scFv減少了抗體的非特異性結合而更集中到達腫瘤等部位,因為被視為導向藥物的理想載體,目前已經廣泛應用于腫瘤細胞、血栓溶解等臨床疾病的治療中。對于RBP4在針對子癇前期發病機制,提高滋養細胞浸潤能力,改善胎盤淺著床,進而有可能達到疾病治療目地相關研究目前鮮有報道。本研究成功在體外人工構建RBP4和anti-HCG scFv融合蛋白,融合蛋白兩個結構各自獨立,RBP4功能不受anti-HCG scFv結構域影響,進而可以靶向作用于胎盤組織,提高胎盤局部的RBP4水平,增加滋養細胞的侵襲性。
融合蛋白技術尚未在產科領域體現其優勢,因此我們需要更進一步的研究,為子癇前期的治療開辟新的方法。
[1]Poon LC,Nicolaides KH.Early prediction of preeclampsia[J].Obstetrics and gynecology international,2014,2014:297.
[2]Damsky CH,Fisher SJ.Trophoblastpseudo vasculogenesis:fakingitwithendothelialadhesionreceptors[J].Cxirr Opin Cell Biol,1998,10(5):660.
[3]Christou GA,Tselepis AD,Kiortsis DN.The metabolic role of retinol binding protein 4:an update [J].HormMetab Res,2012,44:6.
[4]Kotnik P,Fischer-Posovszky P,Wabitsch M.RBP4:a controversial adipokine[J].Eur J Endocrinol,2011,165:703.
[5]Liu C,Zhang N,Yu H,et al.Proteomic analysis of human serum for finding pathogenic factors and potential biomarkers in preeclampsia[J].Placenta,2011,32:168.
[6]Lu Q,Liu C,Liu Y,et al.Serum markers of pre-eclampsia identified on proteomics[J].J Obstet Gynaecol Res,2016,42(9):1111.
[7]Gronwall C,Stahl S.Engineered affinity proteins-generation and applications[J].Journal of biotechnology,2009,140(3-4):254.
[8]North R A,Ferrier C,Long D,et al.Uterine artery Doppler flow velocity waveforms in the second trimester for the prediction of preeclampsia and fetal growth retardation[J].Obstet Gynecol,1994,83(3):378.
[9]Laginha KM,Moase EH,Yu N,et al.Bioavailability and therapeutic efficacy of HER2 scFv-targeted liposomal doxorubicin in a murine model of HER2 overexpressing breast cancer[J].J Drug Target,2015,16(7):605.
[10]Newcomer ME,Ong DE.Plasma retinol binding protein:structure and function of the prototypic lipocalin[J].BiochimBiophysActa,2000,1482(1-2):57.
[11]Zanotti G, Bemi R.Plasma retinol-binding protein:structure and interactions with retinol,retinoids,and transthyretin[J].Vitam Horm,2004,69:271.
[12]Craig RL,Chu WS,Elbein SC.Retinol binding protein 4 as a candidate gene for type 2 diabetes and prediabetic intermediate traits[J].Mol Genet Metab,2007,90(3):338.
[13]Meigs JB,Panhuysen CI,Myers RH,et al.A genome wide scan for loci linked to plasma levels of glycose and HBA1c in a community-based sample of Caucasian pedigrees:The Framingham offspring Study [J].Diabetes Care,2002,25(10):1845.
[14]Yang Q,Graham TE,Mody M,et al.Serum retinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes.[J].Nature,2005,436(7049):356.
Construction of Fusion Protein of Single Chain Variable Fragment and RBP4
LIHong-xia1,LIUChong-dong2,CAOGuang-ming2,etal.
(1.DepartmentofGynecologyandObsterics,CivilAviationGeneralHospital,Beijing100123,China;2.DepartmentofGynecologyandObsterics,BeijingChaoyangHospitalofCapitalMedicalUniversity,Beijing100020,China)
Objective Construction of fusion protein of single chain variable fragment and RBP4.Methods MaxCodonTM Optimization Program (V13) was used to optimize the amino acid sequence of scFv-RBP4 protein,and the full-length splice primers were designed by Detai Bio.The scFv-RBP4 gene was inserted into the expression vector proEM by double digestion,and the accuracy of the final expression vector was confirmed by restriction enzyme digestion and sequencing.The plasmid was transfected into DH5a clone strain and the plasmid was extracted from themammalian cell HEK293T by transfection reagent.The plasmid was purified by Ni-IDA affinity chromatography.The scFv-RBP4 was purified by Ni-IDA affinity chromatography.Results The results of digestion and sequencing showed that the scFv-RBP4 protein was constructed correctly and the purity of the target protein was> 90%.Conclusion The scFv-RBP4 fusion protein can be expressed stably in HEK293T cells,which will be the foundation for the extraction and functional study of late fusion proteins.
RBP4;fusion protein;scFv;HEK293T;construction
國家自然科學基金面上項目(81571455)
*通訊作者
1007-4287(2017)06-1082-04
R714.2
A
2016-11-28)

