兒童急性橫貫性脊髓炎患兒腦脊液中miR—182—5p上調促進CREB蛋白表達的實驗研究
王志杰+郭曉玲+劉海英+王天儀+李煥龍+張錚+周搏+門秀麗


【摘要】 目的 從微小RNA(microRNA)組學角度探索兒童急性橫貫性脊髓炎(ATM)發生的分子生物學機制, 以期尋找關鍵治療靶點。方法 使用microarray4.0芯片檢測兒童急性橫貫性脊髓炎患兒腦脊液中發生改變的microRNA, 運用生物信息學方法論證發揮關鍵調控作用的microRNA, 進行靶基因預測。運用反轉錄熒光定量聚合酶鏈式反應(RT-qPCR)技術進行生物學與技術重復。檢測關鍵microRNA靶蛋白的表達量并分析樣本間靶蛋白與目標microRNA表達變化趨勢相關性。結果 急性橫貫性脊髓炎患兒腦脊液樣本中共有247個microRNA發生表達變化, microRNA-182-5p(miR-182-5p)特征性上調明顯。生物信息分析結果顯示cAMP 應答元件結合蛋白 (CREB)可為miR-182-5p的靶基因, 與miR-182-5p趨勢相反。結論 兒童急性橫貫性脊髓炎腦脊液中miR-182-5p上調導致CREB下調, 使神經元軸突生長能力下降。miR-182-5p是兒童急性橫貫性脊髓炎治療的關鍵靶點之一。
【關鍵詞】 兒童急性橫貫性脊髓炎;腦脊液;微小RNA;cAMP 應答元件結合蛋白 ;治療靶點
DOI:10.14163/j.cnki.11-5547/r.2017.16.029
急性橫貫性脊髓炎(acute transverse myelitis, ATM)屬于橫貫性脊髓炎(transverse myelitis, TM)疾病的炎癥亞型。在急性期與亞急性期可以損傷脊髓產生臨床癥狀, 進而導致神經傳導功能的缺陷。至今為止絕大部分急性橫貫性脊髓炎患兒的發病機制依然難以明確, 兒童時期是急性橫貫性脊髓炎患兒發病率較高的兩個階段之一。cAMP 應答元件結合蛋白 (cAMP response element binding protein, CREB)與學習記憶、神經退行性疾病以及促進神經細胞分化、維持突觸功能和促進再生有關[1-3]。有學者報道, 神經細胞中CREB的表達能克服髓磷脂抑制促進損傷的脊髓后索再生[4-6]。本研究首先應用microarray方法在microRNA組學(miRNomes)角度觀察急性橫貫性脊髓炎樣本中microRNA的表達改變, 進而尋找關鍵microRNA以及它的靶基因、靶蛋白。
1 材料與方法
1. 1 樣本采集 本研究收錄承德醫學院附屬醫院、中國人民解放軍第二六六醫院2016年1~9月診斷為急性橫貫性脊髓炎的4例患兒, 家屬簽署知情同意書后, 取腦脊液樣本隨機編號為T1~T4凍存。對照組腦脊液樣本來自臨床懷疑相關疾病, 經腦脊液等相關檢查排除疾病, 腦脊液為正常者3例患兒, 家屬簽署知情同意書后, 取腦脊液樣本凍存。
納入標準:①ATM組:按照TMCWG診斷標準(橫貫性脊髓炎聯盟工作組織于2002年提出的公共診斷標準)診斷為ATM者, 且無其他疾病。②對照組:臨床懷疑相關疾病, 經腦脊液等相關檢查排除疾病, 腦脊液為正常者。
排除標準:有遺傳性疾病家族史者;近期曾患感染性疾病者;營養不良、生長發育狀態欠佳者;有結核病史者。
1. 2 總RNA抽提 采用mirVanaTM PARISTM Kit試劑盒(Ambion, 美國)按照說明書操作, 具體如下:每例樣本采集腦脊液2 ml, 迅速轉入抗凝管中用移液器混勻。在1 h內(室溫條件下)進行下面的操作:820 g, 4℃, 離心10 min。吸取1 ml上清轉至干凈的1.5 ml離心管中, 16000 g, 4℃, 離心10 min。小心吸取上清到新的離心管中, 置于-80℃保存備用。取適量的樣本400 ?l, 加入等量的2×Denaturing Solution, 渦旋混勻, 冰上放置5 min。加入等體積的氯仿, 渦旋混勻30~60 s, 室溫, 最高轉速離心5 min。小心吸取上清到新的1.5 ml離心管中, 添加1.25倍體積的無水乙醇, 渦旋混勻。轉移至柱子中(最大體積700 ?l),13000 g, 離心30 s。加入350 ?l microRNA Wash Solution 1到離心柱中, 13000 g, 室溫離心15 s, 棄流過液, 將離心柱重新放置到收集管中。混合10 ?l DNase I和 70 ?l Buffer RDD QIAGEN總體積80 ?l, 加到離心柱中的膜上, 室溫放置15 min。加入350 ?l microRNA Wash Solution 1到離心柱中, 13000 g, 室溫離心15 s, 棄流過液, 將離心柱重新放置到收集管中。加入500 ?l Wash Solution 2/3過柱2次, 空柱離心1 min。將離心柱放置到新的收集管中, 柱中心加100 ?l 95℃預熱的Elution Solution, 室溫最高轉速離心20~30 s, 收集管中的液體即為提取的Total RNA, 放置在-70℃保存。
1. 3 microRNA表達譜的數據分析 本實驗應用microRNA 4.0芯片(Affymetrix, 美國)。利用NanoDrop ND-2100(Thermo Scientific, 美國)定量總RNA并用Agilent 2100(Agilent, 美國)檢測RNA完整性。質檢合格后, 參照芯片標準流程進行樣本的標記、芯片的雜交以及洗脫。利用Affymetrix Scanner 3000(Affymetrix, 美國)掃描得到原始圖像。應用Expression Console version1.3.1(Affymetrix, 美國)數據分析軟件分析圖像, 將所得原始數據轉化為RMA標準化算法信號值, 并應用分層聚類分析的方法對樣本間microRNA表達模式進行分析。
1. 4 RT-qPCR 利用miScript II Reverse Transcription Kit (Qiagen, 德國) 和PrimerScript RT reagent Kit (TaKaRa, 日本)分別進行microRNA和mRNA的檢測。分別用U6 和 GADPH對所得的microRNA和mRNA表達量進行標準化。
1. 5 酶聯免疫吸附測定(ELISA) 采用美國R&D System公司生產的試劑盒進行檢測, 所有操作嚴格按照說明書進行。
2 結果
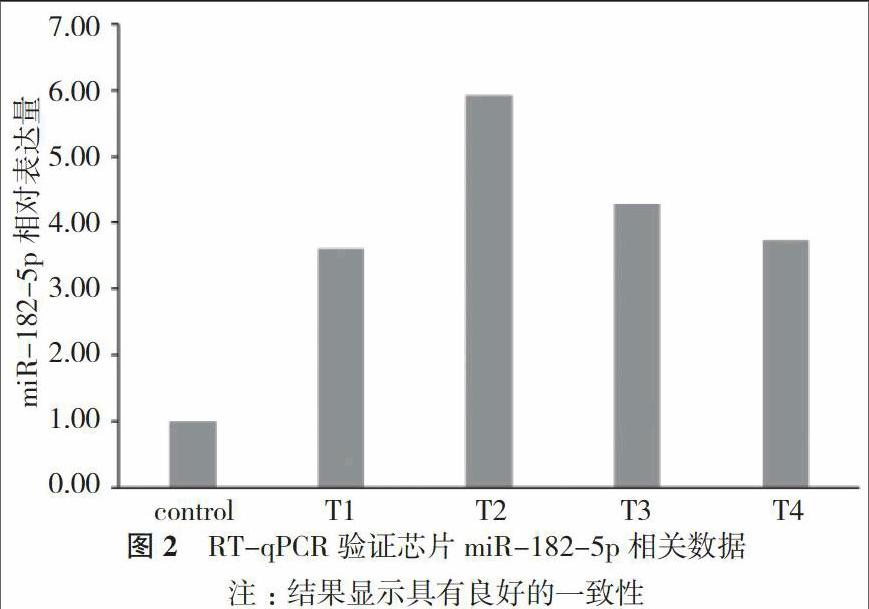
2. 1 兒童急性橫貫性脊髓炎microRNA表達譜分析 芯片結果顯示, 與對照組相比急性橫貫性脊髓炎樣本中共有247個microRNA發生表達變化(見圖1)。其中miR-182-5p在各樣本中明顯上調, 與對照組相比分別上調3.61、5.93、4.28及3.74倍, 這4個上調倍數在各樣本上調倍數排序中分別位于第5、4、7、6位。這就使得miR-182-5p初步納入研究者的視線。用RT-qPCR驗證芯片miR-182-5p相關數據, 結果顯示具有良好的一致性(見圖2)。
2. 2 靶基因預測 為了進一步研究miR-182-5p表達變化的意義, 本研究應用Target Scan數據庫預測miR-182-5p的靶基因, 并查詢相關文獻發現其靶基因可為CREB(見表1)。
2. 3 CREB蛋白的表達量與變化趨勢 用ELISA檢測各樣本CREB蛋白的表達量(見表2), 比較發現CREB蛋白與miR-182-5p的表達趨勢相反(見圖3)。進一步說明了CREB是miR-182-5p的靶基因。
3 討論
miR-182-5p上調是影響急性橫貫性脊髓炎臨床特點的重要因素之一;miR-182-5p通過調節其靶基因CREB從而進一步影響神經元軸突的生長。急性橫貫性脊髓炎樣本中, 至少發生一次改變的microRNA一共有247個, 經KEGG數據庫生物信息分析這些microRNA涉及多條細胞信號轉導通路[7-9]。miR-182-5p只是諸多發揮調控作用的重要microRNA之一。本團隊期待在未來實驗中可以進一步探索其他關鍵調控microRNA以期更客觀、全面、深入探究急性橫貫性脊髓炎發病機理, 為臨床應用找到更多且更加有效的治療靶點。
參考文獻
[1] Sung JY, Shin SW, Ahn YS, et al. Basic fibroblast growth factor-induced activation of novel CREB kinase during the differentiation of immortalized hippocampal cells. Journal of Biological Chemistry, 2001, 276(17):13858-13866.
[2] Kandel ER. The molecular biology of memory: cAMP, PKA, CRE, CREB-1, CREB-2, and CPEB. Molecular Brain, 2012, 5(1):14.
[3] Scott BR. Cyclic AMP response element-binding protein (CREB) phosphorylation: a mechanistic marker in the development of memory enhancing Alzheimer's disease therapeutics. Biochemical Pharmacology, 2012, 83(6):705-714.
[4] Gao Y, Deng K, Hou J, et al. Activated CREB is sufficient to overcome inhibitors in myelin and promote spinal axon regeneration in vivo. Neuron, 2004, 44(4): 609-621.
[5] Yiu EM, Kornberg AJ, Ryan MM, et al. Acute transverse myelitis and acute disseminated encephalomyelitis in childhood: spectrum or separate entities? J Child Neurol, 2009, 24(3): 287-296.
[6] Dunne K, Hopkins IJ, Shield LK. Acute transverse myelopathy in childhood. Dev Med Child Neurol, 1986, 28(2):198-204.
[7] Young J, Quinn S, Hurrell M, et al. Clinically isolated acute transverse myelitis: prognostic features and incidence. Mult Scler, 2009, 15(11):1295-1302.
[8] Perumal J, Zabad R, Caon C, et al. Acute transverse myelitis with normal brain MRI : long-term risk of MS. J Neurol, 2008, 255(1): 89-93.
[9] Alvarenga MP, Thuler LC, Neto SP, et al. The clinical course of idiopathic acute transverse myelitis in patients from Rio de Janeiro. J Neurol, 2010, 257(6):992-998.

