利奈唑胺治療耐多藥肺結核臨床療效觀察
劉智 楊梁梓 傅佳鵬 劉志超 柯學 李劍 傅向東 李國保
利奈唑胺治療耐多藥肺結核臨床療效觀察
劉智 楊梁梓 傅佳鵬 劉志超 柯學 李劍 傅向東 李國保
目的 觀察利奈唑胺在治療耐多藥肺結核(MDR-TB)的臨床療效和不良反應。方法 將46例耐多藥肺結核患者隨機分為治療組22例,對照組24例; 治療方案:治療組以利奈唑胺為主,聯合阿米卡星、吡嗪酰胺、丙硫異煙胺、乙胺丁醇、左氧氟沙星,對照組為阿米卡星、吡嗪酰胺、丙硫異煙胺、乙胺丁醇、左氧氟沙星,所有病例療程均為24個月。結果 至療程結束,治療組治療成功率94.7%,對照組為66.7%,兩組差異有統計學意義(P<0.05);治療組病灶吸收(顯吸+吸收)率為100%,對照組為71.4%,兩組差異有統計學意義(P<0.05);不良反應率治療組(78.95%)要高于對照組(33.33%),兩組差異有統計學意義(P<0.01)。結論 利奈唑胺用于治療耐多藥結核時痰菌轉陰率高,不良反應可控,不失為治療耐多藥結核的良藥,給廣大耐多藥患者帶來希望。
利奈唑胺;耐多藥肺結核;臨床療效;不良反應
據世界衛生組織2016年結核病報告估計,2015年全球估計有48萬新發的耐多藥結核病病例和10萬耐利福平結核病病例。2013年開始治療的耐多藥患者,全球平均成功治愈率僅為52%[1]。全球廣大醫務工作者們都在不停探索治療耐多藥結核病的新藥和新方案。有文獻報道[2-4],利奈唑胺(LZD)對支氣管肺泡組織具有良好的滲透性,在治療耐多藥結核和廣泛耐藥結核方面取得了一定的臨床效果。
現將2013年1月-2014年12月深圳市第三人民醫院結核科收治的46例耐多藥肺結核患者治療效果匯報如下。
資料與方法
一、入選標準
① 自愿參加本研究,并簽署知情同意書;② 年齡在18-65歲之間;③ 入選前2月內痰結核分枝桿菌培養陽性,藥敏試驗結果顯示耐多藥,且對左氧氟沙星及阿米卡星敏感,治療前1周內痰涂片找抗酸桿菌陽性;④ 非XDR-TB患者;⑤ 胸片檢查顯示有肺內結核病變;
二、排除標準
① 對研究藥物或其中任何成份有過敏史者,或不能組成有效方案者;② 目前有嚴重合并癥(如:呼吸衰竭、心功能不全等)或肝腎功能損害(血清肌酐水平、ALT和/或AST水平大于3倍參考值上限);③ 有嚴重心、腦血管疾病者;④ 妊娠期或哺乳期婦女;⑤ HIV抗體檢測陽性和艾滋病患者。
三、一般資料
按以上標準,選取深圳市第三人民醫院2012年1月-2014年12月收治的46例耐多藥肺結核患者,按隨機數字表法將患者隨機納入治療組和對照組。其中治療組22例,男性14例,女性8例,年齡18-61歲,平均(34.6±3.4)歲。對照組24例,男15例,女9例,年齡21-63歲,平均(36.8±4.5)歲。
四、治療方案
對照組: 3 Z Am Lfx Pto E/3 Z Am3Lfx Pto E/18 Z Lfx Pto E。治療組: 3 Z Am3Lfx Pto E LZD/3 Z Am3Lfx Pto E LZD/6Z Lfx Pto E LZD/12Z Lfx Pto E。說明:Z-吡嗪酰胺 Am-阿米卡星 Lfx-左氧氟沙星 Pto-丙硫異煙胺 E-乙胺丁醇,LZD-利奈唑胺,其中阿米卡星頭3個月每日注射,后三個月為隔日注射。利奈唑胺選用口服利奈唑胺片劑,劑量根據WHO推薦[5]為600mg/天,1天1次,如出現嚴重不良反應,則減量為300mg/天。根據文獻報道[6],利奈唑胺療程定為12個月。其余藥物,兩組患者均選用同一廠家生產的同一規格藥物,根據公斤體重計算用量。
五、觀察項目
1 療效監測: ①細菌學:對所有患者治療1月、2月、3月、6月、9月、12月、15月、18月、21月、24月時均進行痰涂片找抗酸桿菌及痰結核分枝桿菌培養檢查。治療6個月時,對痰菌尚未陰轉的患者復查藥敏試驗一次。②影像學:對所有患者治療1月、2月、3月、6月、9月、12月、15月、18月、21月、24月時行胸片或CT檢查。
2 安全性監測:①對全部患者每月至少進行1次血、尿常規(注射期)及肝、腎功能等生化指標的檢查;②對全部患者進行不良反應監測;③對應用丙硫異煙胺的患者定期監測TSH;④對使用注射劑期間的患者定期檢測聽力;⑤對使用乙胺丁醇的患者根據情況定期檢測視力、視野。
3 療效評價:本研究采用痰結核分枝桿菌培養和影像學檢查作為耐多藥結核病療效評價的方法和指標。(1) 根據文獻報道[7],將影像學判定標準分為:病灶顯吸:病灶吸收≥1/2原病灶;吸收:病灶吸收,但<1/2原病灶;不變:病灶無明顯變化;惡化:病灶擴大或播散;(2) 細菌學判定標準,根據世界衛生組織標準,分為治愈、完成治療、失敗、死亡、丟失、不能評價六個等級[8]:① 治愈:患者完成療程且無治療失敗的證據,且在強化期結束后連續3次或以上痰培養陰性,每次間隔至少30天。② 完成治療:患者完成療程且無治療失敗的證據,且在強化期結束后沒有證據顯示連續3次或以上痰培養陰性,每次間隔至少30天。③ 失敗:患者由于以下原因需要終止治療或永久性更改方案(更換2種以上藥物),包括強化期結束時痰菌不能陰轉、痰菌陰轉后在繼續期痰菌又復陽、發現氟喹諾酮類及注射類藥物耐藥的證據以及出現藥物不良反應。④ 死亡:患者在治療過程中由于任何原因所致的死亡 。⑤ 丟失:患者未治療或由于任何原因治療中斷連續2個月或以上。⑥ 不能評價:包括患者轉診到其他結防機構或不知其治療轉歸。⑦ 治療成功:包括治愈和完成治療。
4 統計學方法:兩組療效比較均采用χ2檢驗。
結 果
治療過程中,治療組有1例患者失訪,1例患者因嚴重不良反應退出觀察,對照組有3例患者失訪,完成全療程患者,治療組有19例,對照組有21例,均無死亡患者。
一、 兩組治療后痰菌陰轉情況
治療組的患者在治療1月、2月、3月、6月、9月、12月、15月、18月、21月、24月時痰結核分枝桿菌培養陰轉率均要高于治療同期的對照組患者,兩組差異有統計學意義(P<0.05)。(見表1)。
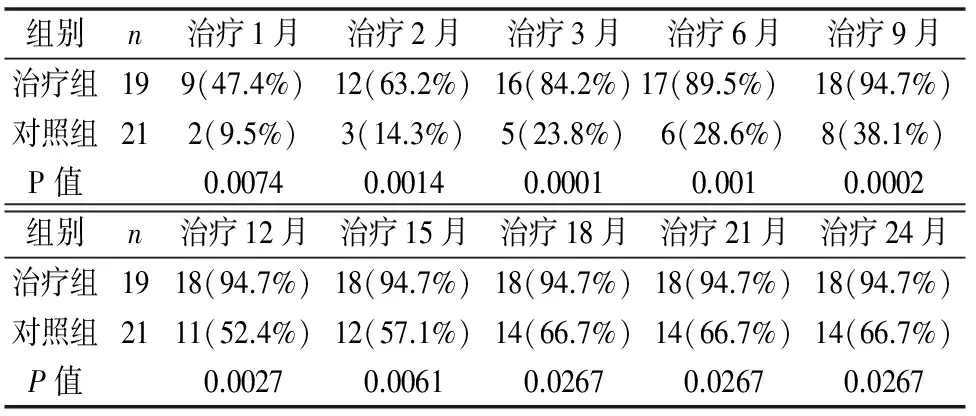
表1 兩組治療后痰菌陰轉情況
二、兩組治療后治療轉歸情況
療程結束后根據痰菌陰轉情況判定治療成功率(包括治愈和完成治療),治療組治療成功率94.7%,對照組為66.7%,兩組差異有統計學意義(P<0.05)。(見表2)。

表2 治療后兩組治療成功情況對比
注: χ2=4.9123,P=0.0267<0.05
三、兩組治療后病灶吸收情況
治療組的患者在治療1月、2月、3月、6月、9月、12月、15月、18月、21月、24月時的病灶吸收(顯吸+吸收)率均要高于治療同期的對照組患者,兩組差異有統計學意義(P小于0.05)。(見表3)。
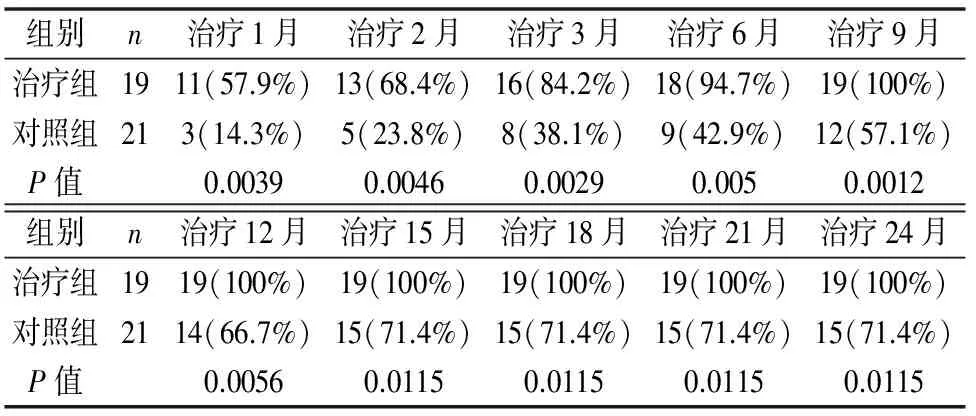
表3 治療后兩組病灶吸收情況對比
四、兩組不良反應發生情況
治療過程中兩組患者的主要不良反應為藥物性肝損害、胃腸道反應及末梢神經炎,不良反應率治療組(78.95%)要高于對照組(33.33%),兩組差異有統計學意義(P<0.01),差異主要體現在末梢神經炎方面,治療組末梢神經炎發生率遠高于對照組,而在藥物性肝炎和胃腸道反應發生率方面兩組差異無統計學意義(P>0.05)。(見表4)。
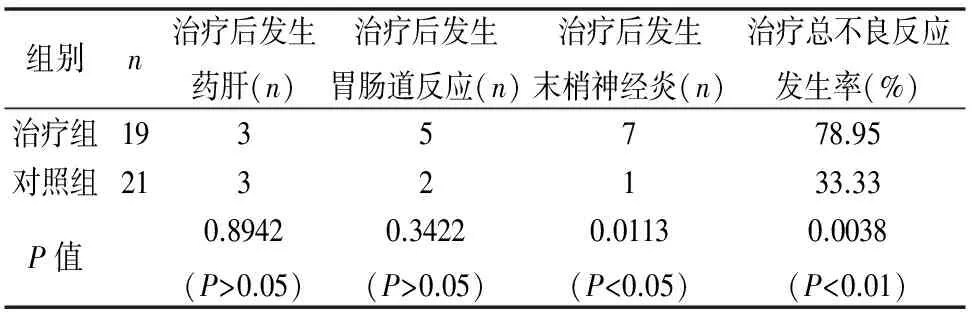
表4 治療后兩組不良反應情況對比
討 論
利奈唑胺在WHO 2016版耐藥結核病指南中屬于C組藥物(二線核心藥物)[8],首次將利奈唑胺列入核心藥物,肯定了利奈唑胺在耐藥結核病治療中的地位和價值。利奈唑胺是2000年經美國食品藥品管理局(FDA)批準上市的惡唑烷酮類抗菌藥物,該藥對耐藥革蘭陽性菌感染有顯著療效[9]。其作用機制是與細菌核糖體50S亞單位結合,抑制細菌蛋白質合成[10]。在體外和動物研究中對耐藥結核分枝桿菌顯示出較好的抑菌活性[11]。大量的國內外病例報道及臨床研究也證實利奈唑胺用于耐藥結核病治療的療效良好。
我們的研究發現,在治療耐多藥結核時,含利奈唑胺組在痰菌陰轉率、病灶吸收率等方面均要優于不含利奈唑胺組,二者之間有顯著統計學差異。且利奈唑胺組痰菌陰轉快,治療1月時,接近一半患者痰菌轉陰,57.9%患者病灶吸收或顯著吸收,治療6月時有接近90%患者痰菌轉陰,提示含利奈唑胺方案療效極佳,有希望將傳統耐多藥結核療程由24月縮短至12月。我們的研究也發現,使用利奈唑胺治療9月時所有患者的病灶均明顯吸收好轉,94.7%患者痰結核分枝桿菌轉陰,而且繼續使用到12月時并不能再提高痰菌轉陰率,提示可考慮將利奈唑胺的療程縮短至9月,但這些需要經過大樣本的研究和長時間隨訪觀察來驗證。
本研究發現,利奈唑胺組不良反應發生率要高于不含利奈唑胺組,但利奈唑胺組的不良反應主要表現在末梢神經炎,19例患者中有7例出現末梢神經炎表現,主要為雙下肢麻木,大多數癥狀較輕,予營養神經治療后癥狀緩解,個別患者癥狀較重,將利奈唑胺減量為300mg/天后,癥狀好轉。另有5例患者服利奈唑胺后出現明顯惡心、嘔吐,將利奈唑胺減量為300mg/天后,癥狀好轉,完成治療。有1例患者服利奈唑胺后出現明顯惡心、嘔吐,將利奈唑胺減量為300mg/天后,癥狀無好轉,不能堅持治療而退出觀察。本研究中,未監測到有患者發生文獻報道中較為常見的骨髓抑制等血液系統不良反應,但不排除觀察樣本量小所致。總體來說,雖然利奈唑胺組不良反應發生率要高于不含利奈唑胺組,但大部分不良反應較輕,減量后大部分患者癥狀均能緩解,不影響治療。
利奈唑胺用于治療耐多藥結核病時痰菌轉陰率高,不良反應可控,不失為治療耐多藥結核的良藥,給廣大耐多藥結核病患者帶來希望。
[1] World Health Organization.Global Tuberculosis Report 2016[R].
Geneva:World Health Organization,2016.
[2] von der Lippe B,Sandven P,Brubakk O.Efficacy and safety of linezolid in multidrug resistant TB (MDR-TB)-a report of ten cases[J].J Infect,2006,52(2):92-96.
[3] Fortún J,Martín-Dávila P,Navas E,et al.Linezolid for the treatment of multidrug-resistant tuberculosis[J].J Antimicrob Chemother,2005,56(1):180-185.
[4] Schecter GF,Scott C,True L,et al.Linezolid in the Treatment of Multidrug- Resistant Tuberculosis[J].Clin Infect Dis,2010,50(1):49-55.
[5] World Health Organization.Companion handbook to the WHO guidelines for the programmatic management of drug-resistant tuberculosis[M].Geneva:World Health Organization,2014.
[6] 王金河,梁建琴,武麗紅.利奈唑胺治療耐多藥結核病的研究進展[J].中國臨床醫生,2014,42(1):21-22.
[7] 童維佳,王永慶.阿莫西林/克拉維酸鉀聯合左氧氟沙星治療耐多藥肺結核的臨床效果[J].臨床肺科雜志,2015,20(9):1602-1604.
[8] World Health Organization.WHO treatment guidelines for drug-resistant tuberculosis,2016 update[M].Geneva:World Health Organization,2016.
[9] Leach KL,Brickner SJ,Noe MC,et al.Linezolid, the first oxazolidinone antibacterial agent[J].Ann N Y Acad Sci,2011,1222:49-54.
[10] Sisson TL,Jungbluth GL,Hopkins NK.Age and sex effects on the pharmacokinetics of linezolid[J].Eur J Clin Pharmacol,2002,57(11):793-797.
[11] Ford CW,Hamel JC,Stapert D,et al.Oxazolidinones: new antibacterial agents[J].Trends Microbiol,1997,5(5):196-200.
Clinical efficacy of linezolid in treatment of multi-drug resistant pulmonary tuberculosis
LIUZhi,YANGLiang-zi,FUJia-peng,LIUZhi-chao,KEXue,LIJian,FUXiang-dong,LIGuo-bao
theThirdPeople’sHospitalofShenzhen,Shenzhen,Guangdong518112,China
Objective To evaluate the clinical therapeutic effect and adverse reaction of linezolid in treatment of multi-drug resistant pulmonary tuberculosis (MDR-TB) patients. Methods 46 MDR-TB patients were divided randomly into the study group (n=22) and the control group (n=24). The study group was treated with linezolid mainly combined with amikacin, pyrazinamide, protionamide, ethambutol and levofloxacin for 24 months, and the control group was given amikacin, pyrazinamide, protionamide, ethambutol and levofloxacin for 24 months. Results At the end of treatment, the treatment success rate was 66.7% in the control group and 94.7% in the treatment group (P<0.05). Lesions absorption rate (marked absorption and absorption) were 71.1% in the control and 100% in the treatment group (P<0.05). The incidence of adverse reactions was 33.33% in the control group and 78.95% in the treatment group (P<0.01). Conclusion Linezolid will bring more benefits for MDR-TB patients by improving the sputum negative conversion rate, though some slight adverse reaction may unexpected happened but also be prevented.
linezolid; multi-drug resistant pulmonary tuberculosis; clinical therapeutic effect; adverse reaction
10.3969/j.issn.1009-6663.2017.07.003
518112 廣東 深圳,深圳市第三人民醫院
2017-03-22]

