維持性血液透析患者血清超氧化物歧化酶與冠狀動脈鈣化的關系
李穎,張五星,周偉,陳曉飛
(1河北北方學院,河北張家口075000;2解放軍第309醫院)
維持性血液透析患者血清超氧化物歧化酶與冠狀動脈鈣化的關系
李穎1,張五星2,周偉2,陳曉飛1
(1河北北方學院,河北張家口075000;2解放軍第309醫院)
目的 分析維持性血液透析(MHD)患者血清超氧化物歧化酶(SOD)與冠狀動脈鈣化(CAC)的關系。方法 選取MHD患者100例,根據冠狀動脈有無鈣化分為無鈣化組21例和有鈣化組79例,記錄患者的臨床資料和血清SOD、血鈣、甘油三酯等實驗室檢驗指標;應用16層螺旋CT檢測評估CAC情況;采用Pearson相關分析和Logistic回歸分析了解血清SOD與CAC發生的關系。結果 糖尿病患病率無鈣化組9%(2例),有鈣化組36%(29例);心血管事件發生率無鈣化組9%(2例),有鈣化組30%(24例),有鈣化組和無鈣化組的糖尿病患病率及心血管事件發生率比較差異有統計學意義(P均<0.05)。有CAC者血清SOD水平為(93.66±22.44)U/mL,無CAC者血清SOD水平為(118.76±39.70)U/mL,有CAC者血清SOD水平低于無CAC者(P<0.05)。Pearson相關分析發現血清SOD水平與CAC積分呈負相關(r=-0.285,P<0.05);Logistic回歸分析發現在校正了年齡、白蛋白因素之后,血清SOD水平仍是CAC的獨立危險因素(B=-0.044,P<0.05)。結論 MHD患者的血清SOD水平與CAC發生有關,血清SOD降低可能是MHD患者CAC發生的相關因素及干預靶點之一。
維持性血液透析;冠狀動脈鈣化;超氧化物歧化酶
已有研究[1]表明超氧化物歧化酶(SOD)與多種疾病有關,包括局部缺血再灌注性疾病、炎癥性疾病、神經退行性變等。維持性血液透析(MHD)患者與非血液透析患者相比心血管事件發生率高,是導致透析患者死亡的主要原因[2]。冠狀動脈鈣化(CAC)是導致心血管事件發生的重要危險因素[3]。多項研究[4]表明冠心病患者的血清SOD水平降低與冠狀動脈的病變相關。但是,MHD患者的血清SOD水平與冠狀動脈病變的相關性尚未見報道。2016年7~9月我們對MHD患者SOD水平變化與CAC之間的關系進行探討。
1 資料與方法
1.1 臨床資料 選取解放軍第309醫院腎臟病科MHD患者100例。男55例、女45例,年齡20~88歲。原發病為慢性腎小球腎炎40例,慢性腎小管間質腎病10例,糖尿病腎臟疾病25例,高血壓腎病10例,梗阻性腎病3例,紫癜性腎炎2例,多囊腎2例,其他病因的患者8例。所有患者透析時間在3個月以上,每周透析3次,每次透析時間4 h,血流量220~300 mL/min,使用的血管通路為頸內靜脈長期管和自體動靜脈內瘺。排除如下患者:①急性腎損傷者;②有冠狀動脈搭橋術和冠狀動脈支架置入術者;③服用免疫抑制劑者;④甲狀旁腺切除術者;⑤有活動性炎癥性疾病者;⑥嚴重的肝肺疾病者;⑦精神疾病患者;⑧惡性腫瘤者;⑨嚴重營養不良者。
1.2 冠狀動脈的鈣化評估 應用日本東芝Toshiba Aquilion M16全身CT掃描機對患者進行胸腔平掃,評估冠狀動脈的鈣化情況。由兩位有經驗的放射科醫師對CAC進行評分,根據冠狀動脈有無鈣化分為無鈣化和有鈣化兩組。冠狀動脈主要分為四個分支:左冠狀動脈主干、左回旋支、左前降支和右冠狀動脈。參考鈣化評分的相關文獻報道[5],對每個分支的鈣化程度進行評估后,分為0分(無鈣化)、1分(輕度鈣化)、2分(中度鈣化)、3分(重度鈣化)四個等級。輕度鈣化指該分支的鈣化長度<1/3;中度鈣化指該分支的鈣化長度占1/3~2/3;重度鈣化指該分支全段鈣化。最后將四個分支的評分進行匯總。
1.3 實驗室檢查 患者均空腹10~12 h后,于次日清晨空腹抽取靜脈血,檢測谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、白蛋白(ALB)、SOD、血Ca2+、甘油三酯(TG)等常規實驗室指標。

2 結果
2.1 冠狀動脈的鈣化評估情況 無鈣化組21例,年齡(42.33±13.72)歲,透析時間(42.00±45.60)周,BMI(20.95±3.96)kg/m2,糖尿病患病率9%(2例),心血管事件發生率9%(2例);有鈣化組79例,年齡(63.35±14.49)歲,透析時間(59.59±41.33)周,BMI(22.42±4.90)kg/m2,糖尿病患病率36%(29例),心血管事件發生率30%(24例)。有鈣化組和無鈣化組的年齡、糖尿病患病率及心血管事件發生率比較差異有統計學意義(P均<0.05)。
2.2 實驗室檢測指標 有鈣化組和無鈣化組比較ALT、AST、ALB、TG、SOD和Ca2+水平存在差異(P均< 0.05)。見表1。
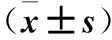
表1 兩組實驗室指標比較
2.3 Pearson相關分析和Logistic回歸分析 Pearson相關分析顯示年齡與CAC呈正相關(r=0.367,P<0.05);ALB與CAC呈負相關(r=-0.245,P<0.05);SOD與CAC呈負相關(r=-0.285,P<0.05)。進行Logistic回歸分析,校正了年齡、ALB對CAC的影響,顯示SOD是CAC的獨立危險因素(B=-0.044,P<0.05)。
3 討論
SOD可催化氫離子和超氧自由基結合生成過氧化氫和氧分子,從而能特異性清除超氧陰離子自由基。健康人體內的活性氧自由基有氧代謝過程運行正常,當出現疾病時,體內的平衡被打破,體內的抗氧化系統被激活,就會大量消耗SOD等抗氧化防御酶。該酶能清除體內的脂質過氧化物,減輕對細胞的過氧化損傷,阻止脂質過氧化的形成,保護血管內皮免受損傷,防止動脈粥樣硬化形成。
本研究結果顯示MHD患者易發生CAC,此與Pencak等[7]的研究結果一致。年齡、糖尿病史、心血管事件、ALT、AST、ALB、TG、SOD和血Ca2+等是CAC的危險因素[6~8]。此外,在Pearson相關性分析中,CAC與SOD呈負相關。經過Logistic回歸分析,校正了年齡和ALB后,發現SOD與CAC仍然存在相關性。目前關于血管鈣化的機制仍不明確,多項研究已表明血管鈣化的形成與多項病理生理機制有關,包括炎癥反應、氧化應激、成骨細胞的多樣性、骨轉化、遺傳的易感性等[9]。分析原因可能是一方面MHD的患者本身體內的氧化應激反應增強,另一方面MHD患者每一次透析都會刺激機體產生微炎癥反應,當透析速度過快時可能會出現局部缺血再灌注的可能,這兩方面皆會加重體內SOD的消耗,促進CAC的發生。由此我們推測,SOD可作為判斷MHD患者冠狀動脈是否發生鈣化的指標之一,對于心血管疾病的早期診斷及預防有一定意義。此外,目前研究發現已有多種藥物可提高體內SOD的活性用于各種疾病的治療,如依達拉奉[10]、銀杏葉[11]。
雖然目前最常用的評價CAC方法是64層及以上的多層螺旋CT進行冠狀動脈掃描并采用Agatston鈣化評分進行冠狀動脈的鈣化范圍和長度半定量分析,但目前多數的基層醫院還是以16層螺旋CT為主。本研究優點在于應用最經濟普遍的16螺旋CT。影響冠狀動脈圖像質量的最主要因素是心率和呼吸,所以在檢查前控制患者的心率及囑咐患者做屏氣練習對于檢查成功是非常重要的。除此之外,CAC的檢測方法還有超聲心動圖、電子束CT(EBCT)和冠狀動脈造影(SCA)等。EBCT檢測精確,但價格昂貴。 SCA是有創性檢查,會有造影劑的危害。雖然血液透析可清除大部分造影劑,但對于透析患者殘余腎功能的保護沒有好處。
本文的局限性:①檢測的樣本量不大,透析齡偏短,會導致部分統計結果只表現出某種變化趨勢,但是沒有統計學的意義;②該研究是單中心橫斷面研究,沒有對SOD的指標進行遠期隨訪,以至于無法觀察到患者的SOD水平對其CAC的遠期影響及預后;③本研究未評估藥物對CAC的影響;④此次研究CAC的評分方法較粗略,還需要擴大樣本量完善實驗設計后繼續研究。
[1] McCord JM, Edeas MA. SOD, oxidative stress and human pathologies: a brief history and a future vision[J]. Biomed Pharmacother,2005,59(4):139-142.
[2] Noordzij M, Cranenburg EM, Engelsman LF, et al. Progression of aortic calcification is associated with disorders of mineral metabolism and mortality in chronic dialysis patients[J]. Nephrol Dial Transplant, 2011,26(5):1662-1669.
[3] Madhavan MV, Tarigopula M, Mintz GS, et al. Coronary artery calcification: pathogenesis and prognostic implications[J]. J Am Coll Cardiol, 2014,63(17):1703-1714.
[4] Ma JL, Wang S, Li XM, et al. Relationship of vascular endothelial function and content of serum superoxide dismutase and malonyldiadehyde in patients with coronary heart disease[J]. Chin Heart J, 2006,18(3):320-322.
[5] Shemesh J, Henschke CI, Farooqi A, et al. Frequency of coronary artery calcification on low-dose computed tomography screening for lung cancer[J]. Clin Imaging, 2006,30(3):181-185.
[6] Pencak P, Czerwieńska B, Ficek R, et al. Calcification of coronary arteries and abdominal aorta in relation to traditional and novel risk factors of atherosclerosis in hemodialysis patients[J]. BMC Nephrol, 2013,14(1):10.
[7] Jaruvongvanich V, Wirunsawanya K, Sanguankeo A, et al. Nonalcoholic fatty liver disease is associated with coronary artery calcification: a systematic review and meta-analysis[J]. Dig Liver Dis, 2016,48(12):1410-1417.
[8] 鄭淑蓓,金領微,李占園,等.維持性血液透析患者冠狀動脈鈣化的評價及影響因素分析[J].中華腎臟病雜志,2015,31(5):339-344.
[9] Evrard S, Delanaye P, Kamel S, et al. Vascular calcification: from pathophysiology to biomarkers[J]. Clin Chim Acta, 2015, 438(1):401-414.
[10] 王欣, 施蟬宏,毛蓉嫣.依達拉奉對老年短暫性腦缺血發作患者血清超氧化物歧化酶和丙二醛的影響[J].中華老年醫學雜志,2015,34(12):1310-1312.
[11] 陳少青,單曉彤,魏成喜,等.口服銀杏葉軟膠囊輔助治療冠心病患者血清炎癥因子、氧化應激標志物及血漿內脂素水平變化[J].山東醫藥,2016,56(3):44-45.
張五星(E-mail:kidney309@sina.com)
10.3969/j.issn.1002-266X.2017.17.024
R543.3
B
1002-266X(2017)17-0070-03
2016-12-14)

