阿托伐他汀誘導血紅素氧合酶1表達對血管內皮細胞抗炎癥損傷能力的影響
王忠慶,黃維義
(西南醫科大學附屬醫院,四川瀘州646000)
阿托伐他汀誘導血紅素氧合酶1表達對血管內皮細胞抗炎癥損傷能力的影響
王忠慶,黃維義
(西南醫科大學附屬醫院,四川瀘州646000)
目的 探討阿托伐他汀能否通過誘導血紅素氧合酶1(HO-1)表達增強血管內皮細胞抗炎癥損傷的能力。方法 體外培養人臍靜脈內皮細胞(HUVEC),隨機分為5組,分別予以不同濃度的阿托伐他汀(0、1、2、5、10 μmol/L)孵育24 h,檢測HO-1蛋白表達量和上清液膽紅素濃度 。另將HUVEC隨機分5組,對照組(等量純培養基)、大劑量他汀組(阿托伐他汀10 μmol/L) 、小劑量他汀組(阿托伐他汀2 μmol/L)、HO-1阻斷組(阿托伐他汀10 μmol/L+ZnPP IX 10 μmol/L)、膽紅素組(膽紅素5 μmol/L)孵育細胞24 h后,各組均加入終濃度為10 ng/mL 的TNF-α孵育細胞12 h。檢測細胞上清液乳酸脫氫酶(LDH)、單核細胞趨化蛋白1(MCP-1)、丙二醛(MDA)、一氧化氮(NO)濃度并檢測細胞活力和凋亡率。結果 與0 μmol/L濃度組比較,阿托伐他汀2、5、10 μmol/L濃度組HO-1蛋白的表達及膽紅素水平增高(P<0.05或<0.01)。與對照組比較,加用阿托伐他汀或膽紅素預處理組上清液MCP-1、MDA、LDH水平降低且NO水平升高,細胞活力增強,細胞凋亡率降低(P<0.05或<0.01),HO-1阻斷組上述各項指標均無明顯變化(P均>0.05)。結論 阿托伐他汀具有誘導HUVEC血紅素氧合酶1(HO-1)表達增強血管內皮細胞抗炎癥損傷的能力,且此作用可能存在劑量依賴性。
動脈粥樣硬化;阿托伐他汀;血紅素氧合酶-1;腫瘤壞死因子-α;炎癥;細胞凋亡;臍靜脈內皮細胞
已知血管內皮在維持血管穩態過程中發揮著重要作用,內皮細胞損傷與修復功能障礙是多種心、腦血管疾病的重要病理基礎,內皮損傷業已被認定為動脈粥樣硬化(AS)的始動環節[1]。大量研究證實,已知的致AS主要危險因素如吸煙、高血壓、糖尿病、脂代謝紊亂乃至血液流變學改變等都能引起氧化應激及炎癥[2],而這些正是導致內皮損傷與功能障礙的關鍵機制[3]。他汀是防治AS的關鍵藥物,不僅具有強大的調脂作用,還具有諸如抗炎、抗氧化、保護內皮細胞等眾多的調脂外作用。血紅素氧合酶1(HO-1)是細胞內一種可誘導的重要保護酶,在拮抗氧化應激和炎癥所致的組織與細胞損傷中發揮著重要作用[4]。2015年10月~2016年5月,我們采用體外培養臍靜脈內皮細胞(HUVEC)進行實驗研究,探討阿托伐他汀能否通過誘導HO-1表達增強內皮細胞的抗炎癥損傷能力。
1 材料與方法
1.1 材料 HUVEC購自廣州吉尼歐公司;阿托伐他汀標準品購自藥檢所;膽紅素、鋅原卟啉IX((ZnPP IX)購自Sigma公司;兔抗HO-1抗體購自Abcam公司;單核細胞趨化蛋白-1(MCP-1)、丙二醛(MDA)、一氧化氮(NO)、膽紅素ELISA試劑盒購自英國Abcam公司;AnnexinV-FITC/PI雙染試劑盒購自凱基生物公司;二甲基亞砜(DMSO)、四甲基偶氮唑藍(MTT)購自Sigma公司;RPMI-1640培養液、0.25%胰蛋白酶-EDTA購自Hyclone公司;胎牛血清(FBS)購自杭州四季青公司。
1.2 細胞培養及分組干預 HUVEC 培養在含10% FBS的RPMI-1640培養基,置于5% CO2、37 ℃的培養箱中培養,待細胞融合達80%后,用0.25%胰蛋白酶-EDTA消化,消化適宜后加入完全培養基終止消化作用。用滅菌后的槍頭將培養瓶壁上的細胞吹落形成細胞懸液,800 r/min離心5 min,按照1∶3進行傳代培養,接種在6孔板中,當細胞生長至亞融合狀態時換用無血清培養基培養12 h達同步化,再行分組實驗。 實驗一:分為5組(每組6孔),分別給予不同終濃度阿托伐他汀(0、1、2、5、10 μmol/L)孵育24 h。實驗二:分為5組(每組6孔),對照組(等量純培養基)、大劑量他汀組(阿托伐他汀10 μmol/L) 、小劑量他汀組(阿托伐他汀2 μmol/L)、HO-1阻斷組(阿托伐他汀10 μmol/L + ZnPP IX 10 μmol/L)、膽紅素組(膽紅素5 μmol/L)孵育細胞24 h后,各組均加入終濃度為10 ng/mL 的TNF-α孵育細胞12 h。
1.3 細胞上清液 HO-1蛋白表達檢測 收集實驗一干預后的各組細胞,加入裂解液裂解60 min,4 ℃、14 000 r/min離心5 min,取上清液用BCA法檢測蛋白濃度。以β-actin為內參,采用Quantity圖像分析軟件分析其相對表達量,以灰度比值表示。
1.4 細胞上清液膽紅素、MDA、MCP-1、NO、LDH濃度檢測 收集實驗一干預后的各組細胞的上清液采用ELISA法測定膽紅素濃度;收集實驗二干預后的各組細胞的上清液采用ELISA法測定MDA、MCP-1、NO、LDH水平,MDA、MCP-1、NO濃度;以上測定操作步驟均按照試劑盒說明進行。LDH濃度采用全自動生化儀進行測定,所有操作步驟按照全自動生化儀的操作流程進行。
1.5 細胞增殖活力檢測 采用MTT法。將含4×104/mL細胞懸液以每孔200 μL接種于96孔板中,按照實驗二分組及干預結束后,每孔加入10 μL MTT液,將培養板放置于37 ℃,5% CO2的細胞培養箱中孵育4 h后,棄去培養液,每孔均加入150 μL二甲基亞砜后,放在搖床上低速振蕩10 min后,用酶標儀測定490 nm處各孔OD值。OD值越大,細胞增殖活力越強。
1.6 細胞凋亡檢測 收集實驗二加入終濃度為10 ng/mL 的TNF-α孵育12 h后的各組細胞, Annexin V-FITC/PI雙染法將樣本中正常、壞死凋亡細胞區分開,采用流式細胞技術檢測細胞凋亡率,所有操作按照凱基凋亡試劑盒說明進行。

2 結果
2.1 不同濃度阿托伐他組HO-1蛋白表達及膽紅素水平比較 HUVEC細胞HO-1蛋白的表達及膽紅素水平隨著阿托伐他汀濃度的增高而增加,與0 μmol/L濃度組比較, 2、5、10 μmol/L濃度組HO-1蛋白的表達及膽紅素水平增高(P<0.05或<0.01)。見表1。
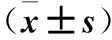
表1 不同濃度阿托伐他組HO-1蛋白表達及膽紅素水平比較
注:與阿托伐他汀0 μmol/L組比較,*P<0.05,△P<0.01。
2.2 HO-1激活或阻斷各組氧化應激和炎癥因水平變化 與對照組比較,加用阿托伐他汀或膽紅素預處理HUVEC均可明顯降低上清液中MCP-1、MDA、LDH的水平并增加NO的水平(P<0.05或<0.01),HO-1阻斷組上述各項指標無統計學差異(P均>0.05)。見表2。
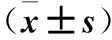
表2 HO-1激活或阻斷各組氧化應激和炎癥因濃度變化
注:與對照組比較,*P<0.05,△P<0.01。
2.3 HO-1激活或阻斷各組細胞活力及凋亡率變化 與對照組比較,加用他汀或膽紅素預處理后均可減輕TNF-α引起的HUVEC細胞損傷,升高細胞活力、降低細胞凋亡率(P<0.05或<0.01),HO-1阻斷組HUVEC活力與凋亡率無統計學差異(P均>0.05)。見表3。
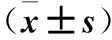
表3 HO-1激活或阻斷各組細胞活力及凋亡率變化
注:與對照組比較,*P<0.05,△P<0.01。
3 討論
眾所周知,他汀自問世以來已然成為AS防治的基石,他汀對內皮細胞的保護作用則被認為是其防治AS的重要機制之一。然而他汀如何保護內皮細胞并未完全明了。近年陸續報道,誘導HO-1高表達可能是他汀拮抗AS的重要機制[5]。已知HO-1是廣泛存在于哺乳動物細胞微粒體中的一種可誘導的重要抗氧化酶, HO-1的主要作用是充當關鍵的限速酶催化具有促氧化性質的游離血紅素降解生成膽綠素、一氧化碳(CO)和游離鐵,其中的膽綠素常被迅速還原成膽紅素。現已明確,膽紅素是細胞最強的內源性抗氧化劑之一,它能通過清除多種形式的自由基而在細胞拮抗氧化應激損傷中發揮著重要作用[6];CO則是與NO相似的細胞內氣體信號分子,主要參與擴張血管、抑制炎癥、調節細胞增殖與凋亡等重要作用[7], HO-1/膽紅素/CO共同組成的內源性保護系統在組織細胞應對炎癥與氧化應激損傷中不可或缺,合理上調HO-1表達已成為包括AS在內的多種疾病的重要防治靶點[8,9]。
阿托伐他汀是抗AS循證依據最多、臨床應用最廣的他汀之一,不僅具有強大的調脂作用,還具有諸如抗炎、抗氧化、保護內皮細胞等眾多的調脂外作用。近年來已有多項研究顯示,他汀正是HO-1的有效誘導劑(盡管不同種類的他汀誘導HO-1表達的細胞內信號轉導機制有所不同)[10],他汀眾多的調脂外作用正逐漸被揭示主要是通過誘導HO-1表達介導的。本實驗發現,當達到一定濃度后,阿托伐他汀能呈劑量依賴性誘導體外培養的HUVEC高表達HO-1蛋白并增加膽紅素的生成。已知TNF-α是由單核巨噬細胞分泌的一種促炎癥因子,它可以啟動炎癥反應過程[11]。為此,我們給體外培養的HUVEC加入TNF-α共同孵育以模擬炎癥環境,通過檢測細胞培養液中MCP-1水平代表炎癥反應程度,同時檢測MDA、 LDH、NO水平及細胞活力和細胞凋亡率代表HUVEC遭受炎癥損[12,13]傷的程度。結果顯示,與對照組相比,在能誘導HO-1表達的前提下,給予小劑量(2 μmol/L)阿托伐他汀預處理即可明顯減輕HUVEC的炎癥損傷程度,給予大劑量阿托伐他汀(10 μmol/L)預處理所產生的抗HUVEC炎癥損傷作用則更加顯著,但大劑量阿托伐他汀的這一細胞保護作用卻能被同時加入的ZnPPIX消除,由于ZnPPIX是HO-1的特異性阻斷劑,提示阿托伐他汀抗HUVEC炎癥損傷作用可能主要是通過誘導HO-1蛋白表達實現的,這一點也被膽紅素組的結果所佐證,即不用他汀而用外源性膽紅素也能在一定程度上起到抗HUVEC炎癥損傷效果,不過單用膽紅素的保護作用遠不及大劑量阿托伐他汀,可能是因為后者誘導HO-1顯著表達后,能起到降解清除有害的游離血紅素并生成抗氧化與抗炎癥的膽紅素和CO,這一舉三得的綜合保護作用自然比單用外源性膽紅素更能增強HUVEC的抗炎癥損傷效果。總之,本實驗的上述結果證明,足夠劑量的阿托伐他汀能顯著誘導HO-1表達并因此增強HUVEC的抗炎癥損傷能力,而膽紅素可能是該保護作用的效應分子之一。
本研究同時也發現,過低劑量的阿托伐他汀(1 μmol/L)并不能有效誘導HO-1表達。Mirjanic-Azaric等[14,15]臨床試驗也發現了類似結果。提示對AS患者需要強化他汀治療才能有效顯現出其調脂外作用。理解這一點,對合理應用他汀防治以炎癥為基礎的易損斑塊所致的急性冠脈綜合征尤為重要。
[1] Mannarino E, Pirro M. Endothelial injury and repair: a novel theory for atherosclerosis [J].Angiology, 2008,59(2 Suppl):69S-72S.
[2] Kunitomo M. Oxidative stress and atherosclerosis [J].Yakugaku Zasshi, 2007,127 (12): 1997-2014.
[3] Fleissner F, Thum T. Critical role of the nitric oxide/reactive oxygen species balance in endothelial progenitor dysfunction [J].Antioxid Redox Signal, 2011,15(4):933-948.
[4] Takahashi T,Morita K,Akagi R,et al. Heme oxygenase -1:a novel therapeutic target in oxidative tissue injuries [J].Curr Med Chem,2004,11(12): 1545-1561.
[5] Heeba G, Moselhy ME, Hassan M , et al. Anti-atherogenic effect of statins: role of nitric oxide, peroxynitrite and haem oxygenase-1 [J]. Br J Pharmacol, 2009,156(8):1256-1266.
[6] Ishikawa K, Maruyama Y. Heme oxygenase as an intrinsic defense system in vascular wall:implication against atherogenesis [J].J Atheroscler Thromb,2001,8(3):63-70.
[7] Zou AP, Billington H, Su N, et al. Expression and actions of heme oxygenase in the renal medulla of rats [J].Hypertension, 2000,35(8):342-347.
[8]Kirkby KA, Adin CA. Products of heme oxygenase and their potential therapeutic applications [J] .Am J Physiol Renal Physiol, 2006,290(3): F563-F571.
[9] Haines DD, Lekli I, Teissier P, et al. Role of haeme oxygenase-1 in resolution of oxidative stress-related pathologies: focus on cardiovascular, lung, neurological and kidney disorders [J].Acta Physiol (Oxf), 2012,204(4): 487-501.
[10] Hsieh CH, Jeng JC, Hsieh MW, et al. Involvement of the p38 pathway in the differential induction of heme oxygenase-1 by statins in Neuro-2Acells exposed to lipopolysaccharide [J]. Drug Chem Toxicol, 2011,34(1):8-19.
[11] Huang WY, Wang J,Liu YM,et al. Inhibitory effect of malvidin on TNF-α-induced inflammatory response in endothelial cells [J].Eur J Pharmacol, 2014,723:67-72.
[12] Barone E, Di Domenico F, Butterfield DA. Statins more than cholesterol lowering agents in Alzheimer disease: their pleiotropic functions as potential therapeutic targets [J]. Biochem Pharmacol, 2014,88(4):605-616 .
[13] Ali F, Hamdulay SS, Kinderlerer AR, et al. Statin-mediated cytoprotection of human vascular endothelial cells: a role for Kruppel-like factor 2-dependent induction of heme oxygenase-1 [J] . J Thromb Haemost, 2007,5(12):2537-2546.
[14] Mirjanic-Azaric B, Rizzo M, Jürgens G, et al. Atorvastatin treatment increases plasma bilirubin but not HMOX1 expression in stable angina patients [J].Scand J Clin Lab Invest, 2015,75(5):382-389.
[15] Hsu M,Muchova L,Morioka I,et al. Tissue-specific effects of statins on the expression of heme oxygenase-1 in vivo [J]. Biochem Biophys Res commun, 2006,343(3):738-744.
黃維義(E-mail:hwy6881@126.com)
10.3969/j.issn.1002-266X.2017.17.011
R543.5
A
1002-266X(2017)17-0034-03
2016-11-07)

