CXCL12/CXCR4生物軸對慢性病毒性心肌炎小鼠心肌纖維化的影響
郭春艷,韓波,梁皓,張曉靜 ,汪翼
(1山東大學(xué)附屬省立醫(yī)院,濟(jì)南250021;2濟(jì)南市婦幼保健院)
CXCL12/CXCR4生物軸對慢性病毒性心肌炎小鼠心肌纖維化的影響
郭春艷1,韓波1,梁皓1,張曉靜2,汪翼1
(1山東大學(xué)附屬省立醫(yī)院,濟(jì)南250021;2濟(jì)南市婦幼保健院)
目的 探討CXCL12/CXCR4生物軸與慢性病毒性心肌炎(CVMC)心肌纖維化的關(guān)系。方法 取4周齡BALB/C健康雄性小鼠30只,隨機(jī)分為對照組(n=10)和CVMC組(n=20)。CVMC組以柯薩奇病毒B3株1×109/mL腹腔重復(fù)增量感染(第0天、14天、28天劑量分別為0.20、0.25、0.30 mL)建立CVMC模型;對照組同期腹腔注射等體積生理鹽水。第42天麻醉后行心臟超聲檢查心率、左室舒張末期內(nèi)徑、左室收縮末期內(nèi)徑、主動脈血流峰值速度,并計算短軸縮短率和射血分?jǐn)?shù)。檢查后斷髓處死小鼠,取心臟組織進(jìn)行心肌組織病理學(xué)檢查及膠原容積測定,計算心肌組織中的膠原容積積分(CVF)。采用Western blotting檢測心肌組織中CXCL12、CXCR4蛋白表達(dá),RT-PCR檢測心肌組織中Ⅰ、Ⅲ型膠原表達(dá)。結(jié)果 與對照組比較,CVMC組小鼠心肌組織CVF增大,Ⅰ型膠原及Ⅲ型膠原的含量增加,CXCL12、CXCR4蛋白表達(dá)增多,差異均有統(tǒng)計學(xué)意義(P均<0.05)。心肌組織CVF與CXCL12 、CXCR4蛋白表達(dá)均呈正相關(guān)(r分別為0.79、0.60,P均<0.05)。結(jié)論 CXCL12/CXCR4生物軸與CVMC心肌纖維化的發(fā)生密切相關(guān)。
病毒性心肌炎,慢性;CXCL12/CXCR4生物軸;心肌纖維化;小鼠
病毒性心肌炎是心血管系統(tǒng)常見疾病,經(jīng)積極治療大多可痊愈;但少數(shù)患者可遷延為慢性病毒性心肌炎(CVMC),甚至發(fā)展為擴(kuò)張型心肌病而預(yù)后不良。心肌間質(zhì)纖維化是CVMC的病理改變特征[1]。最新研究發(fā)現(xiàn),CXCL12/CXCR4生物軸能促進(jìn)纖維細(xì)胞增殖、肌成纖維細(xì)胞形成、細(xì)胞外基質(zhì)沉積,從而加速組織纖維化發(fā)病進(jìn)程。為進(jìn)一步了解CVMC心肌纖維化的發(fā)生機(jī)制,2014年4月~2016年4月,我們對CXCL12/CXCR4生物軸與CVMC心肌纖維化之間的相關(guān)性進(jìn)行探討。
1 材料與方法
1.1 材料 病毒:柯薩奇病毒B3株(CVB3)Nancy標(biāo)準(zhǔn)株購自山東省醫(yī)學(xué)科學(xué)院基礎(chǔ)研究所微生物室。在Hela細(xì)胞上傳代,凍融3次,并測得半數(shù)細(xì)胞感染率為1×109/mL。動物:4周齡BALB/C健康雄性小鼠30只,體質(zhì)量為15~20 g,由山東大學(xué)動物實驗中心提供。試劑:苦味酸-天狼猩紅染液購自北京雷根生物技術(shù)有限公司;兔抗小鼠CXCL12、CXCR4多克隆抗體購自Abcam公司;封閉用正常山羊血清工作液、山羊抗兔生物素化二抗工作液、辣根過氧化酶標(biāo)記的鏈霉卵白素工作液均購自北京中山金橋生物技術(shù)有限公司;濃縮型DAB試劑盒購自北京雷根生物技術(shù)有限公司;BCA-100蛋白質(zhì)定量測定試劑盒及RIPA蛋白裂解液購自Millipore公司;辣根酶標(biāo)記山羊抗兔IgG購自Thermo公司;ECL顯影試劑盒購自美國Santa Cruz公司;MMLVRT-PCR擴(kuò)增試劑盒購自美國Invitrogen公司。
1.2 動物模型制備及相應(yīng)處理 30只小鼠隨機(jī)分為對照組(n=10)和CVMC組(n=20)。CVMC組分別于第0、14、28天腹腔接種1×109/mL的 CVB3 0.2、0.25、0.3 mL共3次[2,3],對照組小鼠同期腹腔注射等體積生理鹽水。第42天時將兩組小鼠腹腔注射3%水合氯醛(0.01~0.015mL/g)麻醉后應(yīng)用PHILIPS 7500彩色多普勒超聲顯像儀檢查心率(HR)、左室舒張末期內(nèi)徑(LVDD)、左室收縮末期內(nèi)徑(LVSD)、主動脈血流峰值速度(Vp),并計算短軸縮短率(FS)和射血分?jǐn)?shù)(EF)。檢查后斷髓處死,取心臟,濾紙吸干,沿左室長軸分為兩部分,一部分放入10%中性甲醛固定,待做HE、苦味酸天狼猩紅染色;另一部分放入-80 ℃凍存,以備Western blotting分析及RT-PCR檢查。
1.3 心肌組織病理學(xué)檢查及膠原容積測定 小鼠心肌組織標(biāo)本的石蠟切片分別以HE常規(guī)染色及苦味酸天狼猩紅膠原染色,確認(rèn)心臟病理變化以及心肌纖維化改變。普通顯微鏡下膠原組織呈紅色,心肌組織呈黃色。采用Leica照相系統(tǒng)拍照,每張切片隨機(jī)選取5個視野(不包括血管),用Qwin圖像分析系統(tǒng)計算每個視野中膠原組織所占百分比,最后取均數(shù)即為膠原容積積分(CVF),以反映心肌間質(zhì)纖維化程度。
1.4 心肌組織中CXCL12、CXCR4蛋白表達(dá) 采用Western blotting法,嚴(yán)格按試劑盒說明操作。將心肌組織放入EP管打進(jìn)預(yù)冷的含有1‰PMSF的生理鹽水,用剪刀剪碎,生理鹽水清洗。加裂解液、超聲裂解并4 ℃離心(20 000r/min)30 min,吸取上清液測定蛋白濃度,各泳道加樣量為60 μg蛋白體積+1/3蛋白體積的4×Loading buffer。8% SDS聚丙烯酰胺凝膠100 V電泳90 min,將分離的蛋白質(zhì)轉(zhuǎn)膜60 min至硝酸纖維素膜。加入兔抗小鼠CXCL12、CXCR4多克隆抗體,4 ℃過夜。二抗室溫孵育60 min后,TBST洗膜3次進(jìn)行ECL化學(xué)發(fā)光、X線曝光及顯影、定影,應(yīng)用Alphalmager TM 2200凝膠成像儀進(jìn)行凝膠掃描和分析,以目的片段/內(nèi)參照GAPDH片段的條帶光密度比值作半定量比較。
1.5 心肌組織中Ⅰ、Ⅲ型膠原表達(dá)檢測 采用RT-PCR法。①RNA提取:取50~100 mg心臟組織剪碎后加Trizol于勻漿器中勻漿,異丙醇沉淀,乙醇洗滌,最后溶于焦碳酸二乙酯處理的水中。分光光度計測其濃度,瓊脂糖凝膠電泳檢測其完整性。②RT反應(yīng):取5 μg總RNA按照MMLV說明書逆轉(zhuǎn)錄為cDNA。③PCR反應(yīng):以β-actin為內(nèi)參照,引物均由濟(jì)南博亞生物科技有限公司合成。PCR反應(yīng)條件為:預(yù)變性95 ℃ 5 min,變性94 ℃ 60 s,退火55 ℃ 60 s,延伸72 ℃ 60 s,循環(huán)33次。④PCR產(chǎn)物定量:PCR產(chǎn)物經(jīng)1.5%瓊脂糖凝膠電泳分離,應(yīng)用Alphalmager TM 2200凝膠成像儀進(jìn)行凝膠掃描和分析,以目的片段/內(nèi)參照β-actin片段的條帶光密度比值作半定量比較。

2 結(jié)果
2.1 兩組心臟超聲檢查指標(biāo) 至第42天時,CVMC組小鼠死亡7只,存活13只。與對照組比較,CVMC組LVDD、LVSD增大, Vp、FS、EF降低,HR增快(P均<0.05)。見表1。
2.2 兩組心肌組織病理變化及膠原容積 HE染色:對照組小鼠心肌細(xì)胞形態(tài)正常,肌原纖維排列致密、整齊,間質(zhì)成纖維細(xì)胞數(shù)量、形態(tài)正常,無明顯病理改變;而CVMC組小鼠心肌纖維排列疏松,間質(zhì)成纖維細(xì)胞明顯增生。苦味酸天狼猩紅染色:對照組小鼠心肌細(xì)胞間隙可見少量紅色纖細(xì)的膠原,而CVMC組心肌膠原明顯增生、變粗,并且將心肌細(xì)胞分割呈網(wǎng)篩狀。CVMC組CVF為(13.95±1.08)%,對照組為(6.52±1.31)%,CVMC組CVF較對照組明顯升高(P<0.05)。
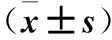
表1 兩組心臟超聲檢查指標(biāo)比較
注:與對照組相比,▲P<0.05。
2.3 兩組心肌組織中CXCL12、CXCR4蛋白表達(dá) 兩組心肌中均可檢測到CXCL12、CXCR4蛋白表達(dá),CVMC組表達(dá)較對照組明顯增強(qiáng)。對照組CXCL12與GAPDH吸光度比值為0.33±0.06,CVMC組為0.90±0.09,兩者相比有統(tǒng)計學(xué)差異(P<0.05);對照組CXCR4與GAPDH吸光度比值為0.11±0.03,CVMC組為0.42±0.07,兩者相比有統(tǒng)計學(xué)差異(P<0.05)。
2.4 兩組心肌組織中Ⅰ、Ⅲ型膠原表達(dá) CVMC組小鼠心肌中Ⅰ型膠原及Ⅲ型原的含量較對照組明顯增加,但Ⅰ型膠原增加更為突出,Ⅰ/Ⅲ型膠原比值亦較對照組明顯增大(P均<0.05)。見表2。

表2 兩組心肌Ⅰ型膠原、Ⅲ型膠原水平比較
注:與對照組相比,◆P<0.05。
2.5 心肌組織中CVF與CXCL12、CXCR4蛋白表達(dá)相關(guān)性 心肌組織中CVF與CXCL12、CXCR4蛋白表達(dá)均呈正相關(guān)(r分別為0.79、0.60,P均<0.05),CXCL12/CXCR4生物軸可促進(jìn)CVMC心肌纖維的增生。
3 討論
CVMC的病程多在1年以上,臨床表現(xiàn)為心功能下降及進(jìn)行性心臟擴(kuò)大,病理特征為心肌間質(zhì)纖維化[1], 主要表現(xiàn)為心肌Ⅰ型、Ⅲ型膠原的增生及其比例的失調(diào),因此阻逆膠原增生,抑制心肌纖維化是防止CVMC向擴(kuò)張型心肌病轉(zhuǎn)化的關(guān)鍵。
CVB3株是引起CVMC最常見的病毒[4], CVMC的發(fā)生、發(fā)展依賴于病毒的持續(xù)存在[5]。小鼠心肌炎的分期為第0~4天為急性期,第4~14天為亞急性期,第14~90天為慢性期[6]。本研究通過以CVB3株重復(fù)增量感染小鼠,第42天時行小鼠心臟B超檢查了解心功能及心臟大小,并行心肌組織HE染色及膠原特異性染色,發(fā)現(xiàn)感染CVMC組小鼠LVDD、LVSD較對照組小鼠明顯增大,但Vp、FS及EF等均較對照組顯著降低。CVMC組HE染色顯示心肌纖維排列疏松,間質(zhì)成纖維細(xì)胞明顯增生,可見少許炎性細(xì)胞浸潤,苦味酸天狼猩紅染色發(fā)現(xiàn)其心肌CVF也較對照組小鼠顯著增加。以上結(jié)果說明第42天時小鼠已具備CVMC的臨床及病理特征,證明此時CVMC模型制備成功。
心肌與非心肌細(xì)胞通過結(jié)締組織和細(xì)胞外基質(zhì)(ECM)相互連接,ECM成分包括膠原、蛋白多糖、糖蛋白、肽生長因子及蛋白酶。心肌間質(zhì)的主要成分是由心肌間隙中成纖維母細(xì)胞產(chǎn)生和分泌的膠原纖維組成,對維持心臟正常的形態(tài)和功能起重要作用[7]。心肌膠原纖維相互交織,構(gòu)成一個多層次、多方位、復(fù)雜的三維空間結(jié)構(gòu),心肌細(xì)胞被包圍、固定和活動在這個網(wǎng)絡(luò)之中[8]。有報道心肌ECM中膠原的數(shù)量、組成和結(jié)構(gòu)的變化參與心臟重構(gòu)過程[9],通過調(diào)節(jié)細(xì)ECM的特性和數(shù)量,非心肌細(xì)胞在決定心肌對病理刺激的反應(yīng)方面(如血流動力學(xué)負(fù)荷過重)起重要作用。心臟間質(zhì)膠原分為Ⅰ、Ⅲ 、Ⅳ 、Ⅴ和Ⅵ 型等,其中90%由Ⅰ型和Ⅲ 型膠原構(gòu)成。Ⅰ型抗張強(qiáng)度大,伸展及回彈性小,主要聚合粗纖維;Ⅲ型抗張強(qiáng)度小,具有較大的伸展和回彈性,主要聚合細(xì)纖維。CVMC時Ⅰ型、Ⅲ型膠原大量增生[10]。本研究也發(fā)現(xiàn)CVMC小鼠心肌組織Ⅰ型、Ⅲ型膠原表達(dá)較對照組小鼠明顯增強(qiáng),但其中Ⅰ型膠原增生更加明顯,從而導(dǎo)致Ⅰ/Ⅲ型膠原比例增大。因Ⅰ型膠原抗張強(qiáng)度大,伸展及回彈性小,從而使小鼠心肌順應(yīng)性下降,僵硬度增加。膠原組織緊繞心肌細(xì)胞,心肌細(xì)胞可能因慢性缺氧而死亡或觸發(fā)細(xì)胞凋亡,間質(zhì)毛細(xì)血管床減少,進(jìn)而導(dǎo)致心臟舒縮功能障礙。
纖維化形成是一個緩慢的動態(tài)過程,涉及到細(xì)胞、細(xì)胞因子和ECM等多種因素、多環(huán)節(jié)間相互作用和相互調(diào)節(jié)的復(fù)雜過程,最終結(jié)局是大量ECM沉積。目前普遍認(rèn)為引起心肌膠原重構(gòu)的主要因素是基質(zhì)金屬蛋白酶系統(tǒng)失衡以及一些內(nèi)分泌激素和細(xì)胞因子異常激活。但最新研究發(fā)現(xiàn),趨化因子CXCL12參與了表達(dá)CXCR4成纖維細(xì)胞的活化、增殖、遷移及細(xì)胞外基質(zhì)的分泌等功能,提示CXCL12/CXCR4生物軸在組織纖維化發(fā)病進(jìn)程中發(fā)揮重要作用。CXCL12即基質(zhì)細(xì)胞衍生因子1,是骨髓基質(zhì)細(xì)胞及成骨細(xì)胞所產(chǎn)生的CXC類趨化蛋白,其基因位于10號染色體長臂[11],是CXCR4的唯一配體。CXCR4是由352個氨基酸組成的高度保守的具有7個跨膜結(jié)構(gòu)域的GTP-蛋白藕聯(lián)的跨膜受體,是纖維細(xì)胞的主要趨化因子受體。CXCL12、CXCR4廣泛表達(dá)于多種細(xì)胞及組織,通過作用于趨化因子受體參與多種生理及病理過程,對病原因子的清除、炎癥反應(yīng)、過敏性疾病、免疫系統(tǒng)自身穩(wěn)定、心臟血管發(fā)育、中樞神經(jīng)系統(tǒng)網(wǎng)絡(luò)發(fā)育及腫瘤生長與轉(zhuǎn)移均起著至關(guān)重要的作用[12]。但近年研究發(fā)現(xiàn)[13],成纖維細(xì)胞在肺部的形成與聚集也與趨化因子CXCL12及其受體CXCR4的表達(dá)有關(guān),通過調(diào)節(jié)CXCR4的表達(dá)可以減輕甚至抑制肺纖維化的發(fā)生。Phillips等[14]研究發(fā)現(xiàn)在博來霉素致小鼠肺纖維化的模型及人的肺纖維化病灶中CXCL12/CXCR4生物軸在纖維細(xì)胞向肌成纖維細(xì)胞轉(zhuǎn)化的過程中發(fā)揮了關(guān)鍵作用。Mehrad等[13]報道在博來霉素致小鼠肺纖維化的模型中應(yīng)用抗CXCL12抗體阻斷CXCL12的表達(dá)后,小鼠肺中表達(dá)CXCR4的細(xì)胞明顯減少,且膠原蛋白的沉積和肺纖維化的程度也明顯減輕。近年來還發(fā)現(xiàn)CXCL12/CXCR4生物軸與前列腺的組織纖維化也密切相關(guān)[15,16]。本實驗發(fā)現(xiàn)CVMC小鼠心肌組織中CXCL12、CXCR4蛋白表達(dá)均較對照組顯著增高,并且蛋白含量與心肌組織中CVF呈正相關(guān),此結(jié)果提示CXCL12/CXCR4生物軸可促進(jìn)CVMC心肌纖維的增生,與CVMC心肌纖維化的發(fā)生有關(guān)。
總之,本研究發(fā)現(xiàn)CVMC的病理特征即為心肌間質(zhì)纖維化,且主要表現(xiàn)為Ⅰ、Ⅲ型膠原的增生及其比例的失調(diào)。CXCL12/CXCR4生物軸可促進(jìn)心肌纖維化的發(fā)生、發(fā)展。
[1] Aretz HT. Myocarditis: the Dallas criteria[J]. Hum Pathol, 1987,18(6):619-624.
[2] Nakamura H, Yamamoto T, Yamamura T, et al. Repetitive Coxsackie virus infection induces cardiac dilation in post-myocarditic mice[J]. Jpn Circ J, 1999,63(10):794-802.
[3] 程志清,劉宏飛,張娟,等.小鼠VMC慢性期Th 細(xì)胞分化及清心Ⅱ號干預(yù)作用[J].中西醫(yī)結(jié)合學(xué)報,2007,5(3):318-321.
[4] Rey L, Lambert V, Wattre P, et al. Detection of enteroviruses ribonucleic acid sequences in endomyocardial tissue from adult patients with chronic dilated cardiomyopathy by a rapid RT-PCR and hybridization assay[J]. Med Virol, 2001,64(2):133-140.
[5] Okada I, Matsumori A, Tomioka N, et al. Successive infection ofcoxsackievirus B3 and encephalomyocarditis virus: an animal model of chronic myocarditis[J]. J Pathol, 1992,167(3):341-347.
[6] Feldman AM, McNamara D. Myocarditis[J]. N Engl J Med, 2000,343(19):1388-1398.
[7] Kuwahara F, Kai H, Tokuda K, et al. Transforming growth factor-beta function blocking prevents myocardial fibrosis and diastolic dysfunction in pressure-overloaded rats[J]. Circulation, 2002,106(1):130-135.
[8] Li YY, Feng YQ, Kadokami T, et al. Myocardial extracellular m atrix remodeling in transgenic m ice overexpressing tumor necrosis factor-α can be modulated by anti-tumor necrosis factor-α therapy[J]. Proc Nat1 Acad Sci USA, 2000,97(23):12746-12751.
[9] Thomas CV, Coker, Zellner JL, et al. Increased matrix metauoprot ejnase activity and selective u pregulation in lv myocardium from patients with end-stage dilated cardiomyopathy[J]. Circulation, 1998,97(17):1708-1715.
[10] 王振濤,韓麗華,尚東麗,等.心肌康對慢性VMC小鼠心肌IⅢ型膠原影響的研究[J].中醫(yī)藥學(xué)刊,2004,22(5):859-861.
[11] Broxmeyer HE. Chemokines in hema-topoiesis[J]. Curr Opin Hematol,2008,15(1):49-58.
[12] 崔紅霞,馮一中,顧振綸,等. CXCL12/CXCR4生物軸與特發(fā)性肺纖維化研究進(jìn)展[J].中國藥理學(xué)通報,2010,26(3):297-301.
[13] Mehrad B, Burdick MD, Strieter RM. Fibrocyte CXCR4 regulation as a therapeutic target in pulmonary fibrosis[J]. Int J Biochem Cell Biol, 2009,41(8-9):1708-1718.
[14] Phillips RJ, Burdick MD, Hong K, et al. Circulating fibrocytes traffic to the lungs in response to CXCL12 and mediate fibrosis[J].J Clin. Invest, 2004,114(3):438-446.
[15] Rodríguez-Nieves JA,Patalano SC,Almanza D,et al. CXCL12/CXCR4 axis activation mediates prostate myofibroblast phenoconversion through non-canonical EGFR/MEK/ERK signaling[J]. PLoS One, 2016,11(7):e0159490.
[16] Gharaee-Kermani M,Kasina S,Moore BB,et al.CXC-type chemokines promote myofibroblast phenoconversion and prostatic fibrosis[J]. PLoS One, 2012,7(11):e49278.
Influence of CXCL12/CXCR4 biological axis on myocardial fibrosis in mice with chronic viral myocarditis
GUOChunyan1,HANBo,LIANGHao,ZHANGXiaojing,WANGYi
(1ProvincialHospitalAffiliatedtoShandongUniversity,Jinan250021,China)
Objective To study the relationship between the CXCL12/CXCR4 biological axis and myocardial fibrosis in chronic viral myocarditis (CVMC).Methods Thirty 4-week-old Balb/c mice were randomly divided into the control group (n=10) and CVMC group (n=20). The mice in the CVMC group were infected with Coxsachie virus B3 (CVB3, 1×109/mL) to establish CVMC models on day 0, 14 and 28 with the volume of 0.20, 0.25 and 0.30 mL, respectively. The mice in the control group
the equal volume normal of saline. After anesthesia, the heart rate (HR), left ventricular end-diastolic internal diameter (LVDD), left ventricular end-systolic internal diameter (LVSD), and peak velocity of aorta (Vp) at least 3 consecutive cardiac cycles were measured by echocardiography on day 42. Meanwhile, the ejection fraction (EF) and fractional shortening (FS) were calculated. Mice were killed after echocardiographic analysis.Then we counted the ratio of heart weight to body weight (HW/BW). Heart slides were stained with collagen specific picrosirius red staining or HE staining. The collagen volume fraction (CVF) was calculated. The protein expression of CXCL12 and CXCR4 was determined by Western blotting. The mRNA expression of type I collagen and type Ⅲ collagen was determined by RT-PCR.Results Compared with the control group, the CVF, the mRNA expression of type I collagen and type Ⅲ collagen and the protein expression of CXCL12 and CXCR4 significantly increased in the CVMC group (allP<0.05). The CVF was positively correlated with CXCL12 and CXCR4 protein expression in the CVMC group (r=0.79, 0.60, allP<0.05).Conclusion CXCL12/CXCR4 biological axis is closely related to CVMC myocardial fibrosis.
viral myocarditis, chronic; CXCL12/CXCR4 biological axis; myocardial fibrosis; mice
山東省自然基金面上項目(ZR2012HM073)。
郭春艷(1973-),女,副主任醫(yī)師,研究方向為小兒急性及慢性病毒性心肌炎的診治。E-mail:guochunyan0531@163.com
汪翼(1945-),女,教授,主要從事小兒心肌炎、心肌病以及肥胖癥、糖尿病的早期干預(yù)研究。E-mail:sdjnwangy@163.com
10.3969/j.issn.1002-266X.2017.17.007
R542.2
A
1002-266X(2017)17-0021-04
2017-02-13)
- 山東醫(yī)藥的其它文章
- GeneXpert MTB/RIF在脊柱結(jié)核診斷中的應(yīng)用
- 三維CT 導(dǎo)航輔助下經(jīng)椎間孔椎體間融合術(shù)治療腰椎間盤突出癥的臨床療效及安全性
- 局麻椎間孔鏡下髓核摘除術(shù)患者右美托咪啶聯(lián)合酮咯酸氨丁三醇的鎮(zhèn)痛及鎮(zhèn)靜效果觀察
- 星狀神經(jīng)節(jié)阻滯對H型高血壓患者腹腔鏡下膽囊切除術(shù)圍術(shù)期循環(huán)及腦代謝的影響
- 血壓變異性與缺血性腦白質(zhì)高信號的相關(guān)性
- 大劑量瑞舒伐他汀治療急性心肌梗死患者血清GDF-15、hs-CRP水平變化及臨床意義

