不同能量超聲破壞微泡對(duì)內(nèi)皮細(xì)胞炎癥因子和VEGF表達(dá)的影響
黃馳雄,景遠(yuǎn)文,李海瑞,王世飛,楊莉,賓建平
(南方醫(yī)科大學(xué)南方醫(yī)院,廣州510515)
不同能量超聲破壞微泡對(duì)內(nèi)皮細(xì)胞炎癥因子和VEGF表達(dá)的影響
黃馳雄,景遠(yuǎn)文,李海瑞,王世飛,楊莉,賓建平
(南方醫(yī)科大學(xué)南方醫(yī)院,廣州510515)
目的 探索不同能量超聲破壞微泡對(duì)內(nèi)皮細(xì)胞炎性介質(zhì)和血管內(nèi)皮生長(zhǎng)因子(VEGF)表達(dá)的影響。方法 培養(yǎng)人臍靜脈內(nèi)皮細(xì)胞,使培養(yǎng)液中微泡濃度為1×107/mL,根據(jù)接受超聲能量處理情況將內(nèi)皮細(xì)胞分為0、1.0、2.0、3.0、4.0 MPa 5組。超聲處理1.5 h后采用全自動(dòng)酶標(biāo)儀檢測(cè)活性氧(ROS)表達(dá)熒光強(qiáng)度,8 h后 采用MTT、Western blotting和免疫熒光分別檢測(cè)內(nèi)皮細(xì)胞活性以及VEGF、 P選擇素表達(dá)。同時(shí)2.0 MPa組中加入ROS抑制劑(GSH)或P選擇素抑制劑(rPSLG-Ig),8 h后檢測(cè)VEGF表達(dá)。結(jié)果 與0 MPa組相比,1.0 、2.0 MPa組內(nèi)皮細(xì)胞活性無(wú)變化(P均>0.05),3.0、4.0 MPa組內(nèi)皮細(xì)胞活性降低(P均<0.05)。與0 MPa組相比,1.0、2.0、3.0、4.0 MPa 組ROS、P選擇素和VEGF的表達(dá)增高(P均<0.05)。3.0 MPa組與4.0 MPa組比較ROS、P選擇素和VEGF的表達(dá)無(wú)統(tǒng)計(jì)學(xué)差異(P均>0.05)。2.0 MPa組中加入GSH或rPSLG-Ig后,VEGF表達(dá)低于單純2.0MPa組(P均<0.05)。結(jié)論 超聲破壞微泡可通過(guò)誘導(dǎo)內(nèi)皮細(xì)胞的炎性反應(yīng)增加VEGF的表達(dá),促進(jìn)血管再生;其中超聲能量2.0MPa對(duì)內(nèi)皮細(xì)胞炎性介質(zhì)和VEGF的影響較理想。
內(nèi)皮細(xì)胞;血管生成;超聲;微泡;炎性反應(yīng);血管內(nèi)皮生長(zhǎng)因子
目前,現(xiàn)代再灌注治療手段如搭橋術(shù)、經(jīng)皮介入治療等能較明顯地改善冠心病患者的癥狀及預(yù)后[1],但無(wú)法避免血管再狹窄,對(duì)直徑較小的血管亦無(wú)有效干預(yù)方法[2]。因此,促血管新生治療有望成為現(xiàn)代再灌注治療手段的重要補(bǔ)充。研究顯示,超聲破壞微泡產(chǎn)生的空化效應(yīng)可在體內(nèi)外引起多種生物學(xué)效應(yīng),具有促血管生成的潛能,但較高能量的超聲可能對(duì)細(xì)胞或較脆弱的新生血管產(chǎn)生損傷。血管內(nèi)皮生長(zhǎng)因子(VEGF)是促進(jìn)血管新生的重要因子,P選擇素、活性氧(ROS)等炎性介質(zhì)與VEGF的表達(dá)高度相關(guān)[3]。2016年7~11月,本研究于體外通過(guò)不同能量超聲破壞微泡刺激內(nèi)皮細(xì)胞,以探討其對(duì)細(xì)胞活性和細(xì)胞ROS、P選擇素、VEGF表達(dá)的影響。
1 材料與方法
1.1 細(xì)胞培養(yǎng)及微泡制備 人臍靜脈內(nèi)皮細(xì)胞(HUvE-12)(廣州吉賽生物)用含有10%胎牛血清(FBS)和1%雙抗的DMEM-F12(均為Gibco產(chǎn)品,美國(guó))培養(yǎng)基在37 ℃、CO2濃度為5%的培養(yǎng)箱中培養(yǎng)。細(xì)胞復(fù)蘇后至少傳代3次才用于實(shí)驗(yàn)干預(yù)。采用既往報(bào)道方法[4]制備全氟丙烷脂質(zhì)微泡,使干預(yù)細(xì)胞時(shí)培養(yǎng)基中微泡濃度為1×107/mL。
1.2 細(xì)胞分組及活性檢測(cè) 取對(duì)數(shù)期內(nèi)皮細(xì)胞,胰酶消化后用含10%FBS的DMEM-F12培養(yǎng)液重懸,保持培養(yǎng)液中微泡濃度為1×107/mL。把內(nèi)皮細(xì)胞分為5個(gè)不同超聲能量處理組(0、1.0、2.0、3.0、4.0 MPa組),用超聲空化治療儀進(jìn)行輻照破壞微泡。然后每個(gè)處理組接種3個(gè)復(fù)孔,并設(shè)置3個(gè)空白對(duì)照孔,每孔接種1×104個(gè)細(xì)胞于96孔板。8 h后用MTT試劑盒檢測(cè)吸光度,以空白對(duì)照孔細(xì)胞活性為100%計(jì)算5個(gè)處理組的細(xì)胞活性。
1.3 內(nèi)皮細(xì)胞ROS表達(dá)檢測(cè) 將5×105細(xì)胞接種于6孔板,培養(yǎng)24 h待細(xì)胞貼壁。細(xì)胞分組和微泡濃度同前。超聲干預(yù)后再培養(yǎng)1.5 h,用無(wú)血清培養(yǎng)基洗3次,避光條件下加入含1 μmol/L DCFH-DA的無(wú)血清培養(yǎng)基于37 ℃、5%CO2培養(yǎng)箱中避光孵育20 min。用胰酶把細(xì)胞消化并用200 μL PBS重懸,加入96孔板于全自動(dòng)酶標(biāo)儀下檢測(cè)ROS熒光強(qiáng)度(激發(fā)波長(zhǎng)488 nm,發(fā)射波長(zhǎng)520 nm),每組重復(fù)3次。
1.4 內(nèi)皮細(xì)胞P選擇素表達(dá)檢測(cè) 將5×104細(xì)胞接種于共聚焦培養(yǎng)皿,培養(yǎng)24 h待細(xì)胞貼壁。細(xì)胞分組和微泡濃度同前。超聲干預(yù)后再培養(yǎng)8 h。取出細(xì)胞PBS洗3次,然后用4%的多聚甲醛固定15 min。PBS洗去多聚甲醛,1%的BSA封閉液封閉20 min。用兔抗大鼠P選擇素一抗(1∶300)4 ℃孵育過(guò)夜,洗去一抗,避光條件下用羊抗兔二抗Alexa488(1∶300)孵育30 min。避光洗去二抗,DAPI染色5 min后用PBS洗3次,吸盡皿中的PBS常溫下避光涼干。最后在激光共聚焦顯微鏡下觀察拍照。
1.5 內(nèi)皮細(xì)胞VEGF表達(dá)檢測(cè) 將5×105細(xì)胞接種于60 mm培養(yǎng)皿,培養(yǎng)24 h后待細(xì)胞貼壁。細(xì)胞分組和微泡濃度同前。超聲干預(yù)之后再培養(yǎng)8 h。取出細(xì)胞PBS洗3次,RIPA裂解液提取總蛋白,BCA試劑盒測(cè)蛋白濃度。10%的SDS凝膠電泳1.5 h,將蛋白轉(zhuǎn)至PVDF膜,3%的BSA封閉1 h,一抗孵育4 ℃過(guò)夜。TBST洗3次(5 min/次)后二抗孵育1 h,TBST洗3次(10 min/次)并晾干,最后用ODYSSEY近紅外成像系統(tǒng)曝光條帶。Western blotting方法檢測(cè)5組細(xì)胞VEGF的表達(dá)以及2.0 MPa時(shí)分別加入ROS抑制劑(GSH)或P選擇素抑制劑(rPSLG-Ig)時(shí)內(nèi)皮細(xì)胞VEGF的表達(dá)。

2 結(jié)果
2.1 不同能量超聲破壞微泡對(duì)內(nèi)皮細(xì)胞活性的影響 0、1.0、2.0、3.0、4.0 MPa 5組細(xì)胞活性分別為(99.80±9.15)%、(97.41±8.29)%、(98.64±9.72)%、(75.86±8.71)%、(61.08±7.74)%。與0 MPa組相比,1.0、2.0 MPa組細(xì)胞活性差異無(wú)統(tǒng)計(jì)學(xué)意義(P均>0.05),3.0 MPa組和4.0 MPa組細(xì)胞活性顯著降低(P均<0.05)。同時(shí),4.0 MPa組細(xì)胞活性也顯著低于3.0 MPa組(P<0.05)。
2.2 不同能量超聲破壞微泡對(duì)內(nèi)皮細(xì)胞ROS和P選擇素表達(dá)影響 0、1.0、2.0、3.0、4.0 MPa 5組細(xì)胞ROS熒光強(qiáng)度分別為24.51±6.83、304.36±57.82、1 200.17±98.95、1 905.24±139.83、2 001.64±115.49。3.0 MPa組和4.0 MPa組ROS熒光強(qiáng)度達(dá)到同一平臺(tái)水平,組間差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);其余各組間細(xì)胞ROS熒光強(qiáng)度比較差異有統(tǒng)計(jì)學(xué)意義(P均<0.05)。P選擇素的表達(dá)與ROS的變化趨勢(shì)相同,也隨著超聲強(qiáng)度的增加而增加,3.0 MPa和4.0 MPa時(shí)達(dá)到同一平臺(tái)水平。
2.3 不同能量超聲破壞微泡對(duì)內(nèi)皮細(xì)胞VEGF表達(dá)影響 0 MPa組無(wú)VEGF表達(dá)。隨著超聲強(qiáng)度的增加,VEGF的表達(dá)逐漸增高,但3.0 MPa組和4.0MPa組細(xì)胞VEGF表達(dá)差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);其余各組間細(xì)胞VEGF表達(dá)差異有統(tǒng)計(jì)學(xué)意義(P均<0.05)。在2.0 MPa組中加入GSH或者rPSLG-Ig時(shí),VEGF的表達(dá)相對(duì)于單純2.0 MPa處理組顯著下降(P均<0.05)。見圖1。
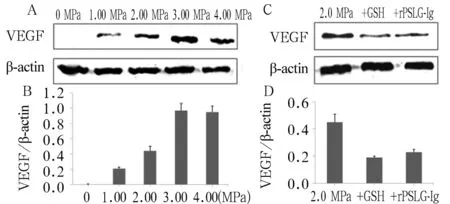
注:A、B:不同超聲能量時(shí)VEGF表達(dá)差異。C、D:2.0 MPa時(shí)加入GSH或rPSLG-Ig VEGF表達(dá)變化。
圖1 超聲破壞微泡對(duì)內(nèi)皮細(xì)胞VEGF表達(dá)量的影響
3 討論
冠狀動(dòng)脈粥樣硬化性心臟病、外周血管病等缺血性疾病發(fā)病率、致殘率高,現(xiàn)代再灌注治療手段如搭橋術(shù)、經(jīng)皮介入治療等能較明顯地改善疾病的癥狀及預(yù)后,但仍具有一定局限性,如血管再狹窄、無(wú)法干預(yù)直徑較小的血管等。促血管新生治療亦被稱為分子搭橋[5],有望成為上述現(xiàn)代再灌注治療手段的重要補(bǔ)充。
目前促血管新生的主要方法是外源性注射干細(xì)胞[6]、促血管形成因子或相關(guān)基因[7],但因靶向性較低的問(wèn)題,其促血管生成的效果欠理想。超聲破壞微泡產(chǎn)生的空化效應(yīng)可在體內(nèi)外引起多種生物學(xué)效應(yīng),具有促血管生成的潛能。Song等[8]研究發(fā)現(xiàn),超聲破壞微泡可促進(jìn)大鼠缺血后肢的血管新生、改善缺血組織血供,但對(duì)其具體機(jī)制尚不清楚。
既往研究提示,低能超聲破壞微泡產(chǎn)生的空化效應(yīng)可誘導(dǎo)細(xì)胞的炎性反應(yīng),ROS、P選擇素表達(dá)增高[9];亦有研究證實(shí),P選擇素、ROS等炎性介質(zhì)增高與VEGF的表達(dá)相關(guān)[3];同時(shí)大量研究已證實(shí),VEGF可有效促進(jìn)血管新生、改善組織血供[10]。因此我們假設(shè)超聲破壞微泡可通過(guò)誘導(dǎo)內(nèi)皮細(xì)胞的炎性反應(yīng)而增加VEGF的表達(dá)量,從而促進(jìn)缺血組織的血管生成。Song等[8]在大鼠后肢缺血模型中發(fā)現(xiàn)超聲破壞微泡可促進(jìn)大鼠后肢的血管生成、增加肌肉血流灌注,但并未對(duì)具體機(jī)制進(jìn)行闡明。本研究發(fā)現(xiàn),超聲破壞微泡可促進(jìn)VEGF的表達(dá),這與Nazer 等[11]研究結(jié)果相似,但Nazer 等未對(duì)VEGF表達(dá)增加的相關(guān)分子機(jī)制進(jìn)行研究。從理論上而言,較高能量的超聲除可能對(duì)脆弱的新生血管產(chǎn)生破壞外,也可能對(duì)細(xì)胞產(chǎn)生不可逆損傷,導(dǎo)致細(xì)胞壞死。因此,探討既能有效促進(jìn)血管新生而又不產(chǎn)生血管損傷及細(xì)胞壞死的超聲能量十分重要。
我們發(fā)現(xiàn),在一定范圍內(nèi)(≤ 2.0 MPa)隨著能量的增加,超聲破壞微泡使內(nèi)皮細(xì)胞ROS、P選擇素和VEGF的表達(dá)量逐漸增高,且細(xì)胞活性未發(fā)生明顯改變;當(dāng)能量為3.0 MPa時(shí),這三種分子的表達(dá)量進(jìn)一步增高,但細(xì)胞活性明顯下降;當(dāng)能量為4.0 MPa時(shí),這三種分子的表達(dá)量不再增高,且細(xì)胞活性進(jìn)一步下降。我們還發(fā)現(xiàn),當(dāng)加入ROS和P選擇素抑制劑后,VEGF表達(dá)量明顯下降。這提示超聲破壞微泡可通過(guò)誘導(dǎo)內(nèi)皮細(xì)胞的炎性反應(yīng)而增加VEGF的表達(dá),2.0 MPa是較理想的超聲能量。
需要說(shuō)明的是,本研究?jī)H局限于體外的內(nèi)皮細(xì)胞試驗(yàn),未進(jìn)行相關(guān)動(dòng)物研究。我們后續(xù)研究擬在大鼠缺血性心臟病模型中探討超聲破壞微泡促進(jìn)血管生成的具體機(jī)制及最佳能量,為超聲破壞微泡促進(jìn)血管生成用于治療缺血性疾病提供理論依據(jù)。
[1] 王潁驊, 薛松. 冠狀動(dòng)脈搭橋與冠脈介入治療的比較[J]. 國(guó)際心血管病雜志, 2007,34(2):104-107.
[2] 宋杰麗, 曾錦培, 陳次濱. 血漿總膽紅素濃度與經(jīng)皮冠狀動(dòng)脈介入治療后支架內(nèi)再狹窄的研究[J]. 嶺南心血管病雜志, 2014,20(3):293-296.
[3] 張清華, 陳玲, 蔣知新, 等. 炎癥細(xì)胞因子對(duì)人臍靜脈內(nèi)皮細(xì)胞分泌VEGF、ICAM-1的影響[J]. 心血管康復(fù)醫(yī)學(xué)雜志, 2009,18(2):93-96.
[4] 潘弟儀, 楊莉, 侯連兵. 超聲造影劑全氟丙烷脂質(zhì)微球的制備與評(píng)價(jià)[J]. 中國(guó)藥學(xué)雜志, 2012,47(10):818-821.
[5] 關(guān)勤, 劉志勇. 分子搭橋技術(shù)研究進(jìn)展[J]. 東南大學(xué)學(xué)報(bào)(醫(yī)學(xué)版), 2006,25(3):212-215.
[6] 李曉玲, 朱旅云, 宋光耀. 臍帶間充質(zhì)干細(xì)胞促血管新生在治療下肢缺血中的研究與應(yīng)用[J]. 中國(guó)組織工程研究, 2015,19(36):5878-5885.
[7] 李玉玲, 李紅, 胡明均, 等. 腺病毒裝載人vegf-165基因轉(zhuǎn)染的間充質(zhì)干細(xì)胞對(duì)下肢缺血性壞死大鼠模型促血管新生的作用[J]. 中國(guó)實(shí)驗(yàn)血液學(xué)雜志, 2010,18(6):1568-1573.
[8] Song J. Microvascular remodeling and accelerated hyperemia blood flow restoration in arterially occluded skeletal muscle exposed to ultrasonic microbubble destruction[J]. AJP: Heart Circulatory Physiol, 2004,287(6):H2754-H2761.
[9] 房良華, 姜藻, 顧曉怡. 低頻超聲聯(lián)合微泡劑對(duì)肝癌細(xì)胞SMMC-7721的生物學(xué)效應(yīng)[J]. 東南大學(xué)學(xué)報(bào)(醫(yī)學(xué)版), 2008,27(4):264-267.
[10] Senturk B, Cubuk MO, Ozmen MC, et al. Inhibition of VEGF mediated corneal neovascularization by anti-angiogenic peptide nanofibers[J]. Biomaterials, 2016,107:124-132.
[11] Nazer B, Ghahghaie F, Kashima R, et al. Therapeutic ultrasound promotes reperfusion and angiogenesis in a rat model of peripheral arterial disease[J]. Circ J, 2015,79(9):2043-2049.
Effects of different pressure of ultrasound-targeted microbubble destruction on expression of inflammatory factor and VEGF
HUANGChixiong,JINGYuanwen,LIHairui,WANGShifei,YANGLi,BINJianping
(NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China)
Objective To explore the influence of different pressure of ultrasound-targeted microbubble destruction on the expression of inflammatory factor and vascular endothelial growth factor (VEGF) in human umbilical vein endothelial cells (HUvE-12 cells).Methods We cultured HUvE-12 cells in the DMEM-F12 medium containing 1×107/mL microbubbles. HUvE-12 cells were divided into 5 groups exposed to different ultrasound pressure (0, 1.0, 2.0, 3.0 and 4.0 MPa). After 1.5 h of ultrasound exposure, we detected the expression of reactive oxygen species (ROS) by using full-automatic microplate reader. At 8 h after corresponding interventions, the cell viability, P-selectin and VEGF expression was determined by MTT, immunofluorescence and Western blotting, respectively. Additionally, ROS inhibitor (GSH) or P-selectin inhibitor (rPSLG-Ig) were added into the 2.0 MPa group, and VEGF expression was determined by Western blotting, respectively. Results The cell viability presented to be no difference in the 1.0 MPa and 2.0 MPa groups as compared with 0 MPa group (all P>0.05), while it decreased significantly in the 3.0 MPa and 4.0 MPa groups (allP<0.05). The expression of ROS, P-selectin and VEGF increased in the 1.0, 2.0, 3.0, and 4.0 MPa groups as compared with that of the 0 MPa group (allP<0.05). No difference was found in the expression of ROS, P-selectin and VEGF between the 4.0 MPa and 3.0 MPa groups (allP>0.05). When GSH or rPSLG-Ig were added in the 2.0 MPa group , the expression of VEGF was inhibited significantly as compared with that of 2.0 MPa applied only (allP<0.05). Conclusion Ultrasound-targeted microbubble destruction can increase the expression of VEGF through inducing inflammatory reaction and promote angiogenesis, and 2.0 MPa is the optimal ultrasound pressure.
endotheliocytes; angiogenesis; ultrasound; microbubbles; inflammatory reaction; vascular endothelial growth factor
國(guó)家自然科學(xué)基金面上項(xiàng)目(81571698)。
黃馳雄(1991-),男,在讀碩士,研究方向?yàn)槌曃⑴菰诩膊≡\斷和治療中的應(yīng)用。E-mail:435683314@qq.com
賓建平(1964-),男,主任醫(yī)師,教授,博士生導(dǎo)師,研究方向?yàn)槌曃⑴菰诩膊≡\斷和治療中的應(yīng)用。E-mail:jianpingbin@126.com
10.3969/j.issn.1002-266X.2017.17.002
R541.4
A
1002-266X(2017)17-0004-03
2016-12-14)
- 山東醫(yī)藥的其它文章
- GeneXpert MTB/RIF在脊柱結(jié)核診斷中的應(yīng)用
- 三維CT 導(dǎo)航輔助下經(jīng)椎間孔椎體間融合術(shù)治療腰椎間盤突出癥的臨床療效及安全性
- 局麻椎間孔鏡下髓核摘除術(shù)患者右美托咪啶聯(lián)合酮咯酸氨丁三醇的鎮(zhèn)痛及鎮(zhèn)靜效果觀察
- 星狀神經(jīng)節(jié)阻滯對(duì)H型高血壓患者腹腔鏡下膽囊切除術(shù)圍術(shù)期循環(huán)及腦代謝的影響
- 血壓變異性與缺血性腦白質(zhì)高信號(hào)的相關(guān)性
- 大劑量瑞舒伐他汀治療急性心肌梗死患者血清GDF-15、hs-CRP水平變化及臨床意義

