新型雌激素受體GPR30激活HER2-ERK1/2促進乳腺癌MCF-7細胞遷移和侵襲*
阮姝琴,代曉燕
(1.重慶市人民醫院腫瘤血液科 400013;2.第三軍醫大學大坪醫院野戰外科研究所腫瘤科實驗室,重慶 400042)
論著·基礎研究
新型雌激素受體GPR30激活HER2-ERK1/2促進乳腺癌MCF-7細胞遷移和侵襲*
阮姝琴1,代曉燕2△
(1.重慶市人民醫院腫瘤血液科 400013;2.第三軍醫大學大坪醫院野戰外科研究所腫瘤科實驗室,重慶 400042)
[摘要] 目的 探討G蛋白耦聯受體30 (GPR30)受體在低表達表皮生長因子受體2(HER2)的乳腺癌MCF-7細胞中激活HER2的分子機制和生物學意義。方法 用Western blot的方法檢測17-β-雌二醇(E2)、三苯氧胺(TAM)的活性代謝產物(4-OHT)或GPR30激動劑(G-1)作用于乳腺癌MCF-7細胞后HER2和下游信號分子ERK1/2磷酸化水平的變化。在MCF-7細胞被不同的抑制劑GPR30拮抗劑(G-15)、EGFR酪氨酸激酶抑制劑(AG1478)、HER2酪氨酸激酶抑制劑(AG825)、Src家族激酶抑制劑(PP2)或MMP抑制劑(GM6001)預處理2 h后,再次檢測HER2和ERK1/2的磷酸化水平變化。最后用Transwell方法檢測G-1引起的MCF-7細胞遷移和侵襲能力的變化。結果 MCF-7細胞在用E2、4-OHT和G-1處理后,HER2和ERK1/2的磷酸化水平增加,該變化在用G-15、AG1478、AG825、PP2或GM6001預處理后受到抑制。而G-1引起的MCF-7細胞遷移和侵襲能力的增強也能被G-15、AG1478、AG825、PP2或GM6001抑制。結論 GPR30通過激活HER2-ERK1/2信號轉導途徑可促進MCF-7細胞的遷移和侵襲。
乳腺腫瘤;G蛋白耦聯受體30;表皮生長因子受體2;細胞運動;侵襲
乳腺癌是全世界女性發病率第一的惡性腫瘤。內分泌治療是雌激素受體(estrogen receptor,ER)陽性乳腺癌患者的主要治療手段之一,三苯氧胺(tamoxifen,TAM)是絕經前此類患者的最常用藥物,但其中約一半的患者最終對TAM耐藥,研究發現ER和表皮生長因子受體(epidermal growth factor receptor,EGFR/ErbB/HER)信號系統之間的相互作用參與了耐藥機制的形成[1]。ErbBs系統包括配體和受體兩大部分,受體部分即ErbBs受體家族,目前成員包括:EGFR/ErbB1、HER2/ErbB2、HER3/ErbB3、HER4/ErbB4。其中HER2在25%~30%的乳腺癌存在過表達,該類乳腺癌表現為更具侵襲性且對內分泌治療反應差。已有研究發現較長時間使用TAM后,乳腺癌細胞發生HER2過表達且對TAM發生耐藥[2]。
G蛋白耦聯受體30 (G protein-coupled receptor 30,GPR30)屬于GPCR家族成員,由G蛋白耦聯雌激素受體(G protein-coupled estrogen receptor,GPER)基因編碼,因其與雌激素有高度親和力而被歸類為新型ER[3]。有研究發現,GPR30和EGFR之間存在信號的正反饋,導致乳腺癌的惡性表型增加且對內分泌治療耐藥[4-5]。GPR30和HER2之間相關性的研究仍少見報道,僅在對乳腺癌組織樣本的免疫組織化學研究中發現二者的表達存在正相關[6]。本課題組前期研究發現,HER-3的配體heregulin-β1增加了GPR30的表達并通過激活HER2/HER3-MAPK/ERK途徑促進乳腺癌細胞的遷移和侵襲,并且這種效應不依賴于ER的表達狀態[7-8]。本研究將探討在非過表達HER2的乳腺癌MCF-7細胞中激活GPR30后,HER2及其下游信號分子的變化,并進一步檢測MCF-7細胞遷移和侵襲能力的改變,旨在為乳腺癌轉移及內分泌耐藥的形成機制提供新的解釋。
1 材料與方法
1.1 材料 (1)細胞株:人乳腺癌細胞株MCF-7購自中國科學院典型培養物保藏委員會細胞庫,使用添加10%胎牛血清(FBS)的MEM培養液,培養于含5%CO2的飽和濕度37 ℃恒溫培養箱中,每隔2~3 d傳代。(2)主要試劑:MEM培養液購自GIBCO。GPR30兔抗人多克隆抗體和ERK2兔抗人多克隆抗體購自ABCAM公司,HER2兔抗人單克隆抗體、磷酸化Erk1 (pT202/pY204)/Erk2 (pT185/pY187) 兔抗人單克隆抗體、磷酸化EGFR (pY1068) 兔抗人單克隆抗體購自Epitomics公司,磷酸化HER2兔抗人單克隆抗體(pY1221/pY1222)購自CST公司。EGFR兔抗人多克隆抗體購自Biovision;α-tublin鼠抗兔單克隆抗體購自Beyotime。17-β-雌二醇(E2)、TAM的活性代謝產物(4-OHT)、HER2酪氨酸激酶抑制劑(AG825)、Src家族激酶抑制劑(PP2)、MMP抑制劑(GM6001) 購自Sigma-Aldrich;EGFR酪氨酸激酶抑制劑(AG1478) 購自CST;GPR30激動劑(G-1) 和抑制劑GPR30拮抗劑(G-15)購自Merck。M-PER哺乳動物蛋白提取試劑盒和BCA蛋白分析試劑盒購自Thermo scientific,毛細管電泳-電化學發光法(EZ-ECL)檢測試劑盒(ECL A液+ECL B液)購自Bioind,Transwell小室購自Millipore,Matrigel購自BD。
1.2 方法
1.2.1 Western blot法檢測蛋白表達 按說明書提取各細胞株總蛋白,按照BCA蛋白定量試劑盒操作說明測定蛋白濃度,樣品均定量為5 g/L,每條泳道上樣60 μg 蛋白,經12% 十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),電壓80 V經80 min電轉移至PVDF膜。5% 脫脂奶粉封閉120 min,加入一抗,4 ℃ 孵育過夜。TBST(Tris-Buffered Saline and Tween 20)洗膜后,用二抗室溫孵育90 min,TBST清洗,ECL發光并以凝膠顯像儀顯像。
1.2.2 Transwell法檢測細胞遷移和侵襲能力 細胞用只含1% FBS的無酚紅培養基培養24 h后,再換用加入處理藥物的無酚紅無血清培養基培養24 h。接下來,細胞被胰酶消化,磷酸鹽緩沖液(PBS)清洗并用相應的含有1%牛血清清蛋白(BSA)的培養基重懸。以總細胞數1×105的200 μL并含有處理藥物的培養基加于Transwell小室的上室,下室也加入含有10%FBS的400 μL無酚紅培養基,并在37 ℃ 5%CO2的條件下孵育48 h。侵襲實驗與遷移實驗不同之處在于上室的聚碳酸酯膜上表面預先用40 μL Matrigel(以matrigel∶培養基為1∶3的比例配制)包被。在孵育48 h后,先將上室的多余培養基小心吸出,然后將上室浸入4%多聚甲醛固定20 min,再浸入0.1% 結晶紫內染色30 min,接著用小棉簽小心擦凈上室膜上表面,而下表面附著的細胞則為穿膜的細胞。再在倒置顯微鏡下選擇8個視野計數,取其平均數進行分析。
1.2.3 不同藥物處理后MCF-7細胞的HER2磷酸化水平檢測 (1)分別用10 nmol/L E2、100 nmol/L TAM代謝活性產物4-OHT及1 μmol/L GPR30特異性激動劑G-1,1 μmol/L GPR30的特異性拮抗劑G-15處理MCF-7細胞,48 h后檢測HER2磷酸化水平;(2)先用G-15預處理2 h后,再加入E2、4-OHT或G-1處理MCF-7細胞,48 h后檢測HER2磷酸化水平;(3)先用10 μmol/L的AG1478、AG825、PP2或GM6001預處理2 h后,再加入G-1處理MCF-7細胞,48 h后檢測EGFR、HER2和ERK1/2的磷酸化水平;(4)用G-1處理MCF-7細胞,在0、10、20、30、45、60 min后分別檢測EGFR、HER2和ERK1/2的磷酸化水平。
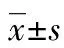
2 結 果
2.1 GPR30信號在乳腺癌細胞MCF-7中反式激活HER2 MCF-7細胞同時表達經典ER和GPR30,但不過表達HER2,用10 nmol/L E2,100 nmol/L TAM代謝活性產物4-OHT,以及1 μmol/L GPR30特異性激動劑G-1處理MCF-7細胞后,HER2磷酸化水平均增加,但是1 μmol/L GPR30的特異性拮抗劑G-15并沒有引起這種變化(圖1)。在用G-15預處理2 h后,加入4-OHT或G-1均未引起HER2磷酸化增加,而E2引起的HER2磷酸化也被部分抑制,見圖2。

圖1 不同藥物處理48 h后HER2磷酸化水平

圖2 G-15預處理后再用不同藥物處理48 h后的HER2磷酸化水平

1:標記物;2:G-1;3:AG825;4:AG1478;5:PP2;6:GM6001。
2.2 EGFR參與了GPR30反式激活HER2的機制 EGFR酪氨酸激酶抑制劑AG1478不僅抑制了G-1引起的EGFR激酶活性及其下游的ERK1/2激活,同時也部分抑制了G-1引起的HER2磷酸化。而HER2酪氨酸激酶抑制劑AG825雖然明顯抑制了HER2的激活,但僅部分抑制了G-1引起的EGFR和ERK1/2磷酸化。實驗還發現Src家族激酶抑制劑PP2或MMP抑制劑GM6001不僅部分抑制了G-1引起的EGFR酪氨酸激酶磷酸化,也部分抑制了G-1引起的HER2激活(圖3)。而G-1引起EGFR、HER2和ERK1/2的持續激活,在加入G-1后10 min即能檢測到并維持至少2 h。GPR30信號在MCF-7細胞引起EGFR、HER2、ERK1/2 的持續激活,見圖4。
2.3 GPR30信號對HER2的激活促進MCF-7細胞的遷移和侵襲 G-1能明顯促進MCF-7細胞的遷移和侵襲(P<0.05);而用G-15、AG1478、AG825、PP2或 GM6001預處理2 h后,G-1促進MCF-7細胞遷徙和侵襲的能力受到部分抑制(P<0.05),見圖5、6。

圖4 GPR30 信號在MCF-7細胞引起EGFR、HER2、ERK1/2 的持續激活

圖5 G-1和各種信號通路抑制劑對MCF-7細胞遷移和侵襲能力的影響

a:P<0.05,與不加G-1比較。
3 討 論
GPR30屬于GPCR,雌激素或其他配體與其結合后,后者被激活并活化其耦聯G蛋白,解離出αβγ亞基進而激活Src相關酪氨酸激酶,接著活化基質金屬蛋白酶(MMPs)促使肝素結合表皮生長因子(HB-EGF)釋放,后者反式激活EGFR,隨后快速活化MAPKs-ERK1/2和PI3K/Akt途徑,繼而參與細胞的增殖、遷移和分化等[9]。已有研究在宮頸癌和乳腺癌細胞中發現EGFR的配體EGF、轉化生長因子(TGF)-α能通過EGFR-MAPK信號途徑上調GPR30的表達[4]。本課題組前期研究證實HER3的配體heregulinβ-1能通過HER2/HER3-MAPK/ERK通路上調GPR30表達[7-8]。本研究中進一步發現GPR30不僅能反式激活EGFR,也能在EGFR參與下激活HER2及其下游MAPK/ERK信號途徑。因此,在EGFR系統和GPR30之間存在信號的正反饋,不斷放大下游信號。大量的文獻已經證明雌激素能激活EGFR和HER2[1]。與經典ER不同的是,E2和TAM都是GPR30的激動劑,因此在表達GPR30的ER陽性的乳腺癌細胞,TAM作為ER的拮抗劑仍然可以激活GPR30,導致雌激素相關的信號應答,從而對TAM耐藥[10-11]。
HER2的配體迄今為止還未被發現,仍是孤兒受體。在HER2過表達的細胞,HER2能自身形成同二聚體激活下游信號途徑。在非過表達HER2的細胞,HER2也能和其他HER家族成員形成功能性的異二聚體[12]。如為了獲得完全的癌基因能力,HER2可以和EGFR形成異二聚體發生相互作用從而激活下游信號途徑[13]。有研究發現,讓MCF-7細胞過表達HER2后,ER和EGFR(或HER2)受體間的相互激活增加從而導致了下游信號途徑的進一步激活,最終對TAM抑制作用的應答減少[11]。本研究結果提示,在HER2并不過表達的乳腺癌細胞,GPR30信號引起的HER-2磷酸化需要EGFR激酶活性的參與。
有研究表明,GPCR可以調節HER2表達導致HER2激活增加。在人乳腺癌組織中,HER2表達和GPR30呈正相關[6]。本課題組前期研究結果表明,HER2上調GPR30表達與ER狀態無關。在本研究中,GPR30信號并不上調HER2表達,但能激活HER2。過去的研究主要集中于HER表達水平改變的生物學意義,但HER酪氨酸激酶磷酸化才是該類受體活化并發揮生物學功能的信號標志,因此活化形式的受體比受體本身的表達水平能傳達更多的信息。如磷酸化形式的人類EGFR可能與乳腺癌患者預后有潛在的作用。單因素分析研究發現,磷酸化的EGFR(pEGFR)、HER2和HER3與較差的無病生存率呈正相關[14]。在HER2陰性和HER2陽性患者中比較,磷酸化HER2與總生存期顯著負相關。在淋巴結陽性患者中,磷酸化的HER2對預后判斷也有價值[13]。因此,GPR30信號激活HER2應該對乳腺癌的生物學行為的影響具有更重要的意義。本課題前期對乳腺癌術后病理組織的研究,揭示GPR30與磷酸化HER2的表達呈強相關性,且GPR30和磷酸化HER2表達在淋巴結轉移組明顯高于淋巴結未轉移組[15]。本研究發現在MCF-7細胞中,GPR30信號引起EGFR、HER2及ERK1/2持久的激活,并促進了MCF-7細胞的遷移和侵襲。
因此,雌激素信號系統和ErbBs之間存在復雜的反饋機制,本研究將有助于理解兩個系統之間的相互作用現象和乳腺癌內分泌治療耐藥機制,并為建立新的乳腺癌治療方法和途徑提供新的理論基礎。
[1]Osborne CK,Schiff R.Mechanisms of Endocrine Resistance in Breast Cancer[J].Annu Rev Med,2011,62(1):233-247.
[2]Cui JJ,Germer K,Wu TY,et al.Cross-talk between HER2 and MED1 regulates tamoxifen resistance of human breast cancer cells[J].Cancer Res,2014,21(72):5625-5634.
[3]Zimmerman MA,Budish RA,Kashyap S,et al.GPER-novel membrane oestrogen receptor[J].Clin Sci (Lond),2016,130(12):1005-1016.
[4]Lappano R,De Marco P,De Francesco EM,et al.Cross-talk between GPER and growth factor signaling[J].J Steroid Biochem,2013,137(18):50-56.
[5]Sjostrom M,Hartman L,Grabau D,et al.Lack of G protein-coupled estrogen receptor(GPER) in the plasma membrane is associated with excellent long-term prognosis in breast cancer[J].Brest Cancer Res Tr,2014,145 (1):61-71.
[6]Filardo EJ,Graeber CT,Quinn JA,et al.Distribution of GPR30,a seven membrane-spanning estrogen receptor,in primary breast cancer and its association with clinicopathologic determinants of tumor progression[J].Clin Cancer Res,2006,12(21):6359-6366.
[7]Ruan SQ,Wang ZH,Wang SW,et al.Heregulin-β1-induced GPR30 upregulation promotes the migration and invasion potential of SkBr3 breast cancer cells via ErbB2/ErbB3-MAPK/ERK pathway[J].Biochem Biophys Res Commun,2012,420(2):385-390.
[8]Ruan SQ,Wang SW,Wang ZH,et al.Regulation of HRG-β1-induced proliferation,migration and invasion of MCF-7 cells by upregulation of GPR30 expression[J].Mol Med Rep,2012,6(1):131-138.
[9]Filardo EJ,Quinn JA,Bland KI,et al.Estrogen-induced activation of Erk-1 and Erk-2 requires the G protein-coupled receptor homolog,GPR30,and occurs via trans-activation of the epidermal growth factor receptor through release of HB-EGF[J].Mol Endocrinol,2000,14(10):1649-1660.
[10]Marjon NA,Hu C,Hathaway HJ,et al.G protein-coupled estrogen receptor regulates mammary tumorigenesis and metastasis[J].Mol Cancer Res,2014,12(11):1644-1654.
[11]Shou J,Massarweh S,Osborne CK,et al.Mechanisms of tamoxifen resistance:increased estrogen receptor-HER2/neu cross-talk in ER/HER2-positive breast cancer[J].J Natl Cancer I,2004,12(96):926-935.
[12]Johnston S,Basik M,Hegg R,et al.Inhibition of EGFR,HER2,and HER3 signaling with AZD8931 in combination with anastrozole as an anticancer approach:Phase Ⅱ randomized study in women with endocrine-therapy-naive advanced breast cancer[J].Breast Cancer Res Treat, 2016,160(1):91-99.
[13]DeFazio-Eli L,Strommen K,Trang DP,et al.Quantitative assays for the measurement of HER1-HER2 heterodimerization and phosphorylation in cell lines and breast tumors:applications for diagnostics and targeted drug mechanism of action[J].Breast Cancer Res,2011,2(13):1-18.
[14]Frogne T,Laenkholm AV,Lyng MB,et al.Determination of HER2 phosphorylation at tyrosine 1221/1222 improves prediction of poor survival for breast cancer patients with hormone receptor-positive tumors[J].Breast Cancer Res,2009,11(1):1-14.
[15]阮姝琴,李剛,王善偉,等.乳腺癌GPR30、HRG1和HER2表達與淋巴結轉移關系的研究[J].重慶醫學,2015,44(7):878-880.
GPR30 promotes MCF-7 breast cancer cell migration and invasion by activating HER2-ERK1/2 signaling pathway*
RuanShuqin1,DaiXiaoyan2△
(1.DepartmentofOncologyandHematology,ChongqingMunicipalPeople′sHospital,Chongqing400013,China; 2.LaboratoryRoom,DepartmentofOncology,DapingHospital,ResearchInstituteofFieldSurgery,ThirdMilitaryMedicalUniversity,Chongqing400042,China)
[Abstract] Objective To study the molecular mechanism and biological significance of GPR30 activating HER2 in MCF-7 breast cancer cells with low expresses HER2.Methods Western blot was adopted to examine the phosphorylation of HER2 and the downstream signaling molecular ERK1/2 after 17-β-estradiol(E2),4-OHT(the active metabolite of tamoxifen) or G-1(the GPR30 agonist) treatment in MCF-7 cells.After different inhibitors such as G-15(the GPR30 antagonist),AG1478(EGFR tyrosine inhibitor),AG825 (HER2 tyrosine inhibitor),PP2 (Src family kinase inhibitor)or GM6001 (MMP inhibitor) pretreated for 2 h,the phosphorylation of HER2 and ERK1/2 were further analyzed.Finally,the altered migration and invasive capability of MCF-7 cells were detected by Transwell method.Results HER2 and ERK1/2 were activated in MCF-7 cells after E2,4-OHT or G-1 treatment and these changes could be inhibited by G-15,AG1478,AG825,PP2 or GM6001 pretreatment.The enhancement of G-1-induced migration and invasion ability in MCF-7 cells could also be inhibited by those inhibitors too.Conclusion GPR30 promotes the migration and invasion of MCF-7 cells through activating HER2-ERK1/2 signal transduction pathway.
breast neoplasms;G protein-coupled receptor 30;human epidermal growth factor receptor-2;cell movement;invasion
10.3969/j.issn.1671-8348.2017.09.005
2013年重慶市衛生局醫學科研資助項目(2013-2-111);2013年重慶市渝中區科技計劃項目(20130144)。 作者簡介:阮姝琴(1978-),副主任醫師,博士,主要從事惡性腫瘤發病機制和個體化治療的研究。△
,E-mail:sqruan@163.com。
R737.9
A
1671-8348(2017)09-1168-04
2016-08-18
2016-11-01)

