羥基磷灰石/殼聚糖-轉化生長因子-β1復合材料對糖尿病兔種植體周圍Runx-2/ALP/OC基因的影響*
劉星宇,雷婷婷,茍詩然,鄭立舸,郭 玲,牟雁東
(1.西南醫科大學附屬口腔醫院修復科/西南醫科大學口頜面修復重建和再生實驗室,四川瀘州 646000;2.四川大學華西口腔醫院/口腔疾病研究國家重點實驗室,成都 610041;3.西南醫科大學附屬醫院規劃財務部,四川瀘州 646000)
論著·基礎研究
羥基磷灰石/殼聚糖-轉化生長因子-β1復合材料對糖尿病兔種植體周圍Runx-2/ALP/OC基因的影響*
劉星宇1,2,雷婷婷3,茍詩然1,鄭立舸2△,郭 玲1,牟雁東2
(1.西南醫科大學附屬口腔醫院修復科/西南醫科大學口頜面修復重建和再生實驗室,四川瀘州 646000;2.四川大學華西口腔醫院/口腔疾病研究國家重點實驗室,成都 610041;3.西南醫科大學附屬醫院規劃財務部,四川瀘州 646000)
目的 將制備的羥基磷灰石/殼聚糖-轉化生長因子-β1緩釋微球復合涂層種植體運用于糖尿病兔脛骨,探討其周圍Runx-2/ALP/OC基因表達的改變,從分子水平評估該種植體的成骨性。方法 制備復合涂層種植體,運用掃描電鏡(SEM)分析其表面形貌。并建立SPF 級新西蘭兔 2 型糖尿病模型,分別在其脛骨干骺端植入種植體,分別于術后 4、8、12周,取出帶種植體周圍骨組織,采用實時熒光定量PCR(RT-PCR)分別檢測普通圖和糖尿病兔在不同種植體植入后Runx-2、堿性磷酸酶(ALP)、骨鈣素(OC)、晚期糖基化終末產物(AGEs)的表達量。結果 Runx-2、ALP、OC在改性涂層種植體表面的mRNA表達在同一時間點上,改性種植體組的表達量高于普通種植體組;不同時間點上,使用改性種植體的Runx-2、ALP、OC的基因表達量增加高于普通種植體,正常兔改性種植體基因表達最高。結論 復合涂層種植體能促進高糖環境下Runx-2/ALP/OC基因表達,具有一定的臨床運用前景。
糖尿病;逆轉錄聚合酶鏈反應;種植體;表面改性
種植義齒是目前治療牙列缺損或缺失的較為理想的修復方式,而糖尿病(DM)作為一種全身性疾病成為種植手術的相對禁忌證,如何提高DM患者種植體的骨結合是目前一個急需解決的問題。本實驗在前期實驗[1]的基礎上,對羥基磷灰石/殼聚糖-轉化生長因子-β1緩釋微球復合涂層種植體進行進一步的研究,將其運用于DM兔上,驗證其成骨效能,為今后的臨床運用提供一定的實驗依據。
1 材料與方法
1.1 材料 實驗動物:6月齡健康雄性新西蘭大白兔(西南醫科大學實驗動物中心)。實驗試劑與材料:納米羥基磷灰石(HA Sigma,美國);明膠粉劑(Sigma,美國);TGF-β1及ELISA試劑盒(Cloud-clone,美國);四氧嘧啶(Sigma,美國);精蛋白長效胰島素(30R諾和諾德中國制藥有限公司);血糖儀及配套血糖試紙(羅氏卓越血糖儀);自行設計種植體(3.3 mm×4.0 mm)。實驗儀器:QUANTA 200掃描電子顯微鏡(SEM,FEI,荷蘭);微弧氧化電源(中南民大等離子體研究所);低溫離心機(C2500,湖南湘儀實驗儀器廠)熱循環儀(TCA0096 Thermo Fisher,美國);實時熒光定量PCR(RT-PCR)儀(PIKORed 9,Thermo Fisher,美國)。
1.2 方法
1.2.1 HA/CS-TGF-β1緩釋微球復合涂層種植體的制備 HA/CS-TGF-β1緩釋微球復合涂層的制備見前置實驗,運用此方式,將復合涂層加載于種植體表面[1]。
1.2.2 動物建模及分組 選取雄性的新西蘭大白兔共29只,體質量為(2.79±0.24)kg。以100 mg/kg的計量計算并經耳緣靜脈緩慢注射新鮮配制的5%四氧嘧啶溶液。于藥物注射后的2、4、6 h 分別于新西蘭兔的皮下注射 5%葡萄糖溶液3 mL。建模期間,每天檢測血糖1次,待實驗動物血糖穩定后每3天檢測血糖1次。以平均每日血糖穩定于 13.9 mmol/L(25 mg/L)以上為建模成功。將建模成功的實驗動物24只分為如下4組,A組(正常兔普通種植體),B組(正常兔改性種植體),C組(DM普通種植體),D組(DM改性種植體);當兔仰臥平躺時,每只兔右腳為普通種植體,左腳為改性種植體。
1.2.3 種植體植入 用戊3%巴比妥鈉(40 mg/kg),耳緣靜脈注射以麻醉動物。將實驗動物術區備皮消毒,沿脛骨上端內側平面切開,分離肌肉及筋膜完全暴露脛骨面;用生理鹽水讓術區冷卻,使用種植機于脛骨平面中央逐級預備種植窩,并植入復合涂層種植體(圖1),深度約2 mm,分層嚴密縫合。術后每日肌內注射40 萬U的硫酸慶大霉素,觀察實驗動物愈合情況。
1.2.4 RT-PCR檢測特定基因
1.2.4.1 RNA的提取與轉錄 于術后第 4、8、12 周,普通兔組、DM兔組各處死4只新西蘭兔,取雙側脛骨(圖2)種植體周0.8 cm×0.8 cm×1.0 cm的骨塊,經錫箔紙雙側包裹并編號后,溫度于80 ℃保存。待3批樣本收集齊后,液氮下無菌研磨、離心、振蕩、靜置、提取含有RNA的上清液,將提取出的 RNA 于-20 ℃ 保存。最后按照說明書依次加入各試劑,置PCR儀上進行反應,完成逆轉錄。

圖1 免脛骨植入 圖2 免脛骨改性種植體
改性種植體 骨結合情況
1.2.4.2 引物設計與RT-PCR反應 所有引物均交由上海生工生物工程技術服務有限公司設計合成,所用引物及堿基序列如表1。按照說明書相關使用要求,應用Smart Cycler System RT-PCR Ⅱ擴增儀進行實驗。使用Thermo Scientific PikoReal軟件(Thermo公司)分析PCR過程各檢測樣本的CT(Threshold cycle)值,本實驗室通過2-△△CT計算X相對mRNA表達水平,GAPDH為內參。

表1 PCR引物及堿基序列(3′~5′)
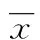
2 結 果
2.1 種植體的表面形態 由掃描電子顯微鏡(SEM)分別掃描微弧氧化后種植體和加載蛋白后改性種植體表面,可知種植體表面存在大量加載TGF-β1蛋白的明膠微球,明膠微球表面可見蛋白吸附,測得該微球球徑為8~30 μm,見圖3、4。

箭頭:微孔。
圖3 微弧氧化后種植體的表面微孔掃描電鏡觀察(×10 000)

箭頭:加載蛋白。
圖4 微弧氧化后種植體的表面微孔掃描電鏡觀察(×500)
2.2 DM模型的建立 除兩只動物建模時死亡,其余動物建模成功。建模后,模型組新西蘭兔空腹血糖由(5.93±0.66)mmol/L增高到(18.61±4.87)mmol/L,穩定于13.8 mmol/L以上。而對照組血糖為(6.12±0.62)mmol/L,差異有統計學意義(P<0.05)。
2.3 2-△△CT法轉換后不同時間點上各基因表達比較 使用改性種植體的兔子(B、D組),Runx-2、ALP、OC的mRNA表達在同一時間點上高于普通種植體的兔子(A、C組),差異有統計學意義(P<0.05),正常兔子改性種植體基因表達最高,DM兔改性種植體率與正常兔子正常種植體的基因表達差異無統計學意義(P>0.05),DM兔正常種植體最低。而隨著時間的增加,使用改性種植體的Runx-2、ALP、OC的基因表達量增加高于普通種植體(P<0.05)。AGEs的表達在普通兔子上,使用普通種植體隨時間遞增比改性種植體較快(P<0.05),而在DM兔上,使用改性種植體后,AGEs遞減較快,普通種植體不變,見表2、圖5。
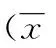
表2 2-△△CT法轉換后不同時間點上各基因表達比較±s,n=4)

圖5 各組不同時間點上各基因表達比較

圖6 部分基因的擴增曲線和溶解曲線
3 討 論
DM是一種常見的慢性全身性疾病,WHO發布《全球糖尿病報告》來看,目前DM已成為重大的公共衛生問題。以往的研究表明,DM患者的種植體成功率遠低于健康人,因此對于DM患者種植體周圍健康狀況,不僅應該及時進行治療,更應該提前預防,以達到更好的修復效果[2-7]。
早期更好的骨整合與結合強度是口腔種植材料研究的熱點。本實驗對種植體進行表面改性,使其表面緊密吸附一層均勻的復合涂層,使種植體具有生物功能性,另一方面表面積增加了的種植體具有更高的骨結合率[8-9]。由電鏡來看,種植體表面存在大量的載蛋白微球,這與以往的實驗結果相似[1]。擴大了種植適應證,尤其是全身性疾病(如DM、骨質疏松等)的患者時,單一鈦種植體表面改性已不能滿足目前的臨床要求,結合理、化、生物方法及材料優點的改性技術以后必然的發展方向[10]。
本實驗同時選取了Runx-2、ALP,AGEs和OC這幾個在糖尿病成骨中有標志性的基因進行檢測,由實驗結果可知Runx-2、ALP、OC的mRNA表達在同一時間點上改性種植體的成骨性要高于普通種植體,DM兔改性種植體率與正常兔子正種植體的基因表達相近。這說明使用復合涂層種植體后,對兔的成骨細胞增殖有促進作用,這可能與復合涂層中存在的TGF-β有關。Liu等[11]研究表明,BMP信號和Runx-2存在相關性,這一級聯反應在成骨細胞分化過程中有著十分重要的作用。而在加入TGF-β后細胞Runx-2、BMP2 mRNA表達增加,表明細胞分化成骨能力增加,Sun等[12]發現轉化生長因子信號通路是一個重要的信號通路調節成骨細胞的礦化,加入TGF-β將影響ALP和OC的表達。這都與本實驗結果基本相符。同時,改性種植體組中的ALP基因的表達量在動物實驗的早期都維持在一個較高的水平,且遠遠大于普通種植體組,這可說明在成骨的早期,該復合涂層種植體提供羥基磷灰石對動物骨的礦化過程有較強的促進作用,復合涂層種植體能有效的促進成骨細胞ALP的基因的表達和其鈣離子的釋放,從而對成骨細胞的活性和礦化有一定作用。與此同時,在使用同種類型種植體時DM組的Runx-2、ALP和OC表達量少于正常兔子組,說明DM確實會引起實驗動物的成骨能力下降。這可能DM的骨代謝有關系密切,DM動物存在著鈣磷及維生素D代謝異常,高血糖,糖基化終末產物,細胞因子與Wnt信號途徑異常等問題,這些都可能造成糖尿病骨代謝異常從而誘發病理改變如骨愈合不良和骨再生能力受損等問題從而影響標志性基因的表達[13-14]。
與上述基因不同,AGEs是一種與DM有密切關系的產物,是在非酶促條件下,蛋白質、氨基酸、脂類或核酸等大分子物質的游離氨基與還原糖的醛基經過縮合、重排、裂解、氧化修飾后產生一組穩定的終末產物[15-16]。組織中AGEs水平在一定程度上能反映DM腎病的嚴重程度,同時AGEs可與成骨細胞表面的受體RAGE結合,抑制成骨細胞分化,使成骨細胞成骨能力下降[17]。本實驗中,圖通AGEs的表達量在普通兔子使用普通時種植體隨時間遞增較快,而使用改性種植體遞增較慢,但二者間差異無統計學意義(P>0.05),說明在普通兔上,AGEs表達改變不明顯,而在DM兔上,使用改性種植體后,AGEs遞減迅速,普通種植體不變。這說明復合涂層種植體在可抑制AGEs的表達,從而促進DM動物的成骨,可能原因是與AGEs與TGF-β1呈負相關,而復合涂層種植體通過TGF-β1的過表達來抑制AGEs從而在DM中起到骨保護作用。
本實驗使用的復合涂層改性種植體,在DM動物體內對于成骨具有明顯的促進作用,該材料有望進一步研究以期以后的臨床運用。
[1]茍詩然,張帆,李萌婷,等.鈦表面羥磷灰石/殼聚糖-轉化生長因子-β1緩釋微球復合涂層的制備及其對成骨細胞黏附與增殖的影響[J].華西口腔醫學雜志,2016,34(3):229-233.
[2]Aloufi F,Bissada N,Ficara A,et al.Clinical assessment of peri-implant tissues in patients with varying severity of chronic periodontitis[J].Clin Implant Dent Relat Res,2009,11(1):37-40.
[3]Abreu MH,Bianchini MA,Magini RS,et al.Clinical and radiographic evaluation of periodontal and peri-implant conditions in patients with implant-supported prosthesis[J].Acta Odontol Latinoam,2007,20(2):87-95.
[4]Crespi R,Capparè P,Gherlone E.A 4-year evaluation of the peri-implant parameters of immediately loaded implants placed in fresh extraction sockets[J].J Periodontol,2010,81(11):1629-1634.
[5]Karoussis IK,Salvi GE,Heitz-Mayfield LJ,et al.Long-term implant prognosis in patients with and without a history of chronic periodontitis:a 10-year prospective cohort study of the ITI dental implant system[J].Clin Oral Implants Res,2003,14(3):329-339.
[6]Yamalik N,Günday S,Kilinc K,et al.Analysis of cathepsin-K levels in biologic fluids from healthy or diseased natural teeth and dental implants[J].Int J Oral Maxillofac Implants,2011,26(5):991-997.
[7]Tang Z,Sha Y,Lin Y,et al.Peri-implant mucosal inflammation and bone loss:clinical and radiographic evaluation of 108 dental implants after 1-year loading[J].Chin J Dent Res,2000,3(2):15-20.
[8]Mendonca G,Mendonca DB,Aragao FJ,et al.Advancing dental implant surface technology-from micron-to nanotopography[J].Biomaterials,2008,29(28):3822-3835.
[9]Dohan ED,Coelho PG,Kang BS,et al.Classification of osseoin-tegrated implant surfaces:materials,chemistry and topogra-phy[J].Trends Biotechnol,2010,28(4):198-206.
[10]Sarkar PD,Choudhury AB.Relationships between serum osteocalcin levels versus blood glucose,insulin resistance and markers of systemic inflammation in central Indian type 2 diabetic patients[J].Eur Rev Med Pharmacol Sci,2013,17(12):1631-1635.
[11]Liu T,Gao Y,Sakamoto K,et al.BMP-2 promotes differentiation of osteoblasts and chondroblasts in Runx-2一deficient cell lines[J].J Cell Physiol,2007,211(3):728-735.
[12]Sun X,Cao Z,Zhang Q,et al.Aluminum trichloride inhibits osteoblast mineralization via TGF-β1/Smad signaling pathway[J].Chem Biol Interact,2016(244),449-2415.
[13]Yamagishi SI.Role of advanced glycation end products (AGEs) in osteoporosis in diabetes[J].Curr Drug Targets,2011,12(14):2096-2102.
[14]Kolluru GK,Bir SC,Kevil CG.Endothelial dysfunction and diabetes:effects on angiogenesis,vascular remodeling,and wound healing[J].Int J Vasc Med,2012(2012):918267.
[15]Bierhaus A,Hofmann MA,Ziegler R,et al.AGE and their interaction with AGE receptor in vascular disease and diabetes Ⅰ.The AGE concept[J].Cardiovasc Res,1998,37(3):586-600.
[16]Mai CY,Wang B,Wen JY,et al.Lipoprotein-associated phospholipase A2 and AGEs are associated with cardiovascular risk factors in women with history of gestational diabetes mellitus[J].Gynecol Endocrinol,2014,30(3):241-244.
[17]Santana RB,Xu L,Chase HB,et al.A role for advanced glycation end products in diminished bone healing in type 1 diabetes[J].Diabetes,2003,52(6):1502-1510.
Investigation of hydroxyapatite/chitosan-TGF-β1 composite coatings on implant surfaces and its effect on the maker gene Runx 2/ALP/OC of diabetic rabbit osteoblasts*
LiuXingyu1,2,LeiTingting3,GouShiran1,ZhengLige2△,GuoLing1,MuYandong2
(1.DepartmentofProsthodontics,theAffiliatedHospitalofStomatologyofSouthwestMedicalUniversity/Laboratory&OralandMaxillofacialReconstructionandRegenerationInstituteofCardiovascularMedicine,SouthwestMedicalUniversity/Luzhou,Sichuan646000,China;2.StateKeyLaboratoryofOralDiseases&theAffiliatedWestChinaStomatologyHospitalofSichuanUniversity,Chengdu,Sichuan610041,China;3.DepartmentofPlanningandFinance,theAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou,Sichuan646000,China)
Objective This study investigated the effects of hydroxyapatite (HA)/chitosan (CS)-transforming growth factor-β1 (TGF-β1) composite coatings on implant surfaces,as well as on the symbol gene of diabetic rabbit osteoblasts.Methods Coatings were prepared on implant surfaces and studied by scanning electric microscope (SEM),New Zealand White rabbits were used to establish the model of type 2 diabetes.Implant the implants in tibial metaphysis of the rabbit and took them and surrounding bone tissue our after 4,8,12 weeks.Detcet the expression of AGEs,ALP,OC,Runx-2 mRNA by semi-quantitative RT-PCR.Results The expression level of Runx-2,ALP and OC mRNA on composite coatings implants tended to be higher than that on normal implant at each time point.The same differences occurred at different points in time,especially the implants in normal rabbits.Conclusion The composite coatings implants significantly promote the proliferation of osteoblast and the expression of Runx-2,ALP and OC in high glucose,and it’s worth of further clinical use.
diabetes mellitus;reverse transcriptase polymerase chain reaction;implant;surface modification
10.3969/j.issn.1671-8348.2017.08.006
口腔疾病研究國家重點實驗室開放課題(SKLOD2015OF09);四川省衛生和計劃生育委員會科研課題(16PJ173)。 作者簡介:劉星宇(1990-),碩士,主要從事口腔修復學研究。△
,E-mail:541148817@qq.com。
R783.4
A
1671-8348(2017)08-1023-04
2016-07-22
2016-09-20)

