卵巢子宮內(nèi)膜異癥不孕患者異位內(nèi)膜組織中FMO3、DMBT1的表達(dá)變化及其意義
王秋陽(yáng),林偉,王福玲,王雅琦,許偉偉
(1青島大學(xué)醫(yī)學(xué)部,山東青島266071;2青島大學(xué)附屬醫(yī)院)
卵巢子宮內(nèi)膜異癥不孕患者異位內(nèi)膜組織中FMO3、DMBT1的表達(dá)變化及其意義
王秋陽(yáng)1,林偉2,王福玲2,王雅琦1,許偉偉1
(1青島大學(xué)醫(yī)學(xué)部,山東青島266071;2青島大學(xué)附屬醫(yī)院)
目的 觀察卵巢子宮內(nèi)膜異位癥(EMs)不孕患者異位內(nèi)膜組織中的含黃素單氧化酶3(FMO3,在輸卵管上皮組織高表達(dá))、腦惡性腫瘤缺失基因(DMBT1,在子宮內(nèi)膜組織高表達(dá))mRNA及蛋白,并探討其意義。方法 將卵巢EMs不孕患者的異位內(nèi)膜組織40例份作為觀察組,選取卵巢EMs已育患者的異位內(nèi)膜組織50例份作為對(duì)照組,以正常卵巢組織35例份作為正常組。采用real-time PCR法檢測(cè)三組FMO3、DMBT1 mRNA,采用Western blotting法檢測(cè)FMO3、DMBT1蛋白。結(jié)果 觀察組FMO3 mRNA及蛋白相對(duì)表達(dá)量高于對(duì)照組和正常組(P均<0.05);觀察組、對(duì)照組DMBT1 mRNA及蛋白相對(duì)表達(dá)量高于正常組(P均<0.05)。結(jié)論 卵巢EMs不孕患者異位內(nèi)膜組織中FMO3呈高表達(dá),異位內(nèi)膜組織來(lái)源可能為輸卵管;輸卵管組織來(lái)源的異位內(nèi)膜組織可能與卵巢EMs患者不孕有關(guān)。
子宮內(nèi)膜異位癥;卵巢子宮內(nèi)膜異位癥;不孕癥;異位子宮內(nèi)膜;含黃素單氧化酶3;腦惡性腫瘤缺失基因
子宮內(nèi)膜異位癥(EMs)是子宮內(nèi)膜組織出現(xiàn)在子宮體以外部位的一類(lèi)疾病[1,2]。EMs可引起痛經(jīng)、月經(jīng)不調(diào)等癥狀,且與不孕關(guān)系密切[3~5]。有關(guān)EMs發(fā)病機(jī)制存在多種學(xué)說(shuō),具體發(fā)病機(jī)制尚未明確。研究[6]表明,EMs病灶組織細(xì)胞部分起源于子宮內(nèi)膜細(xì)胞,部分可能源于輸卵管上皮細(xì)胞。輸卵管上皮細(xì)胞可能是卵巢EMs潛在的組織細(xì)胞來(lái)源。關(guān)于不同來(lái)源的卵巢EMs病灶對(duì)患者生育能力的影響是否存在差異尚未見(jiàn)報(bào)道。為研究不同來(lái)源的卵巢EMs病灶對(duì)生育的影響,我們選擇在輸卵管上皮組織中高度表達(dá)、在子宮內(nèi)膜組織中低表達(dá)的含黃素單氧化酶3(FMO3)作為輸卵管來(lái)源標(biāo)志物,選擇在子宮內(nèi)膜組織中高表達(dá)、在輸卵管上皮組織中低表達(dá)的腦惡性腫瘤缺失基因(DMBT1)作為子宮內(nèi)膜來(lái)源標(biāo)志物[6],檢測(cè)卵巢EMs不孕患者異位內(nèi)膜組織中的FMO3、DMBT1 mRNA和蛋白,以此觀察卵巢EMs不孕患者異位內(nèi)膜組織的來(lái)源,并分析其與患者不孕的關(guān)系。
1 資料與方法
1.1 臨床資料 研究對(duì)象選自2014年5月~2015年5月在青島大學(xué)附屬醫(yī)院手術(shù)治療的女性住院患者。納入標(biāo)準(zhǔn):①有正常月經(jīng)周期及排卵,基礎(chǔ)性激素檢查正常;②手術(shù)治療前3個(gè)月無(wú)激素類(lèi)藥物治療史;③排除子宮腺肌癥、子宮先天發(fā)育異常、急性盆腔炎、子宮肌瘤、子宮內(nèi)膜增生癥患者及子宮內(nèi)膜息肉、子宮內(nèi)粘連等子宮內(nèi)病變患者及自身免疫性疾病患者。納入行卵巢巧克力囊腫剝除術(shù)的卵巢EMs合并不孕患者50例,年齡25~35(29.4±2.7)歲,不孕年限1~10年,患者同時(shí)行宮腔鏡與腹腔鏡手術(shù),輸卵管通暢,術(shù)中留取異位內(nèi)膜40例份作為觀察組;行卵巢巧克力囊腫剝除術(shù)的卵巢EMs已育患者50例,年齡26~45(30.6±5.4)歲,術(shù)中留取異位內(nèi)膜50例份作為對(duì)照組;因一側(cè)卵巢病變而行雙側(cè)卵巢切除的患者35例,年齡28~45(32.0±3.2)歲,術(shù)中留取正常卵巢組織50例份作為正常組。三組患者年齡、BMI等資料具有可比性。本研究方案經(jīng)本院醫(yī)學(xué)倫理委員會(huì)審批通過(guò),患者均簽署知情同意書(shū)。
1.2 各組FMO3、DMBT1 mRNA檢測(cè) 采用real-time PCR法。參照TRIzol說(shuō)明書(shū)提取組織總RNA,逆轉(zhuǎn)錄為cDNA用于PCR擴(kuò)增。基因引物由上海生工生物公司合成。FMO3基因上游引物序列為5′-AATTCGGGCTGTGATATTGC-3′,下游引物序列為5′-TTGAGGAAGGTTCCAAATCG-3′,產(chǎn)物長(zhǎng)度20 bp;DMBT1上游引物序列為5′-TGCTCTGTCTGCCAAATCAC-3′,下游引物序列為5′-GTCATTGTCTGCCTGCTTGA-3′,產(chǎn)物長(zhǎng)度20 bp;內(nèi)參GAPDH基因上游引物序列為5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游引物序列為5′-AGCCTTCTCCATGGTGGTGAAGAC-3′,產(chǎn)物長(zhǎng)度24 bp。PCR反應(yīng)在FTC2000型熒光定量PCR儀上進(jìn)行,使用2×Sybr Green qPCR Mix試劑盒,按照說(shuō)明書(shū)進(jìn)行PCR反應(yīng),每個(gè)標(biāo)本設(shè)3個(gè)副孔。以2-ΔΔCt表示目的基因相對(duì)表達(dá)量[7]。
1.3 各組FMO3、DMBT1蛋白檢測(cè) 采用Western blotting法。取出各組組織,加細(xì)胞裂解液冰上勻漿提取總蛋白,BCA法檢測(cè)蛋白濃度。每孔加入50 μg總蛋白,10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白質(zhì),將蛋白質(zhì)轉(zhuǎn)移至聚偏氟乙烯(PVDF)膜上。封閉后加入相應(yīng)一抗FMO3、DMBT1、GAPDH,4 ℃孵育過(guò)夜。洗膜后加入二抗,孵育并洗膜,ECL顯色液顯色。方正掃描儀掃描條帶,Quantity One軟件對(duì)條帶進(jìn)行灰度分析,以FMO3、DMBT1與GAPDH條帶的相對(duì)吸光度值表示FMO3、DMBT1蛋白的相對(duì)表達(dá)量。
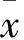
2 結(jié)果
2.1 各組FMO3、DMBT1 mRNA相對(duì)表達(dá)量比較 觀察組FMO3 mRNA相對(duì)表達(dá)量高于對(duì)照組和正常組(P均<0.05);觀察組、對(duì)照組DMBT1 mRNA相對(duì)表達(dá)量高于正常組(P均<0.05)。詳見(jiàn)表1。

表1 各組FMO3、DMBT1 mRNA及蛋白相對(duì)表達(dá)量比較
注:與正常組相比,*P<0.05;與對(duì)照組相比,△P<0.05。
2.2 各組FMO3、DMBT1蛋白相對(duì)表達(dá)量比較 觀察組FMO3蛋白相對(duì)表達(dá)量高于對(duì)照組和正常組(P均<0.05);觀察組、對(duì)照組DMBT1蛋白相對(duì)表達(dá)量高于正常組(P均<0.05)。詳見(jiàn)表1。
3 討論
過(guò)去對(duì)于EMs的研究多基于EMs與在位內(nèi)膜的關(guān)系,從“血逆流學(xué)說(shuō)”到“在位內(nèi)膜決定論”都指出在位內(nèi)膜是EMs發(fā)病的源頭[8]。近年來(lái),學(xué)者們對(duì)卵巢EMs的組織來(lái)源有了新的發(fā)現(xiàn)。卵巢EMs的異位內(nèi)膜被證實(shí)有一部分來(lái)源于輸卵管[9]。有學(xué)者[10]發(fā)現(xiàn)初始內(nèi)膜異位病灶從輸卵管樣上皮到內(nèi)膜樣上皮移行,或腺體一半呈輸卵管黏膜上皮樣、另一半呈宮體內(nèi)膜上皮樣;隨后又發(fā)現(xiàn)大部分卵巢低級(jí)別漿液性癌也起源于輸卵管黏膜上皮而非卵巢表面生發(fā)上皮,故推測(cè)輸卵管黏膜上皮參與了卵巢EMs的形成,并最終在細(xì)胞和分子水平得到證實(shí)。近年研究[6]表明,約60%的卵巢EMs病灶組織有可能起源于輸卵管上皮細(xì)胞。輸卵管上皮細(xì)胞是卵巢EMs潛在的組織細(xì)胞來(lái)源。
現(xiàn)已證實(shí),EMs與不孕關(guān)系密切[11,12]。關(guān)于卵巢EMs相關(guān)性不孕與卵巢異位組織來(lái)源的關(guān)系目前尚未見(jiàn)報(bào)道。本研究分別選擇FMO3和DMBT1作為輸卵管上皮組織和子宮內(nèi)膜組織的標(biāo)志物。FMO3是一種重要的肝微粒體酶,參與體內(nèi)大量藥物、外源性物質(zhì)和某些化學(xué)物質(zhì)的氧化代謝。DMBT1屬于SRCR超家族,在許多惡性腫瘤組織中常表達(dá)缺失或下調(diào)[13,14],被認(rèn)為是候選的抑癌基因。本研究結(jié)果顯示,DMBT1在卵巢EMs患者的異位病灶組織中均呈高表達(dá),F(xiàn)MO3僅在卵巢EMs不孕患者的異位病灶組織中高表達(dá),提示DMBT1可能在卵巢EMs發(fā)病中發(fā)揮著重要作用,但與卵巢EMs相關(guān)性不孕無(wú)關(guān),而FMO3可能與卵巢EMs相關(guān)性不孕有關(guān)。我們推測(cè),子宮內(nèi)膜為絕大部分卵巢EMs病灶組織的來(lái)源,但子宮內(nèi)膜來(lái)源的卵巢EMs可能并不增加不孕發(fā)生率;而輸卵管組織來(lái)源的卵巢EMs患者不孕發(fā)生率可能增高,輸卵管組織可能與卵巢EMs相關(guān)性不孕存在一定關(guān)聯(lián),具體機(jī)制尚不明確。
輸卵管組織來(lái)源的卵巢EMs導(dǎo)致不孕與以下因素有關(guān):①異位的輸卵管組織可能引起盆腔解剖結(jié)構(gòu)改變,引起不孕;②異位的輸卵管組織可能引起卵泡液微環(huán)境改變,后者影響卵母細(xì)胞質(zhì)量及后續(xù)的受精和胚胎發(fā)育[15];③T、B淋巴細(xì)胞及NK細(xì)胞的免疫功能變化可能與輸卵管組織的生長(zhǎng)與種植有關(guān),輸卵管來(lái)源的異位病灶組織有可能引起免疫細(xì)胞異常活化及腹腔微環(huán)境改變;④子宮內(nèi)膜容受性降低等[16]。輸卵管來(lái)源的卵巢異位內(nèi)膜組織有可能由生殖干細(xì)胞分化而來(lái),這些細(xì)胞中HOX基因可能表達(dá)缺失,而HOX參與調(diào)控苗勒管向生殖器官發(fā)育,對(duì)維持子宮內(nèi)膜容受性也有重要作用[16]。
總之,本研究發(fā)現(xiàn),多數(shù)卵巢EMs患者的異位內(nèi)膜組織來(lái)源為子宮內(nèi)膜,而卵巢EMs不孕患者異位內(nèi)膜組織來(lái)源為輸卵管,輸卵管組織可能在卵巢EMs不孕發(fā)生中發(fā)揮一定作用。在以后的研究中,我們有必要從其他角度或應(yīng)用其他方法進(jìn)一步對(duì)上述結(jié)論進(jìn)行驗(yàn)證。
[1] 李雷,冷金花.子宮內(nèi)膜異位癥及其治療對(duì)女性生育影響的研究進(jìn)展[J].中國(guó)實(shí)用婦科與產(chǎn)科雜志, 2013,29(5):393-396.
[2] 于玲,田永杰.子宮內(nèi)膜異位癥發(fā)病相關(guān)因素的臨床研究[J].山東大學(xué)學(xué)報(bào)(醫(yī)學(xué)版),2013,51(2):79-83.
[3] Houshdaran S, Nezhat CR, Vo KC, et al. Aberrant endometrial DNA methylome and associated gene expression in endometriosis[J]. Biol Reprod, 2016,95(5):1-16.
[4] Opoien HK, Fedorcsak P, Omland AK, et al. In vitro fertilization is a successful treatment in endometriosis-associated infertility[J]. Fertil Steril, 2012,97(4):912-918.
[5] Ozkan S, Murk W, Arici A. Endometriosis and infertility: epidemiology and evidence-based treatments[J]. Ann N Y Acad Sci, 2008,1127(10):92-100.
[6] Yuan Z, Wang L, Wang Y, et al. Tubal origin of ovarian endometriosis[J]. Mod Pathol, 2014,27(8):1154-1162.
[7] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001,25(4):402-408.
[8] 仝佳麗.子宮內(nèi)膜異位癥的在位內(nèi)膜病變研究進(jìn)展[J].現(xiàn)代婦產(chǎn)科進(jìn)展,2010,19(6):465-467.
[9] 魏利,吳凱彥,王軼英.卵巢子宮內(nèi)膜異位癥的輸卵管起源及其臨床意義[J].實(shí)用婦產(chǎn)科雜志,2015,31(11):811-812.
[10] Chen C, Li J, Yao G, et al. Tubal origin of ovarian low-grade serous carcinoma[J]. Am J Clin Exp Obstet Gynecol, 2013,24(11):1488-1499.
[11] Buyalos RP, Agarwal SK. Endometriosis-associated infertility[J]. Curr Opin Obstete Gynecol, 2000,12(5):377-381.
[12] Augoulea A, Alexandrou A, Creatsa M, et al. Pathogenesis of endometriosis: the role of genetics, inflammation and oxidative stress[J]. Arch Gynecol Obstet, 2012,286(1):99-103.
[13] Helmke BM, Renner M, Poustka A, et al. DMBT1 expression distinguishes anorectal from cutaneous melanoma[J]. Histopathology, 2009,54(2):233-240.
[14] Mollenhauer J, Helmke B, Medina D, et al. Carcinogen inducibility in vivo and down-regulation of DMBT1 during breast carcinogenesis[J]. Genes Chromosomes Cancer, 2004,39(3):185-194.
[15]Ambekar AS, Nirujogi RS, Srikanth SM, et al. Proteomic analysis of human follicular fluid: A new perspective towards understanding folliculogenesis[J]. J Proteomics, 2013,87(13):68-77.
[16] 宋亞麗,全松.子宮內(nèi)膜異位癥患者內(nèi)膜容受性及“種植窗”的特點(diǎn)[J].生殖與避孕,2016,34(7):590-594.
王福玲(E-mail: wang.fl2007@163.com)
10.3969/j.issn.1002-266X.2017.03.017
R711.71;R711.6
B
1002-266X(2017)03-0056-03
2016-09-21)

