人肌母細胞瘤體注射對人宮頸癌細胞裸鼠移植瘤的治療觀察
毋蓓蓓,李巧云,李曉麗
(鄭州大學第五附屬醫院,鄭州450052)
人肌母細胞瘤體注射對人宮頸癌細胞裸鼠移植瘤的治療觀察
毋蓓蓓,李巧云,李曉麗
(鄭州大學第五附屬醫院,鄭州450052)
目的 觀察人肌母細胞瘤體注射治療人宮頸癌細胞裸鼠移植瘤的效果,并與順鉑進行比較。方法 裸鼠45只,皮下注射HeLa細胞制作宮頸癌細胞移植瘤,隨機分為人肌母細胞組、順鉑組、生理鹽水組各15只,分別采取人肌母細胞瘤體注射、順鉑腹腔注射、生理鹽水瘤體注射,用藥后連續觀察4周。于用藥前后觀察裸鼠一般情況,測算裸鼠體質量及腫瘤體積;采用HE染色觀察各組腫瘤組織形態及細胞形態;分別采用免疫組化法、Western blotting法檢測腫瘤組織中的p53蛋白。結果 人肌母細胞組裸鼠用藥后體質量較治療前增高,腫瘤體積較用藥前縮小,且用藥后腫瘤體積小于其余兩組(P均<0.05)。人肌母細胞組裸鼠用藥后的反應性、精神、飲食狀況均優于其余兩組。病理檢查示生理鹽水組細胞異型性明顯、腫瘤細胞體積大、細胞核增多;人肌母細胞組可見大量凋亡壞死的腫瘤細胞,大量細胞固縮、細胞核碎裂,腫瘤組織纖維化明顯;順鉑組腫瘤細胞固縮、細胞核裂解不明顯,腫瘤組織纖維化程度不顯著。人肌母細胞組、順鉑組、生理鹽水組腫瘤組織中p53蛋白陽性表達率分別為20.0%、33.3%、60.0%,p53蛋白相對表達量分別為0.321±0.054、0.379±0.067、0.534±0.064,三組相比,P均<0.05。結論 人肌母細胞瘤體注射可減小人宮頸癌細胞裸鼠移植瘤的體積,促使腫瘤細胞凋亡(機制可能與下調p53蛋白表達有關),抑瘤效果優于順鉑。
宮頸癌;人肌母細胞;順鉑;動物實驗;p53
宮頸癌是女性生殖系統最常見的惡性腫瘤之一[1],我國宮頸癌的發病率及病死率也居高不下[2]。目前宮頸癌的治療方案仍是以手術為主,輔以放化療[3,4]。然而,放化療除能有效殺死腫瘤細胞外,對正常組織細胞的破壞力也極大,不良反應多。人肌母細胞基因療法(HMGT)作為一種前研治療手段逐漸受到學者重視,在治療器官退化所致疾病方面已初有成效[5]。Parlakian等[6]研究證明人肌母細胞可以抑制黑色素瘤細胞生長。2015年12月~2016年3月,我們制作了人宮頸癌細胞裸鼠移植瘤模型,給予人肌母細胞瘤體注射治療,觀察人肌母細胞對宮頸癌的治療作用,并與傳統抗腫瘤藥物順鉑[7,8]進行對比,現報告如下。
1 材料與方法
1.1 實驗材料 細胞株:宮頸癌HeLa細胞株(武漢大學細胞庫)、人肌母細胞(武漢羅蓋人肌母細胞醫學研究院,取自健康成年男性股四頭肌)。實驗動物:雌性BALB/c裸鼠45只(北京維通利華有限公司),SPF級動物房飼養,水和飼料經高壓滅菌處理,溫度22 ℃、濕度55%、12 h明暗交替。實驗試劑與器械:細胞培養用DMEM培養基、胎牛血清、胰酶等(Gibco公司),順氯氨鉑(北京中杉金橋有限公司),GAPDH(康為世紀公司),p53抗體(碧云天公司)。
1.2 人宮頸癌細胞裸鼠移植瘤模型的制作 取對數生長期的HeLa細胞,胰酶消化,2 min后停止消化,離心,PBS洗滌,制成1×108/mL的宮頸癌細胞懸液。用1 mL一次性注射器抽取懸液,依次皮下注射于裸鼠左側腋下(0.2 mL),隔日用游標卡尺測量瘤體的長徑(a)和短徑(b)。至腫瘤直徑增長至3~5 mm,裸鼠對外界反應可,飲食可,體質量無明顯下降,視為建模成功。
1.3 人肌母細胞注射方法 將建模成功的裸鼠隨機分為人肌母細胞組、順鉑組和生理鹽水組,每組15只。人肌母細胞組裸鼠瘤體內注射人肌母細胞懸液(多點注射,0.2 mL,1×107個細胞),順鉑組腹腔注射順鉑(3 mg/kg),生理鹽水組瘤體注射生理鹽水0.2 mL,用藥后連續觀察4周。
1.4 裸鼠體質量、腫瘤體積測算及一般情況觀察 每天記錄裸鼠體質量,觀察裸鼠精神狀況、腫瘤質地,隔日測量腫瘤長短徑、計算腫瘤體積,4周后處死裸鼠并取出腫瘤組織。
1.5 腫瘤組織病理觀察 將各組腫瘤組織在多聚甲醛溶液固定48 h后,常規石蠟切片,HE染色,每只裸鼠取1張瘤體切片,隨機選擇3個視野,選視野中心觀察,拍攝腫瘤細胞變性壞死明顯處。
1.6 腫瘤組織中p53蛋白[5,9]檢測 ①定性檢測:取腫瘤組織做石蠟切片,根據免疫組化試劑盒說明書操作,以細胞核中出現棕色或棕褐色顆粒為p53蛋白陽性細胞,每份隨機觀察5個高倍視野(400×),根據陽性細胞百分比和染色強度判定結果:陽性細胞百分比≤5%計0分,>5%~25%計1分,>25%~50%計2分,>50%~75%計3分,>75%計4分;染色呈黃色計1分,棕黃色計2分,棕褐色計3分;兩項得分相乘,0為陰性(-),1~4為弱陽性(+),5~8中度陽性(++),9以上為強陽性(+++),+~+++判定為p53蛋白表達陽性。②定量檢測:提取組織蛋白,將PBS清洗3遍后的細胞置于培養皿上,加細胞裂解緩沖液,冰上孵育10 min,使用細胞刮刀刮2 min,置于Eppendorf管中,先后煮沸、離心各10 min,取上清液,再按照蛋白提取試劑盒說明提取蛋白;進行SDS-PAGE電泳后,用濕轉法轉膜,牛奶封閉1 h,加一抗4 ℃孵育過夜,洗膜,二抗室溫孵育1 h,壓片、暗室顯影,用Image J軟件分析計算p53蛋白相對表達量。
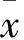
2 結果
2.1 各組裸鼠用藥前后體質量、腫瘤體積及一般情況 各組裸鼠無死亡。人肌母細胞組、順鉑組和生理鹽水組用藥前體質量分別為(16.05±0.18)、(16.09±0.15)、(16.08±0.13)g,用藥后分別為(16.35±0.26)、(16.09±0.18)、(15.72±0.19)g;人肌母細胞組裸鼠用藥后體質量較治療前增高,生理鹽水組用藥后體質量降低(P均<0.05)。人肌母細胞組、順鉑組和生理鹽水組用藥前腫瘤體積分別為(36.71±0.52)、(36.77±0.68)、(36.53±0.85)mm3,用藥后分別為(20.14±1.88)、(55.42±3.35)、(94.97±4.68)mm3;人肌母細胞組用藥后腫瘤體積較用藥前縮小,生理鹽水組腫瘤體積較用藥前增大,且人肌母細胞組用藥后腫瘤體積小于其余兩組(P均<0.05)。人肌母細胞組用藥后對外界刺激反應靈敏,精神可,無明顯飲食改變;順鉑組對外界刺激反應一般,精神欠佳,飲食減少;生理鹽水組對外界刺激反應遲鈍,精神差,飲食明顯減少。
2.2 各組用藥后腫瘤組織病理變化 生理鹽水組可見分化程度較高的腫瘤細胞,細胞異型性明顯,視野中可見腫瘤細胞體積大、細胞核增多;人肌母細胞組可見大量凋亡壞死的腫瘤細胞,大量細胞固縮、細胞核碎裂,腫瘤組織纖維化明顯,并有大量的壞死組織和炎癥細胞;順鉑組腫瘤細胞固縮、細胞核裂解不明顯,腫瘤組織纖維化程度不顯著,可見部分組織壞死、炎癥細胞浸潤。見圖1。

注:A為生理鹽水組;B為人肌母細胞組;C為順鉑組。
圖1 各組用藥后腫瘤組織病理變化(HE染色,400×)
2.3 各組腫瘤組織中p53蛋白表達比較 人肌母細胞組、順鉑組、生理鹽水組腫瘤組織中p53蛋白陽性表達率分別為20.0%、33.3%、60.0%(見圖2),p53蛋白相對表達量分別為0.321±0.054、0.379±0.067、0.534±0.064,三組相比,P均<0.05。

注:A為生理鹽水組;B為人肌母細胞組;C為順鉑組。
圖2 各組腫瘤組織中p53蛋白表達情況(HE染色,400×)
3 討論
宮頸癌是最常見的女性生殖系統惡性腫瘤之一,也是對女性健康危害最大的惡性腫瘤。研究[10]表明宮頸癌全球每年新發病例約50萬,其中80%的患者來自發展中國家。在發病率不斷升高的同時,宮頸癌的傳統治療手段(如手術輔以放化療)療效有限,在達到一定治療劑量時局部控制率難以提高,并發癥卻不斷增加[4]。傳統化療藥物順鉑可阻止G1期腫瘤細胞的DNA復制,對宮頸癌有一定治療效果,但患者會產生難以耐受的消化道癥狀及骨髓抑制等[11],且腫瘤細胞耐藥率較高[12]。我們在本次實驗中也觀察到,順鉑對裸鼠消化系統存在毒性作用,順鉑組裸鼠在反應性、精神、飲食方面的表現并不理想。尋找一種并發癥少、療效好的治療方案對于控制宮頸癌病情、改善患者生活質量有重要意義。
成肌細胞是一種胞質含有肌組織的前體細胞,在胚胎發育過程中由間充質細胞轉化而來,其最終分化為成熟的肌細胞。炎癥狀態下,人肌母細胞被激活,調節細胞增殖與分化[13]。1990年國外學者[14]首次發現人肌母細胞可修復受損基因、補充杜氏肌營養不良癥患者體內的抗肌萎縮蛋白。隨后有學者[15]將其應用于缺血性心肌病的治療,顯示出較好的療效和較高的安全性。近年來研究[16]顯示,對前列腺癌小鼠模型注射人肌母細胞能夠抑制實體腫瘤的生長及轉移。我們制作了人宮頸癌細胞裸鼠移植瘤模型,給予人肌母細胞瘤體注射,結果顯示人肌母細胞組裸鼠一般情況較好,裸鼠體質量增加,腫瘤體積縮小,提示人肌母細胞對宮頸癌有一定的治療作用,且不良反應小于順鉑。進一步病理觀察顯示,人肌母細胞組腫瘤細胞大量凋亡,腫瘤組織纖維化明顯,表明人肌母細胞注射可促使宮頸癌細胞發生凋亡,推測機制與人肌母細胞通過旁分泌炎癥因子參與并導致細胞凋亡有關[10]。
p53基因是最常見的抑癌基因[17],其編碼產物是核轉錄因子,當DNA損傷或癌基因突變時,p53接到應激信號,細胞內p53蛋白水平升高[18,19]。p53基因在所有腫瘤細胞中均可能發生突變[20]。本研究觀察了各組腫瘤組織中p53蛋白的表達變化,結果顯示,人肌母細胞組p53蛋白陽性表達率和相對表達量均低于其余兩組,推測人肌母細胞對宮頸癌的治療作用還可能與調控p53蛋白表達有關。
結合上述實驗結果,我們認為,人肌母細胞瘤體注射治療人宮頸癌細胞裸鼠移植瘤在縮小腫瘤體積、破壞腫瘤細胞、促進腫瘤細胞凋亡方面的效果較順鉑明顯;而且,與傳統化療藥物順鉑相比,人肌母細胞在治療過程中無消化道反應、骨髓抑制等難以耐受的不良反應,對體質量、飲食情況、精神狀態的影響較小。如將人肌母細胞用于宮頸癌治療的臨床試驗,可能有助于更好地控制病情、改善患者生存質量及治療依從性。然而,本實驗納入樣本量偏少,仍需進行大樣本動物實驗驗證有效性和可行性,且治療的最佳時機、注射方式、注射劑量、追加時機、療程設定等也需進一步探索。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality Sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer J Int Cancer, 2015,136(5):359-386.
[2] Du K, Gong HY, Gong ZM. Influence of serum VEGF levels on therapeutic outcome and diagnosis /prognostic value in patients with cervical cancer[J]. Asian Pac J Cancer Prev, 2014,15(20):8793-8796.
[3] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010,7(12):2893-2917.
[4] Green JA, Kirwan JM, Tierney JF, et al. Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix: a systematic review and meta-analysis[J]. Lancet, 2001,358(9284):781-786.
[5] Liu J, Zhang C, Feng Z. Tumor suppressor p53 and its gain-of-function mutants in cancer[J]. Acta Biochim Biophys Sin (Shanghai),2014,46(3):170-179.
[6] Parlakian A, Gomaa I, Solly S, et al. Skeletal muscle phenotypically converts and selectively inhibits metastatic cells in mice[J]. PLoS One, 2010,5(2):e9299.
[7] 曹靜玲.紫杉醇聯合順鉑新輔助化療對宮頸癌組織OPN和VEGF表達的影響[J].山東醫藥,2015,55(25):71-72.
[8] 陳雨,周穎,張雪芬.奈達鉑或順鉑聯合紫杉醇應用于宮頸癌輔助化療的比較分析[J].實用婦產科雜志,2015,31(11):862-865.
[9] Kastan MB, Berkovich E. p53: a two-faced cancer gene[J]. Nat Cell Biol, 2007,9(5):489-491.
[10] Valdespino VM, Valdespino VE. Cervical cancer screening: State of the art[J]. Curr Opin Obstet Gynecol, 2006,18(1):35-40.
[11] Yu W, Jin C, Lou X, et al. Global analysis of DNA methyla-tion by Methyl-Capture sequencing reveals epigenetic control of cisplatin resistance in ovarian cancer cell[J]. PLoS One, 2011,6(12):29450.
[12] Muggia F. Platinum compounds 30 years after the introduction of cisplatin: implications for the treatment of ovarian cancer[J]. Gynecol Oncol, 2009,112(1):275-281.
[13] Gopinath SD, Rando TA. Stem cell review series: aging of the skeletal muscle stem cell niche[J]. Aging Cell, 2008,7(4):590-598.
[14] Kehat MG, Kenyagin-Karsenti D, Sinr M, et al. Human embryonic stem cells can differentiate into myocytes with structural and functional properties of cadiomyocytes[J]. J Clin Invest, 2001,108(3):407-414.
[15] Koh GY, Klug MG, Soonpaa MH, et al. Differentiation and long-term survival of C2Cl2 myoblast grafts in heart[J]. J Clin Invest, 1993,92(3):1548-1554.
[16] Stolting MNL, Ferrari S, Handschin C, et al. Myoblasts inhibit prostate cancer growth by paracrine secretion of tumor necrosis factor-alpha [J]. J Urol, 2013,189(5):1952-1959.
[17] Lee WC, Lee SY, Koo YJ, et al. Establishment of a Korea HPV cohort study[J].J Gynecol Oncol, 2013,24(1):59-65.
[18] Livesey KM, Kang R, Vernon P, et al. p53/HMGB1 complexes regulate autophagy and apoptosis[J]. Cancer Res, 2012,72(8):1996-2005.
[19] Dong XX, Wang YR, Qin S, et al. p53 Mediates autophagy activation and mitochondria dysfunction in kainic acid-induced excitotoxicity in primary striatal neurons[J]. Neuroscience, 2012,207(5):52-64.
[20] 勞小斌,劉曉強,邱春嫦.宮頸癌患者人乳頭狀瘤病毒16型感染與P53基因表達及臨床意義[J].中華醫院感染學雜志,2013,23(24):5918-5920.
河南省科技攻關計劃普通項目(152102310074)。
李巧云(E-mail: qiaoYunli11@163.com)
10.3969/j.issn.1002-266X.2017.03.010
R737.33
A
1002-266X(2017)03-0036-03
2016-08-18)

