lncRNAs在淋巴造血系統腫瘤中的研究進展*
潘毅 綜述 孫保存 審校
·綜述·
lncRNAs在淋巴造血系統腫瘤中的研究進展*
潘毅 綜述 孫保存 審校
長鏈非編碼RNAs(long noncoding RNAs,lncRNAs)是長度≥200個核苷酸的非蛋白編碼轉錄子。多數lncRNAs在腫瘤組織中顯示致癌基因的作用,通過影響腫瘤細胞的增生、遷移、浸潤和轉移促進腫瘤的發生發展;部分lncRNAs已成為特定腫瘤的診斷及預后標志物。對其表達、功能及機制的研究成為當前腫瘤研究的熱點,但多集中于上皮源性腫瘤。本文旨在對lncRNAs在淋巴造血系統腫瘤中的研究進展進行綜述。
lncRNAs 淋巴造血系統腫瘤 生物標志物
非編碼RNAs(noncoding RNAs,ncRNAs)由“管家”RNAs和具有調節作用的RNAs組成。依據大小的不同,又分為短鏈和長鏈ncRNAs(long noncoding RNAs,lncRNAs):短鏈者<200個核苷酸,長鏈者在200~100 Kb個核苷酸之間[1]。lncRNAs可在表觀、轉錄及轉錄后水平調節基因的表達,并在多種生物學過程中發揮重要作用;其異常表達參與多種腫瘤的發生與發展過程[2]。本文旨在對lncRNAs在腫瘤中的作用機制,與腫瘤發生發展及預后的關系等研究進展進行綜述。
1 lncRNAs的結構、功能及作用機制
1.1 lncRNAs的結構
大多數lncRNAs通過RNA聚合酶Ⅱ進行轉錄,通過5'加帽和3'多聚腺苷酸加尾。最近通過GENCODE的評估,人類基因組包含約16 000個基因,編碼超過28 000個不同的lncRNAs轉錄子[3]。
Novikova等[4]首次報告類固醇受體RNA活化子(steroid receptor RNA activator,SRA)這種人類lncRNA的二級結構。SRA共激活幾種人類性激素受體并與乳腺癌強相關。研究人員發現這種lncRNA具有復雜的結構,由4個域構成,有多種二級結構成分[4]。lncRNAs的促進子富于A/T核苷酸但CpG模式較少,包含特征性的結合序列,并具有獨特的與蛋白編碼基因相關的染色質標記模式[5]。
1.2 lncRNAs的定位與功能
lncRNAs在細胞內的定位某種程度上決定其功能,核內lncRNAs與核染色質發生相互作用;胞漿lncRNAs可以調節mRNAs的穩定性或翻譯過程,以及影響細胞信號的級聯放大作用[6]。近期研究表明,通過ChIRP、Chart和RAP等方法闡明lncRNAs通過與DNA、染色質、信號通路、調節蛋白以及細胞內各種RNA之間的相互作用而發揮功能[7]。
在人細胞中Hox轉錄反義RNA(HOX transcript antisense RNA,HOTAIR)從HoxC基因簇轉錄,并且通過反式作用表觀抑制HoxD簇[8]。單純靶向去除HOTAIR位點確實影響HoxD基因的表達。新近發展的技術如CRISPR-Cas9系統可以進行有效靶向基因組設計。這些體內靶向去除研究對于揭示很多lncRNAs的真正功能是非常重要的[9]。
1.3 lncRNAs作用機制
1.3.1 lncRNAs的作用機制依賴于與細胞大分子之間的相互作用(圖1)[7]與核染色質結合的lncRNAs可以通過控制局部染色質的結構(上部)或指向招募調節分子到特定位點(下部)來調節基因的表達(圖1A);lncRNAs與多個蛋白之間的作用可以促進蛋白復合物的組裝(上部)或影響蛋白與蛋白之間的相互作用(下部)(圖1B);mRNAs與lncRNAs的相互作用可以影響蛋白發揮作用,這些蛋白參與mRNAs代謝的多個方面,包括影響剪接、mRNAs的穩定性、翻譯(上部)以及去除對應靶mRNAs的miRNAs(下部)(圖1C)。
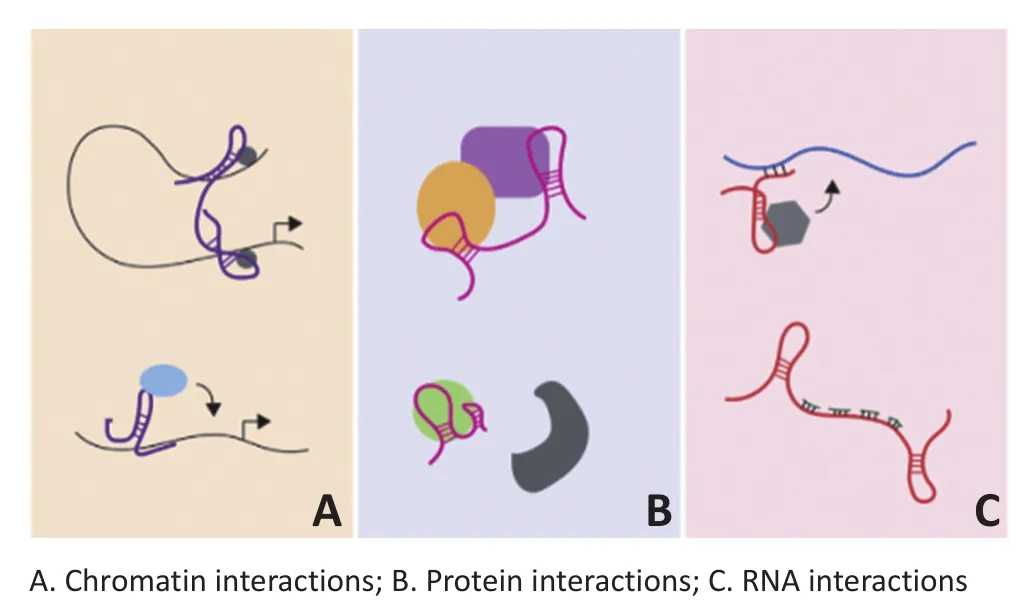
圖1 lncRNAs與細胞大分子之間的相互作用示意圖Figure 1Schematic diagram of the interactions between lncRNAs and cellular macromolecules
1.3.2 lncRNAs與miRNAs的相互作用特定的lncRNAs與miRNAs可以相互調節[10]。在血細胞分化過程中證實miRNAs和lncRNAs有互補表達模式[9]。lncRNAs被假設作為競爭性內源性RNA(competing endogenous RNA,ceRNA)或者RNA海綿,以這種方式與miRNAs相互作用。
2 lncRNAs在淋巴造血系統腫瘤中的研究進展
2.1 lncRNAs與非霍奇金淋巴瘤
2.1.1 lncRNAs與濾泡性淋巴瘤本文通過微陣列芯片方法對比3a級FL和反應性增生的淋巴結,發現1 580個lncRNAs上調表達,1 213個lncRNAs下調表達。在這些lncRNAs中,189個lncRNAs顯示明顯差異表達,其中152個lncRNAs上調表達,37個lncRNAs下調表達。本研究觀察到上調表達的lncRNAs多于下調表達者。通過qRT-PCR在獨立樣本中的驗證發現,ENST00000545410(RP11-625 L16.3)在FL3a中顯示明顯上調表達,但是其生物學功能仍亟待研究。有研究提示,其潛在的功能和分子機制將被進一步闡明,以明確其是否在濾泡性淋巴瘤(follicular lymphoma,FL)的發生機制中具有一定的作用[11]。
2.1.2 lncRNAs與彌漫性大B細胞淋巴瘤Verma等[12]通過RNA-seq及生物信息學分析,證實了2 632個新的含多個外顯子的lncRNAs,其中約2/3不表達于正常B細胞,并且很多lncRNAs具有接合結構。在彌漫性大B細胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)的生發中心B細胞亞型(germinal center B cell subtype,GCB型)和活化B細胞亞型(activated B cell subtype,ABC型)中,超過1/3的lncRNAs出現差異表達。在DLBCL中發現的2 632個lncRNAs顯著擴大淋巴瘤轉錄組的范圍,證實這些lncRNAs在DLBCL形成和(或)維持方面的潛在作用。
2.1.3 lncRNAs與伯基特淋巴瘤在多種人類惡性腫瘤中,染色體8q24位點的擴增是經典的致瘤事件,它導致MYC基因的擴增,越來越多的證據表明在MYC驅動的腫瘤中lncRNAs亦發揮著重要作用。Tseng等[13]發現在伯基特淋巴瘤(Burkitt's lymphoma,BL)中,PVT1是位于t(2:8)易位斷裂點的lncRNA,它使人類的免疫球蛋白增強子位于PVT1-MYC的融合位點上。在MYC致瘤小鼠模型上,僅單一拷貝的MYC擴增對于增強腫瘤的形成是不夠的,當包括MYC和lncRNA Pvt1多基因片段擴增時,腫瘤的發展得到有效促進。
Doose等[14]證實在IG-MYC陽性的BL中有13個差異表達的lncRNAs,并且這些lncRNAs在細胞系中被MYC調節的趨勢是相同的。其中,MYC誘導的長鏈非編碼RNA(MYC-induced long noncoding RNA,MINCR)在MYC陽性的淋巴瘤中顯示與MYC表達強相關。推測MINCR參與MYC轉錄網絡中控制細胞周期基因表達的過程[14]。
2.1.4 lncRNAs與T細胞淋巴瘤Lee等[15]通過對惡性塞扎里細胞(Sezary cell,SC)和非惡性的CD4+T細胞進行全轉錄組配對末端測序,證實SC和蕈樣霉菌病相關的lncRNAs和新的轉錄子。針對差異表達基因的信號通路分析表明PI3K/Akt、TGFβ、NF-κB和T-cell受體信號通路均出現調節異常。生物信息學分析證實21個SC相關的lncRNAs。該研究顯示塞扎里綜合征(Sezary syndrome,SS)轉錄組的特征,并支持在人類惡性腫瘤中lncRNAs失調的現象。
2.2 lncRNAs與霍奇金淋巴瘤
霍奇金淋巴瘤(Hodgkin's lymphoma,HL)是生發中心B細胞起源的惡性淋巴瘤。Tayari等[16]研究正常B細胞亞群、HL細胞系和HL組織中lncRNAs的表達。在HL和正常生發中心B細胞中觀察到475個lncRNAs明顯差異表達。應用RNA熒光原位雜交技術在原發HL組織中顯示3個lncRNAs的腫瘤細胞特異性表達,這3個lncRNAs有可能成為有價值的生物標志物。
2.3 其他
2.3.1 小淋巴細胞性淋巴瘤/慢性淋巴細胞白血病(small lymphocytic lymphoma/chronic lymphocytic leukemia,SLL/ CLL)和多發性骨髓瘤Isin等[17]為探究CLL和多發性骨髓瘤(multiple myeloma,MM)患者循環lncRNAs水平,選取5個lncRNAs為研究對象,包括TUG1、lincRNA-p21、MALAT1、HOTAIR和GAS5。lincRNA-p21是在慢性淋巴細胞白血病(chronic lymphocytic leukemia,CLL)組唯一顯示明顯變化的分子,而其他的lncRNAs在MM組有顯著改變。這些lncRNAs的差異表達顯示其具有組織和病變特異性,可作為特定疾病的有潛力的標志物。
2.3.2 前驅B細胞急性淋巴細胞白血病Rodríguez-Malavé等[18]通過對人類前驅B細胞急性淋巴細胞白血病(precursor B cell acute lymphoblastic leukemia,B-ALL)樣本的基因表達譜研究發現lncRNAs的差異表達。其中,BALR-6(B-ALL associated long RNA-6)顯示最高表達并具有MLL重排。功能實驗顯示,在人類B-ALL細胞系中siRNA介導的BALR-6敲除,降低細胞增殖和增加細胞死亡;而在人類和小鼠細胞系中過表達BALR-6的異構體,增加細胞增殖和減低了細胞凋亡。這些研究支持lncRNA BALR-6在B-ALL中具有促進腫瘤細胞存活的作用[18]。
3 lncRNAs作為腫瘤診斷標志物
除了在腫瘤生物學上的可能作用之外,lncRNAs已作為一種新的有希望的腫瘤標志物出現,其在不同類型惡性腫瘤的診斷方面具有較好的應用前景。
3.1 前列腺癌
前列腺癌抗原3(prostate cancer antigen 3,PCA3),是在前列腺癌中研究較透徹的lncRNAs,其在超過95%的原發前列腺癌和轉移灶中出現強的過表達[19],是目前已知的最特異的前列腺癌基因。PCA3可以在尿液中被檢測到,PROGENSA PCA3檢測是率先被美國食品及藥物管理局(Food and Drug Administration,FDA)認證的基于尿液的分子診斷檢測方法[20]。
3.2 胃癌
應用血漿H19來診斷胃癌在獨立的研究中揭示出一致的結果。Arita等[21]發現胃癌患者血漿H19的水平明顯高于健康對照者,具有74%的敏感性和58%的特異性。Zhou等[22]研究獲得82.9%的敏感性和72.9%的特異性。而且,上述研究中患者血漿中增高的H19水平在術后均顯著降低,提示在腫瘤組織塊和循環H19濃度之間的直接相關性。
3.3 其他
在尿液中發現的尿路上皮癌1(urothelial carcinoma associated 1,UCA1),可作為膀胱癌高度敏感性和特異性的標志物[23];在肝細胞癌患者血漿中可高頻次檢測到HULC(highly up-regulated in liver cancer,HULC),使其成為肝細胞癌頗有希望的診斷標志物[24],這些均提示lncRNAs可作為腫瘤診斷標志物的良好應用前景。
4 lncRNAs作為腫瘤預后標志物
多數lncRNAs發揮致癌基因的作用,其表達與預后差成正相關,使其成為可提示預后的生物標記物。Peng等[25]發現lncRNA LUNAR1的高表達與分期和國際預后指數(IPI)明顯相關。實驗證實敲除LUNAR1可明顯抑制DLBCL細胞的增生,提示其可作為候選的預后標志物。轉移相關肺腺癌轉錄子1(metastasis-associated lung adenocarcinoma transcript1,MALAT1)是早期肺腺癌轉移狀態的預測因子。在人肺癌細胞敲除MALAT1基因模型中,顯示MALAT1具有調節轉移相關基因的功能,并在肺癌荷瘤小鼠模型中得到驗證[26]。
少數lncRNAs具有抑癌基因的作用。生長抑制特異性5(growth arrest specific 5,GAS5)是腫瘤抑制lncRNA。GAS5在腎細胞癌等腫瘤中下調表達[27]。低水平的GAS5提示腫瘤患者有較差的預后[28]。
5 lncRNAs作為潛在的治療靶點
靶向lncRNAs的治療現正成為腫瘤靶向治療的探索領域之一。小分子干擾RNA既可有效去除胞漿lncRNAs,也可成功靶向核lncRNAs;此外,反義寡核苷酸(antisense oligonucleotides,ASOs)是嵌合的RNA/ DNA寡核苷酸,可指導RNase H來裂解互補的靶mRNAs或lncRNAs[29]。臨床前實驗顯示ASOs靶向腫瘤相關lncRNAs的有效性。如在小鼠MMTV-PyMT乳腺癌模型中,ASOs靶向MALAT1在體內通過促進胞囊分化,增加細胞黏附和降低遷移顯示出治療效果[30]。
6 結語
目前,對于lncRNAs的大部分研究局限于腫瘤組織/細胞系與正常組織/細胞系中的差異表達,對其功能和機制的研究尚處于起步階段,亦是未來研究之重點和熱點。期待隨著新的分子技術的發展與對腫瘤lncRNAs通路的不斷加深認識,將會為基于lncRNAs的腫瘤診斷、靶向治療及預后分析提供更多的信息和機會。
[1]Mattick JS.Non-coding RNAs:the architects of eukaryotic complexity[J].EMBO Rep,2001(11):986-991.
[2]Cao JN.The functional role of long non-coding RNAs and epigenetics[J].Biol Proced Online,2014,16(1):11.
[3]Huarte M.The emerging role of lncRNAs in cancer[J].Nat Med, 2015,21(11):1253-1261.
[4]Novikova IV,Hennelly SP,Sanbonmatsu KY.Structural architecture of the human long non-coding RNA,steroid receptor RNA activator [J].Nucleic Acids Res,2012,40(11):5034-5051.
[5]Alam T,Medvedeva YA,Jia H,et al.Promoter analysis reveals globally differential regulation of human long Non-Coding RNA and protein-coding genes[J].PLoS One,2014,9(10):e109443.
[6]Batista PJ,Chang HY.Long noncoding RNAs:cellular address codes in development and disease[J].Cell,2013,152(6):1298-1307.
[7]Schmitt AM,Chang HY.Long noncoding RNAs in cancer pathways [J].Cancer Cell,2016,29(4):452-463.
[8]Rinn JL,Kertesz M,Wang JK,et al.Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs[J].Cell,2007,129(7):1311-1323.
[9]Alvarez-Dominguez JR,Hu WQ,Gromatzky AA,et al.Long noncoding RNAs during normal and malignant hematopoiesis[J].Int J Hematol,2014,99(5):531-541.
[10]Cesana M,Cacchiarelli D,Legnini I,et al.A long noncoding RNA controls muscle differentiation by functioning as a competing endogenous RNA[J].Cell,2011,147(2):358-369.
[11]Pan Y,Li HX,Guo Y,et al.A pilot study of long noncoding RNA expression profiling by microarray in follicular lymphoma[J].Gene, 2016,577(2):132-139.
[12]Verma A,Jiang YW,Du W,et al.Transcriptome sequencing reveals thousands of novel long non-coding RNAs in B cell lymphoma[J]. Genome Med,2015,7(1):110.
[13]Tseng YY,Moriarity BS,Gong W,et al.PVT1 dependence in cancer with MYC copy-number increase[J].Nature,2014,512(7512):82-86. [14]Doose G,Haake A,Bernhart SH,et al.MINCR is a MYC-induced lncRNA able to modulate MYC's transcriptional network in Burkitt lymphoma cells[J].Proc Natl Acad Sci U S A,2015,112(38):e5261-5270.
[15]Lee CS,Ungewickell A,Bhaduri A,et al.Transcriptome sequencing in Sezary syndrome identifies Sezary cell and mycosis fungoides-associated lncRNAs and novel transcripts[J].Blood,2012,120(16): 3288-3297.
[16]Tayari MM,Winkle M,Kortman GA,et al.Long noncoding RNA expression profiling in normal B-Cell subsets and hodgkin lymphoma reveals hodgkin and Reed-Sternberg cell specific long noncoding RNAs[J].Am J Path,2016,186(9):2462-2472.
[17]Isin M,Ozgur E,Cetin G,et al.Investigation of circulating lncRNAs in B-cell neoplasms[J].Clin Chim Acta,2014,431(3):255-259.
[18]Rodríguez-Malavé NI,Fernando TR,Patel PC,et al.BALR-6 regulates cell growth and cell survival in B-lymphoblastic leukemia[J].Mol Cancer,2015,14(1):214.
[19]Hessels D,Gunnewiek JM,Van Oort I,et al.DD3(PCA3)-based molecular urine analysis for the diagnosis of prostate cancer[J].Eur Urol,2003,44(1):8-15.
[20]Lee GL,Dobi A,Srivastava S.Prostate cancer:diagnostic performance of the PCA3 urine test[J].Nat Rev Urol,2011,8(3):123-124.
[21]Arita T,Ichikawa D,Konishi H,et al.Circulating long non-coding RNAs in plasma of patients with gastric cancer[J].Anticancer Res, 2013,33(8):3185-3193.
[22]Zhou X,Yin C,Dang Y,et al.Identification of the long non-coding RNA H19 in plasma as a novel biomarker for diagnosis of gastric cancer[J].Sci Rep,2015,5(2):11516.
[23]Wang XS,Zhang Z,Wang HC,et al.Rapid identification of UCA1 as a very sensitive and specific unique marker for human bladder carcinoma[J].Clin Cancer Res,2006,12(16):4851-4858.
[24]Xie H,Ma H,Zhou D.Plasma HULC as a promising novel biomarker for the detection of hepatocellular carcinoma[J].Biomed Res Int, 2013,2013(23):136106.
[25]Peng W,Feng JF.Long noncoding RNA LUNAR1 associates with cell proliferation and predicts a poor prognosis in diffuse large B-cell lymphoma[J].Biomed&Pharmaco,2016,77(3):65-71.
[26]Gutschner T,H?mmerle M,Eissmann M,et al.The noncoding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells[J].Cancer Res,2013,73(3):1180-1189.
[27]Qiao HP,Gao WS,Huo JX,et al.Long non-coding RNA GAS5 functions as a tumor suppressor in renal cell carcinoma[J].Asian Pac J Cancer Prev,2013,14(2):1077-1082.
[28]Sun M,Jin FY,Xia R,et al.Decreased expression of long noncoding RNA GAS5 indicates a poor prognosis and promotes cell proliferation in gastric cancer[J].BMC Cancer,2014,14(1):1-12.
[29]Ideue T,Hino K,Kitao S,et al.Efficient oligonucleotide-mediated degradation of nuclear noncoding RNAs in mammalian cultured cells[J].Rna-A Publication Of The Rna Society,2009,15(8):1578-1587.
[30]Arun G,Diermeier S,Akerman M,et al.Differentiation of mammary tumors and reduction in metastasis upon Malat1 LncRNA loss[J]. Cancer Res,2016,76(6):34-51.
(2016-08-12收稿)
(2016-10-18修回)
(編輯:孫喜佳校對:武斌)
Research progress on lncRNAs in haematopoietic and lymphoid tissue tumors
Yi PAN,Baocun SUN
Department of Pathology,National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin Medical University Cancer Institute and Hospital,Tianjin 300060,China
This work was supported by the Individual Medical Platform Construction Project of National Clinical Research Center for Cancer(No. 13ZCZCSY20300)
Baocun SUN;E-mail:baocunsun1950@aliyun.com
Long noncoding RNAs(lncRNAs)are non-protein coding transcripts longer than 200 nucleotides.Most lncRNAs have pronounced oncogenic effects associated with tumorigenesis and progression,promoting the proliferation,migration,invasion,and metastasis of tumor cells.The specific lncRNAs expression in particular types of cancers makes them promising diagnostic and prognostic biomarkers.Currently,studies on lncRNAs expression,functions,and mechanisms have attracted considerable attention in cancer research.However,these studies mainly focus on epitheliogenic malignant tumors.In this review,we outline the current state of information on lncRNAs and research progress on its role in haematopoietic and lymphoid tissue tumors.
long noncoding RNAs,haematopoietic and lymphoid tissue tumors,biomarkers

10.3969/j.issn.1000-8179.2017.02.949
天津醫科大學腫瘤醫院病理科,國家腫瘤臨床醫學研究中心,天津市腫瘤防治重點實驗室,天津市惡性腫瘤臨床醫學研究中心(天津市300060)
*本文課題受國家腫瘤臨床醫學研究中心個體化醫學平臺建設項目(編號:13ZCZCSY20300)資助
孫保存baocunsun1950@aliyun.com
潘毅專業方向為淋巴及頭頸腫瘤的病理診斷。
E-mail:tjphyLP@126.com

