腦血管周圍間隙擴大的危險因素及臨床意義
唐 健綜述, 石勝良審校
腦血管周圍間隙擴大的危險因素及臨床意義
唐 健1綜述, 石勝良2審校
腦血管周圍間隙是圍繞在腦穿通動脈及穿通靜脈周圍的間隙,與軟腦膜下腔相通,是腦組織間液回流的重要途徑[1],最先由德國病理學家Rudolf Virchow和法國生物學家charles Philippe Robin發現并描述,故也被稱為Virchow-robin間隙(Virchow-Robin space,VRS)[2]。正常大小的VR間隙在顱腦MRI上難以被檢出,僅當VR間隙直徑擴大后才能在MR影像上被觀察到,故目前很多研究者認為在MR上能被觀察到的血管周圍間隙即為血管周圍間隙擴大(dilated Virchou-Robin space,dVRS)[3]。早期報道顯示少量的dVRS可以在許多無臨床癥狀的人群中觀察到,故通常認為無臨床意義,大量出現的dVRS更常見于一些患有器質性疾病的人群,可能參與某些疾病的發病過程[4]。近年來研究發現dVRS在患有腦小血管病(cerebral small vessel diseases,CSVD)及癡呆的人群中更加常見,并與腔隙性腦梗死及腦白質疏松嚴重程度相關,推測其可能是CSVD的影像表現[5]。本文就近年來關于dVRS危險因素及臨床意義方面的研究做一綜述。
1 dVRS的定義及分級標準
dVRS多見于基底節區、皮質下白質、半卵圓中心、大腦腳等部位,也可見于海馬、島葉、腦橋、小腦等。根據切面不同,dVRS可以呈圓形或者線狀,通常與穿通動脈走向一致,邊界光滑清楚,直徑通常<3 mm,一般無占位效應(見圖1)[3],偶報道有直徑超過20 mm的巨大血管周圍間隙,可能被誤診為一些腦部薄壁囊腫,如:神經膠質囊腫、室管膜囊腫、囊狀的寄生蟲等,根據dVRS的解剖特征有利于鑒別,dVRS往往好發于穿支動脈的部位,與血管走行一致,周圍多伴隨有其他dVRS,信號與腦脊液相近[6]。
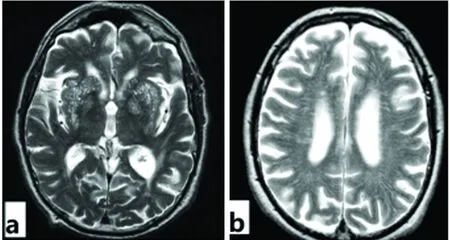
圖1 a:(T2像)基底節區呈點狀分布的dVRS;b:(T2像)半卵圓中心呈線樣分布的dVRS
dVRS嚴重程度的分級方式目前無統一標準,以按數量進行分類居多,由于基底節區及半卵圓中心的dVRS解剖上存在差異,常常將以上兩個部位的dVRS分開計數。如Maclullich AM等根據dVRS數量,選擇dVRS最多的大腦半球,按統一分級的標準分別將海馬區、基底節區及半卵圓中心分為4個等級:0分=無dVRS,1分為dVRS<10個,2分為dVRS10~20個,3分為dVRS21~40個,4分為dVRS>40個[7]。朱以誠等按不同標準對基底節區、半卵圓中心進行分級:評估基底節區dVRS時,選擇dVRS數量最多的層面進行分級,1級為dVRS<5個,2級為6~10個,3級數量為dVRS>10個但仍可計數,4級為dVRS無法計數;半卵圓中心dVRS分級相對復雜,1級:合計所有層面的白質,dVRS<10個,2級:合計所有層面的白質,dVRS總數>10個,但在顯示最多的dVRS白質層面,dVRS<10個;3級:在顯示最多的dVRS的白質層面,10≤dVRS≤20個;4級:在顯示最多dVRS的白質層面,dVRS>20個[8]。上述兩種分級方法各有利弊,Maclullich AM的分級方法較為簡單易行,朱以誠的分級方法兼顧了不同部位上血管密度的差異,但較為繁瑣。也有兼顧dVRS大小及數量進行分級的方法,此類方法較為繁瑣,僅被少數研究者采用,故在此不作贅述。
2 dVRS的危險因素、發病機制及與CSVD的關系
dVRS的形成機制尚不清楚,鑒于其在解剖位置上與腦小血管接近,故推測很可能與腦小血管病變有關[9]。當腦小血管出現病變時,血管內皮損害、平滑肌增厚、血腦屏障受損,進而更多的物質通過血管滲透到血管周圍間隙,導致血管周圍間隙擴大。Doubal在253例急性腦梗死患者研究中發現,校正了年齡、腦白質疏松、腦萎縮、血管性危險因素的影響之后,基底節區dVRS的嚴重程度與是否為小血管閉塞類型梗死及腦白質疏松嚴重程度有關,提示dVRS可能與腦小血管病有共同危險因素,亦或是其影像學表現[5]。
由于解剖學上的差異,不同部位小血管病發病機制不盡相同,基底節區域血供多由穿支動脈供應,這些穿支動脈多呈直角發出,更容易受到高血壓等血管危險因素影響,而皮質及皮質下白質的血供由軟腦膜動脈發出,受血管危險因素影響相對較少,但卻是淀粉樣血管病(cerebral amyloid angiopathy,CAA)的好發部位。多項研究顯示不同類型腦小血管病患者的dVRS分布同樣遵循這一規律[8,10]。一項探究血管周圍間隙擴大與動態血壓關系的研究發現,在143名首發腔隙性腦梗死患者中,校正了年齡、性別、嚴重腦白質疏松、癥狀性腔隙性腦梗死的影響后,全日的收縮壓及舒張壓、24 h舒張壓與基底節區dVRS嚴重程度有關,而各項血壓指標與半卵圓中心dVRS嚴重程度無明顯關系[11],這提示基底節區的dVRS更易受高血壓的影響。另一項基于1818名卒中后非癡呆人群探究血管周圍間隙危險因素的研究顯示,嚴重的基底節及腦白質dVRS均與高齡、高血壓有關,男性合并基底節區dVRS機率較女性高[8],這可能與男性傾向于吸煙及飲酒有關。
CAA以淀粉樣物質沉積在血管壁為病理特點的一類小血管病,局限于大腦皮質的腦出血或微出血、皮質的鐵黃素沉積、以及靠近大腦后部的腦白質疏松病灶是CAA的影像特點,淀粉樣物質標記的PET檢查也是診斷CAA的有效方法[12]。除靠近大腦后部腦白質疏松之外,上述影像學表現難以被常規MR發現,相比之下dVRS可以被常規MR檢出,近年來研究發現半卵圓中心的dVRS與CAA關系密切,并認為可能是CAA的影像學表現之一,如果這一推論得到證實,無疑為CAA的早期診治帶來曙光。Charidimou A發現半卵圓中心的dVRS在病理確診CAA腦出血患者中更為常見[13],并與皮質微出血、皮質鐵黃素沉積、腦白質疏松、PitB物質沉積等CAA影像學表現相關[14],將dVRS加入到CAA的波士頓診斷標準可提高診斷敏感度而又不降低其特異度[13]。Van Veluw SJ回顧了5例CAA患者的病理資料及既往頭部MRI檢查資料,發現近皮質的dVRS與淀粉樣病變嚴重程度成正比[10]。眾多證據提示半卵圓中心dVRS的形成可能與淀粉樣物質沉積有關,血管周圍的淀粉樣物質沉積導致組織間液回流受阻,進而導致了血管周圍間隙擴大,然而尚需大樣本前瞻性研究來驗證這一假設。其他關于dVRS的形成機制還包括:血管迂曲和腦萎縮導致細胞外水分聚集、VRS纖維化和閉塞以及由此引起的液體流動阻力增加[3]。
3 dVRS的臨床意義
3.1 dVRS與認知功能的關系 Maclullich AM在基于健康老年人群認知功能的研究中發現,基底節及半卵圓中心的dVRS與非言語推理能力及視空間能力評分負相關[7]。Zhu等對1778例非癡呆老年人患者進行為期4 y的隨訪,在校正了腦白質病變、腦梗死對認知功能的影響之后,發現基底節區dVRS的老年人發生癡呆的機會顯著增加[15]。在一項基于189例高血壓及腔隙性腦梗死患者的研究中,Huijts等發現基底節區dVRS嚴重程度與信息執行功能減退有關,并且其相關性獨立于年齡及腦白質疏松嚴重程度[16]。然而并非所有研究的結果均支持dVRS與認知功能損害相關,Hurford對246例缺血性腦卒中及TIA患者進行了復雜的認知功能測定,包括總體認知功能、言語及聽覺記憶、命名能力、感知覺、信息處理速度及執行功能等七個認知方面,并對他們CSVD的影像學表現進行評分,結果未發現dVRS與任何認知領域損害相關[17]。上述研究結果的差異可能與其入組人群不同有關,Huijts等研究對象是腦小血管人群,而Hurford R則以缺血性卒中及TIA患者為研究對象。此外,各項研究中dVRS的分級標準以及認知功能測評量表不同也可能對研究結果造成影響。
3.2 dVRS對腦卒中的影響 Yang等比較分析了426例首發腔隙性腦梗死dVRS分布特點與腔隙性腦梗死1 y后預后之間的關系,發現嚴重的基底節區dVRS與首發腔隙性腦梗死1 y后mRS評分升高有關,然而在納入了腦白質疏松(LA)、靜息缺血灶(SBI)、糖尿病、高血壓等因素進行多因素分析后,未發現基底節區dVRS與預后不良獨立相關,Yang推測可能是由于dVRS與SBI、LA等存在共線性關系導致的,隨后他將dVRS、LA、SBI合并計算總體CSVD的嚴重程度并與其他腔隙性腦梗死復發的危險因素再次進行多因素分析后發現,發現總體CSVD嚴重程度與腔隙性腦梗死1 y后預防不良有關[18],這提示合并嚴重腦白質疏松、血管間隙擴大或者大腦靜息缺血灶的腦梗死患者可能預后不良,這可能與其腦小血管受累,代償功能減退有關,這類人群需要進行規范的二級預防治療。多項研究顯示合并有腦白質疏松、腔隙狀態或是微出血的腦梗死患者在抗栓治療的過程中發生出血轉化的風險增高,其機制可能與血腦屏障損害有關[19],上述影像學對急性腦梗死的抗栓治療有重要參考價值,關于dVRS與腦梗死出血轉換及腦梗死復發的關系尚待大樣本前瞻性研究進一步證實。
4 dVRS的研究前景
CSVD是導致血管性認知損害及癡呆的重要原因,已經逐漸成為近年來研究的熱點,早期診斷及治療CSVD對預防癡呆有重要意義。dVRS在解剖位置上與腦小血管毗鄰,與腦白質疏松以及其他特征性的小血管病影像學改變關系密切,很可能是CSVD的早期影像學標志[19]。多項橫斷面研究顯示特定腦區的dVRS對腦小血管病病因分型有早期參考價值,有利于在早期對CSVD進行病因干預,值得更進一步研究。
[1]Abbott NJ. Evidence for bulk flow of brain interstitial fluid:significance for physiology and pathology[J]. Neurochem International,2004,45:545-552.
[2]Bokura H,Kobayashi S,Yamaguchi S. Distinguishing silent lacunar infarction from enlarged virchow-robin spaces:A magnetic resonance imaging and pathological study[J]. J Neurol,1998,245:116-122.
[3]Kwee RM,Kwee TC. Virchow-robin spaces at mr imaging[J]. Radiographics,2007,27:1071-1086.
[4]Groeschel S,Chong WK,Surtees R,et al. Virchow-robin spaces on magnetic resonance images:Normative data,their dilatation,and a review of the literature[J]. Neuroradiology,2006,48:745-754.
[5]Doubal FN,MacLullich AM,Ferguson KJ,et al. Enlarged perivascular spaces on mri are a feature of cerebral small vessel disease[J]. Stroke,2010,41:450-454.
[6]Lim AT,Chandra RV,Trost NM,et al. Large anterior temporal virchow-robin spaces:Unique mr imaging features[J]. Neuroradiology,2015,57:491-499.
[7]Maclullich AM,Wardlaw JM,Ferguson KJ,et al. Enlarged perivascular spaces are associated with cognitive function in healthy elderly men[J]. J Neurol Neurosurg Psychiat,2004,75:1519-1523.
[8]Zhu YC,Tzourio C,Soumare A,et al. Severity of dilated virchow-robin spaces is associated with age,blood pressure,and mri markers of small vessel disease:A population-based study[J]. Stroke,2010;41:2483-2490.
[9]Potter GM,Doubal FN,Jackson CA,et al. Enlarged perivascular spaces and cerebral small vessel disease[J]. Inter J Stroke,2015,10:376-381.
[10]van Veluw SJ,Biessels GJ,Bouvy WH,et al. Cerebral amyloid angiopathy severity is linked to dilation of juxtacortical perivascular spaces[J]. J Cerebral Blood Flow Metabolism,2016,36:576-580.
[11]Klarenbeek P,van Oostenbrugge RJ,Lodder J,et al. Higher ambulatory blood pressure relates to enlarged virchow-robin spaces in first-ever lacunar stroke patients[J]. J Neurol,2013,260:115-121.
[12]Yamada M. Cerebral amyloid angiopathy:Emerging concepts[J]. J Stroke,2015,17:17-30.
[13]Charidimou A,Jaunmuktane Z,Baron JC,et al. White matter perivascular spaces:An mri marker in pathology-proven cerebral amyloid angiopathy[J]. Neurology,2014,82:57-62.
[14]Charidimou A,Hong YT,Jager HR,et al. White matter perivascular spaces on magnetic resonance imaging:Marker of cerebrovascular amyloid burden[J]. Stroke,2015,46:1707-1709.
[15]Zhu YC,Dufouil C,Soumare A,et al. High degree of dilated virchow-robin spaces on mri is associated with increased risk of dementia[J]. J Alzheimer’s Dis,2010,22:663-672.
[16]Huijts M,Duits A,Staals J,et al. Basal ganglia enlarged perivascular spaces are linked to cognitive function in patients with cerebral small vessel disease[J]. Current Neurovasc Res,2014,11:136-141.
[17]Hurford R,Charidimou A,Fox Z,et al. Mri-visible perivascular spaces:Relationship to cognition and small vessel disease mri markers in ischaemic stroke and tia[J]. J Neurol eurosurg Psychiat,2014,85:522-525.
[18]Yang H,Shen R,Jin Z,et al. Dilated virchow-robin spaces in first-ever lacunar stroke patients:Topography and clinical correlations[J]. J Stroke Cerebrovasc Dis,2016,25:306-311.
[19]Pantoni L. Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeutic challenges[J]. The Lancet Neurol,2010,9:689-701.
1003-2754(2017)01-0095-02
R743
2016-09-15;
2016-12-26
(1.廣西醫科大學,廣西 南寧 530021;2.廣西醫科大學第二附屬醫院神經內科,廣西 南寧 530021)
石勝良,E-mail:ssl_1964@163.com

