血清γ-谷氨酰基轉移酶在阻塞性睡眠呼吸暫停低通氣綜合征中的變化及其預測意義
陳娟
蘇州市吳江區第一人民醫院呼吸內科,江蘇蘇州 215200
作為一種全身性的疾病,OSAHS常累及患者的心腦血管及其他臟器,對患者的身心健康造成極大程度的破壞。而慢性間歇低氧(chronic intermittenthypoxia,CIH)會造成體內的氧化應激水平高于正常人,因此導致患者體內的心腦血管發生器質性損傷。相關研究指出[1],血清γ-谷氨酰基轉移酶可作為觀察指標來評估全身氧化應激水平,但是對于OSAHS患者血清中的γ-GT水平與代謝損傷之間的相關性的研究存在空白。該次實驗中,根據2015年1月—2016年12月于該院進行治療的80例OSAHS患者的嚴重程度的差異與血清中γ-GT含量的相關性進行比較,詳情見如下報道。
1 資料與方法
1.1 一般資料
納入2015年1月—2016年12月在該院睡眠中心多導睡眠監測(polysomnograhpy,PSG)的患者80例,其中男性52例,女性 28例。 年齡 28~67歲,平均年齡(32.8±5.4)歲。入院前的常規檢查中,上述患者均無呼吸系統之外的其他器官及其系統的功能性或器質性病變,同時年齡、性別等一般資料差異無統計學意義(P>0.05)。該次實驗經過該院倫理協會審核同意,過程中的各項操作均取得患者及其家屬的知情同意。根據中華醫學會呼吸病學分會OSAHS診治指南[1]對于睡眠呼吸暫停低通氣指數(apnea hypopnea index,AHI)的診斷標準,其中AHI<5次/h的患者為非OSAHS組,共26例;AHI在5~30次/h的患者為輕中度OSAHS組,共 26例;剩余 28例患者 AHI>30次/h,為重度組。另外,將OSAHS患者根據血糖水平具體分為合并糖尿病和不合并糖尿病兩組,根據患者血清中的γ-GT水平, 其中 γ-GT≤40 IU/L的患者為低 γ-GT組,γ-GT>40 IU/L的患者為高γ-GT組。
1.2 研究方法及流程
對該次實驗中的所有研究對象進行PSG檢測前進行詳細的病史采集,具體包括:夜間打鼾、患病史及用藥史,同時計算患者的體重指數。儀器選擇Alice4型多導睡眠分析儀進行全夜睡眠監控,檢測時間≥7 h,檢測指標具體包括:口鼻氣流、腦電圖、下頜肌電圖、胸腹呼吸運動、體位及鼾聲。上述監測結束后,上述所有數據經專業睡眠呼吸醫師進行處理,計算出觀察對象的AHI、氧減指數(oxygen desaturation index,ODI)、夜間最低指脈氧飽和度(lowest SpO2,LSpO2)等相關呼吸指數。結束相關觀察后,高壓液相色譜法測定血清糖化血紅蛋白(glycosylated hemoglobin A1,HbA1c)。進行口服葡萄糖耐量試驗 (oral glucose tolerance test,OGTT),飲葡萄糖75 g/250~300 mL水,葡萄糖氧化酶法測定空腹和餐后2 h血漿葡萄糖。
1.3 診斷標準與評估方法
1.3.1 OSAHS診斷標準 診斷標準參考中華醫學會呼吸病學分會睡眠呼吸障礙學組2011年修訂的阻塞性睡眠呼吸暫停通氣綜合征診斷指南[2]:根據睡眠過程中經由呼吸道氣流較基線水平的下降幅度,可將其分為呼吸睡眠暫停和低通氣。前者的下降幅度≥90%;后者的下降幅度≥30%,伴SaO2下降≥4%或下降幅度≥50%,伴SaO2下降≥3%;兩者持續時間均在10 s或以上。OSAHS是指呼吸暫停或低通氣的發生頻率超過30次/7 h;或AHI,即睡眠過程中暫停通氣或低通氣指數≥5次/h。其中,AHI在5~30次/h的患者為輕中度 OSAHS組;AHI>30次/h,為重度組。
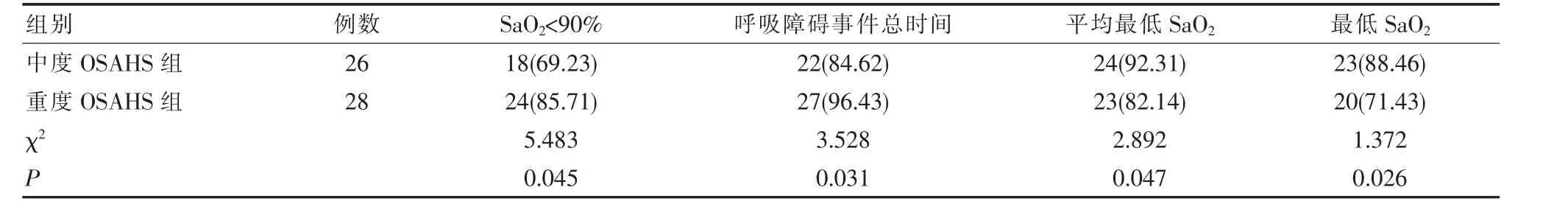
表1 中度OSAHS組與重度OSAHS組患者睡眠呼吸監測指標比較[n(%)]
1.3.2 糖尿病診斷標準 根據1999年世界衛生組織糖尿病診斷標準[3]:患者伴有多飲、多尿、多食和無法解釋的體重下降,具體指標滿足空腹血糖≥7.0 mmol/L或隨機血糖≥11.1 mmol/L或OGTT2 h血糖≥11.1 mmol/L中的一項或幾項,或既往存在糖尿病史。
1.4 統計方法
該次實驗的所有數據經SPSS 17.0統計學軟件處理,計量資料呈正態分布時用(均數±標準差)表示,呈非正態分布時用中位數和四分位數間距表示,計數資料用構成比表示。計量資料呈正態分布時兩組間比較采用雙側t檢驗;呈非正態分布時采用Mann-Whitney U檢驗。計量資料呈正態分布、方差齊性時多組間比較采用方差分析,多組間構成比比較采用χ2檢驗。連續型變量與多自變量間線性相關分析采用多元逐步回歸。P<0.05為差異有統計學意義
2 結果
2.1 患者一般情況及多導睡眠檢測結果在各組間比較
結果顯示,3組研究人群中,年齡與患者OSAHS的嚴重程度呈正相關,同時隨著OSAHS的進展,患者糖尿病和高血壓的發病率逐漸增加,差異有統計學意義(P<0.05)。
2.2 3組研究對象間GGT水平比較
非OSAHS組、中度OSAHS組、重度OSAHS組患者的GGT 分 別 為 17.00 (15.00,20.76)、30.00(22.00,40.00)、38(27.00,76.50),3 組比較差異有統計學意義(P<0.01)。
2.3 中度OSAHS組與重度OSAHS組患者睡眠呼吸監測指標比較
重度OSAHS組患者的AHI、SaO2<90%百分比、呼吸障礙事件事件百分比明顯大于中度OSAHS組,平均最低SaO2與最低SaO2均小于中度OSAHS組,兩組對比差異有統計學意義(P<0.05),中度 OSAHS組 AHI值為(39.15±19.74)次/h,重度 OSAHS 組的 AHI為(47.30±18.46)次/h,兩組比較,差異有統計學意義(t=4.276,P<0.05),見表 1。
2.4 血清γ-GT水平影響因素的多元逐步回歸分析
針對患者血清γ-GT水平影響因素的多元逐步回歸分析,結果顯示,血清γ-GT水平與ODI和HbA1c的水平呈正相關,差異有統計學意義(P<0.05),詳情見表2。

表2 血清γ-GT水平影響因素的多元逐步回歸分析
2.5 亞組分析
根據患者是否合并糖尿病分組的結果顯示,合并糖尿病的OSAHS患者血清中γ-GT含量明顯高于單純患有OSAHS組患者;而高γ-GT組患者患糖尿病的計量表明顯高于低γ-GT組患者,差異有統計學意義,見表3。
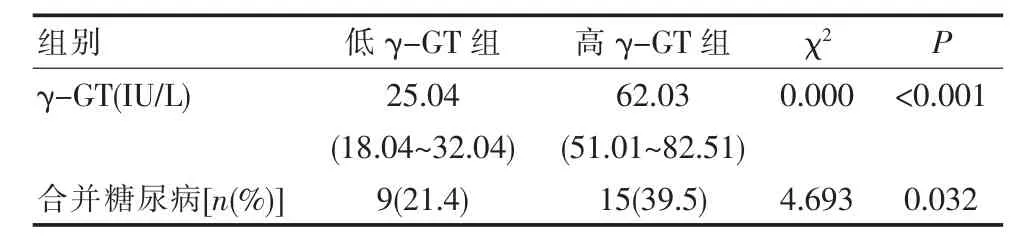
表3 亞組分析
2.6 OSAHS合并糖尿病危險因素的logstic回歸分析
將是否合并糖尿病作為因變量,患者年齡、性別、BMI、AHI、Ts90%、γ-GT 及血壓作為自變量進行分析,結果表明,患者血清γ-GT可作為合并糖尿病的OSAHS評估的獨立危險因素,見表4。
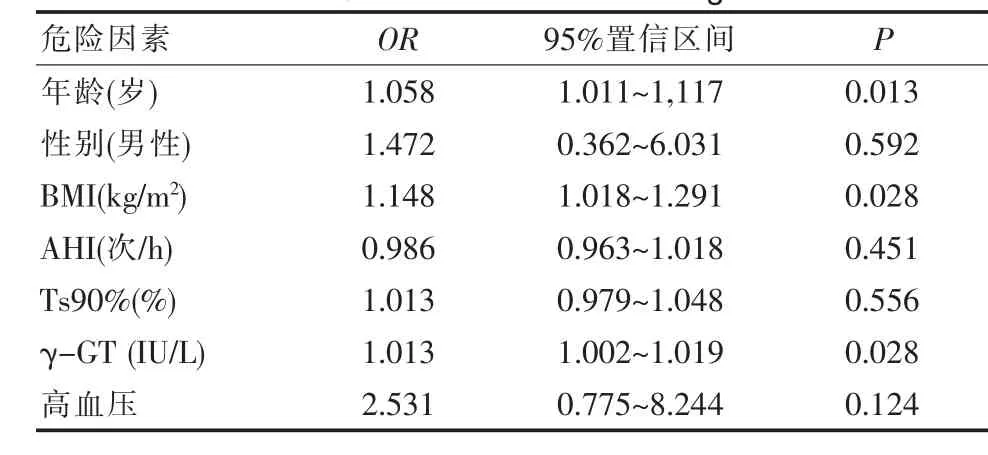
表4 OSAHS合并糖尿病危險因素的logstic回歸分析
3 討論
OSAHS作為一種睡眠呼吸障礙性疾病,臨床上常伴有睡眠過程中的睡眠暫停和通氣量降低的相關表現[4]。由于上述表現,患者常出現低氧或高碳酸血癥的風險,同時相關睡眠結構發生一定的改變,對多個臟器的結構和功能造成破壞。同時夜間伴隨著低氧發生頻率的增加,會產生大量的活性自由基,這也是造成相關并發癥的主要因素。γ-GT是一種參與催化γ-谷氨酰基轉換的酶,相關研究發現,γ-GT參與細胞的抗氧化,同時也與活性氧的生成存在一定的相關性,可作為觀察指標評價系統及其器官的氧化應激水平[5]。
該次實驗中,發現OSAHS患者血清中的γ-GT水平與疾病的嚴重程度呈正相關,同時在排除年齡、性別和BMI 3項相關因素的影響后,γ-GT水平與夜間低氧評價指標ODI呈正相關,這在一定程度上表明血清γ-GT的水平與患者夜間低氧水平密切相關。兩組患者血清GGT水平與AHI、呼吸障礙事件總時間百分比正相關 (r=0.215、0.387,P=0.021及<0.001),與最低SaO2及平均最低SaO2負相關 (r=-0.371、-0.207,P=<0.025及0.001),未發現其與SaO2<90%百分比相關(r=-0.119,P=0.132)。另外,部分學者指出,對患者進行期一年的持續氣道正壓通氣(continuous positive airway pressure,CPAP)治療后可明顯降低血清中γ-GT水平,這在一定程度上表明血清γ-GT水平對于評估OSAHS患者病情的嚴重程度具有積極的意義[6]。同時相關學者指出,OSAHS患者血清GTT平均水平提高了39.0%,在長期正壓通氣治療后,OSAHS患者抗氧化能力表現為一定程度的提高,血清中的GGT水平明顯降低。該次實驗中,非OSAHS組、中度OSAHS組、重度OSAHS組患者的 GGT分別為 17.00(15.00,20.76)、30.00(22.00,40.00)、38(27.00,76.50),3組比較差異有統計學意義,且重度OSAHS組患者的AHI、SaO2<90%百分比、呼吸障礙事件事件百分比明顯大于中度OSAHS組,平均最低SaO2與最低SaO2均小于中度OSAHS組,兩組對比差異有統計學意義(P<0.05),再次驗證了之前的研究成果。
趙彩霞[7]通過對健康人員、2型糖尿病患者以及OSAHS合并2型糖尿病患者血清中TNF-α、IL-6和3-NT水平進行研究發現,合并組患者TNF-α、IL-6、3-NT分別為(2.85±0.49)ng/mL、(15.77±1.26)ng/L 和(409.6±3.3)nmol/L,均高于 非 合 并 組 的 [(2.27±0.57)ng/mL、(8.67±0.95)ng/L、(234.8±2.9)nmol/L]和對照組的[(1.64±0.43)ng/mL、(1.58±0.33)ng/L、(188.5±1.7)nmol/L], 且非合并組高于對照組(P<0.5);Pearson 相關分析顯示,TNF-α、IL-6 和 3-NT 均與睡眠呼吸紊亂指數 (AHI)和TST90呈正相關,而與HOMA-IR和最低脈搏血氧飽和度(LSpO2)呈負相關,且TNF-α和3-NT均與Hb A1c呈正相關;回歸分析顯示,HOMA-IR、AHI、LSpO2和 TST90 是影響血清 TNF-α 和 3-NT水平的危險因素,AHI、LSpO2和 TST90是影響血清IL-6水平的危險因素,可見OSAHS患者的血清水平可以與預測其是否存在合并糖尿病的可能性[7]。該次實驗的創新之處在于針對血清γ-GT的變化情況來預測OSAHS患者合并糖尿病的可能性。多元逐步回歸分析的結果發現,排除ODI之外,血清γ-GT可作為獨立因素與HbA1c呈正相關,這在一定程度上指出了OSAHS與體內的糖代謝共同影響血清γ-GT的水平。另外,該研究將發現合并糖尿病的OSAHS患者血清中γ-GT的含量明顯高于OSAHS組患者。在對血清γ-GT作為變量將患者劃分為高γ-GT組和低γ-GT組的研究過程中比較兩組患者的糖尿病發病率,結果顯示患者血清γ-GT含量的高低與患者糖尿病的患病率呈現一定的相關性[8]。最后,該研究針對合并糖尿病的OSAHS患者的相關危險因素進行回歸分析,結果發現,排除相關因素后,血清γ-GT仍然是OSAHS合并糖尿病患者的獨立危險因素[9-10]。
綜上所述,血清γ-GT水平與OSAHS的患病嚴重程度呈正相關,同時可作為獨立危險因素來預測OSAHS患者伴發糖尿病的可能性[10]。考慮到該次實驗選取的樣本量存在一定的局限性,可能對文章的部分結果造成影響,因此在對該文進行研究的同時,希望可以取其精華,并提出寶貴的意見。
(
)
[1]鄧先柱,劉濱,李悅.阻塞性睡眠呼吸暫停低通氣綜合征與高血壓的研究進展[J].心血管病學進展,2014,35(2):230.
[2]顧晨鵑,李敏,李慶云,等.阻塞性睡眠呼吸暫停低通氣綜合征患者血清 γ-谷氨酰基轉移酶的變化及其預測意義[J].中華結核和呼吸雜志,2016,39(8):592-597.
[3]張建勛,劉志強,萬和斌,等.缺血性腦卒中與阻塞性睡眠呼吸暫停綜合征的臨床相關性研究[J].現代診斷與治療,2015(20):4561-4563.
[4]呂秀云,崔麗英,成忠紅.阻塞性睡眠呼吸暫停低通氣綜合征患者與血栓前分子標記物的相關性研究[J].中華肺部疾病雜志:電子版,2014,7(2):179.
[5]余穎,任躍忠,何冬娟,等.2型糖尿病合并阻塞性睡眠呼吸暫停綜合征患者炎性因子變5.7化及其相關因素分析[J].實用預防醫學,2016,23(12):1482-1485.
[6]董凱峰,劉志明,呂欣,等.阻塞性睡眠呼吸暫停低通氣綜合征患者血液流變學觀察[J].山東醫藥,2013,53(40):45.
[7]趙彩霞.阻塞性睡眠呼吸暫停低通氣綜合征對2型糖尿病患者血清TNF-α、IL-6和 3-NT水平的影響及意義[J].中西醫結合心血管病電子雜志,2016,4(4):142-144.
[8]趙曉彬.慢性阻塞性肺疾病并急性呼吸衰竭患者血氣分析及血液流變學指標的臨床研[J].中國醫藥科學,2013,3(11):165.
[9]張福業,孟秋云,陳燕,等.阻塞性睡眠呼吸暫停低通氣綜合征患者氧化應激狀態與病情嚴重程度的相關性[J].社區醫學雜志,2014,12(2):14.
[10]郭建英.血液流變學水平與急性腦梗死患者神經功能缺損恢復程度的關系研究[J].中國醫藥導報,2013,10(1):65.