抗結核藥物性肝損傷大鼠肝組織TUG1、NEAT1、Gas5的表達觀察
田慎謙,王悅,牛琛,李玉紅,朱凌妍,任琦,鄭國穎,馮福民
(華北理工大學公共衛生學院,河北省煤礦衛生與安全重點實驗室, 河北唐山 063000)
?
抗結核藥物性肝損傷大鼠肝組織TUG1、NEAT1、Gas5的表達觀察
田慎謙,王悅,牛琛,李玉紅,朱凌妍,任琦,鄭國穎,馮福民
(華北理工大學公共衛生學院,河北省煤礦衛生與安全重點實驗室, 河北唐山 063000)
目的 觀察抗結核藥物性肝損傷(ADLI)大鼠肝組織長鏈非編碼RNA(lncRNA)TUG1、NEAT1、Gas5的表達變化。方法 56只SPF級SD大鼠隨機分為A、B、C、D、E、F組和對照組各8只,A、B、C、D、E、F組大鼠予異煙肼55 mg/kg灌胃,1 次/d,分別于給藥3、7、10、14、21、28 d時處死,對照組大鼠予等容積蒸餾水灌胃,于灌胃28 d處死。采用熒光定量PCR法檢測各組肝組織TUG1、NEAT1和Gas5,并檢測TUG1上游分子SP1及下游分子HOXB7、KLF2、Bcl-2、Caspase-3 mRNA。結果 各實驗組和對照組中NEAT1、Gas5比較,P均>0.05。A、B、C、D、F組TUG1相對表達量與對照組比較,P均<0.05。B、C組SP1 mRNA的相對表達量與對照組比較,P均<0.05;A、C、D組HOXB7 mRNA相對表達量與對照組比較,P均<0.05;E、F組KLF2 mRNA相對表達量與對照組比較,P均<0.05;C、D、E、F組Bcl-2 mRNA的相對表達量與對照組比較,P均<0.05;B、C、E組Caspase-3 mRNA的相對表達量與對照組比較,P均<0.05。結論 ADLI大鼠肝組織TUG1低表達,其可能通過調控HOXB7、KLF2、Bcl-2、Caspase-3 mRNA表達參與ADLI的發生、發展。
抗結核藥物性肝損傷;長鏈非編碼RNA;TUG1;NEAT1;Gas5
異煙肼是目前常用的一線抗結核藥物,但使用不當其易導致抗結核藥物性肝損傷(ADLI)[1],最終導致結核化療方案改變、中斷,患者出現肝衰竭等不良反應,嚴重影響結核的治療及患者預后。目前ADLI的具體發病機制尚不明確[2]。長鏈非編碼RNA(lncRNA)在基因印記、細胞周期調控、轉錄的抑制和激活等各種生物生理活動起重要作用[3]。研究[4]發現lncRNA中的 TUG1、NEAT1、Gas5在人、大鼠、小鼠肝組織中均可表達,且在肝癌的細胞增殖、細胞凋亡、侵襲、遷移中起重要作用。病毒性肝炎、藥物性肝損傷等肝臟疾病中往往也伴隨著異常的細胞凋亡和增殖,但TUG1、NEAT1、Gas5 與ADLI的關系尚不明確。2014年9月~2016年3月,我們觀察異煙肼導致的ADLI大鼠肝臟組織中TUG1、NEAT1和Gas5變化。現將結果報告如下。
1 材料與方法
1.1 實驗動物、試劑及儀器 56只SPF級SD大鼠[北京華阜康生物科技公司,動物許可證號:SCXK(京)2009-0004],8~9周齡,體質量258~365 g,雌雄各半。異煙肼(沈陽紅旗制藥有限公司,批號:1404022),TRIpure Reagent(北京百泰克生物技術有限公司,批號:0020141224),PrimeScriptTMRT Master Mix試劑盒(大連TaKaRa公司),SYBR?Premix Ex TaqTMⅡ試劑盒(大連TaKaRa公司),MDA、SOD試劑盒(南京建成生物工程研究所)。HITACHI 7600-020全自動生化分析儀(日本日立公司);Heraeus高速冷凍離心機(德國Thermo Scientific公司);C1000PCR擴增儀(美國BIO-RAD公司);熒光定量PCR儀(美國Applied Biosystems公司)。
1.2 大鼠分組及ADLI模型制備方法 56只大鼠隨機分為A、B、C、D、E、F組和對照組各8只,A、B、C、D、E、F組每天異煙肼55 mg/kg灌胃,1次/d,對照組予等容積蒸餾水灌胃,制作ADLI模型。A、B、C、D、E、F組分別于給藥第3、7、10、14、21、28天時處死大鼠,對照組于第28 天處死大鼠,取肝組織50~100 mg備用。
1.3 各組大鼠肝組織TUG1、NEAT1、Gas5檢測 采用熒光定量PCR法。取大鼠肝組織,常規TRIzol法提取總RNA,反轉錄和實時熒光定量PCR嚴格按照試劑盒說明書進行操作。以GAPDH為內參,用 2-ΔΔCt來表示各RNA的相對表達量。引物均由上海生工合成,其序列如下:TUG1上游引物5′-TACGTCCCGTGCCTCCTGAT-3′,下游引物5′-AGGGCTGTGCTGAATCTGGG-3′; NEAT1上游引物5′-ACTGCTTGACACCCCATGCC-3′,下游引物5′-CGGTGATGACCACGGCTACC-3′;Gas5上游引物5′-AGCCAGAAAATGGGATGGTGGA-3′,下游引物5′-TGTGGAGCTTGCCATGCCTT-3′; GAPDH上游引物5′-CAATGACCCCTTCATTGACC-3′,下游引物5′-GACAAGCTTCCCGTTCTCAG-3′。反轉錄反應條件:37 ℃15 min,85 ℃5 s,4 ℃1 min;定量PCR反應條件:95 ℃30 s,95 ℃5 s,60 ℃30 s,40個循環。
1.4 TUG1上游分子SP1及下游分子HOXB7、KLF2、Bcl-2、Caspase-3 的mRNA檢測 采用熒光定量PCR法檢測方法“1.3”中存在統計學差異的TUG1的上游分子SP1及其下游分子HOXB7、KLF2、Bcl-2、Caspase-3、p15、p16、p27和p57 mRNA表達,所有操作均同“1.3”。引物序列如下。SP1上游引物5′-TGCAGCAGAATTGAGTCACC-3′,下游引物5′-CACAACATACTGCCCACCAG-3′;HOXB7上游引物5′-CACTACAATCGCTACCTGACTCG-3′,下游引物5′-TTCCTCCTCTTCCTCCTCGT-3′;KLF2上游引物5′-TCGCACCTAAAGGCGCATC-3′,下游引物5′-TAGTGGCGGGTAAGCTCGTC-3′;Bcl-2上游引物5′-GGGATGCCTTTGTGGAACTAT-3′,下游引物5′-AGGTATGCACCCAGAGTGATG-3′;Caspase-3上游引物5′-GGTATTGAGACAGACAGTGG-3′,下游引物5′-CATGGGATCTGTTTCTTTGC-3′。反轉錄反應條件:37 ℃15 min,85 ℃5 s,4 ℃1 min;定量PCR反應條件:95 ℃30 s ,95 ℃5 s,60 ℃30 s,40個循環。用 2-ΔΔCt來表示各mRNA相對表達量。
1.5 統計學方法 采用SPSS17.0統計軟件。計量資料表示,組間比較采用單因素方差分析,相關性分析采用Pearson相關分析。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠肝組織TUG1、NEAT1及Gas5表達比較 各組大鼠肝組織TUG1、NEAT1及Gas5表達比較見表1。
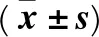
表1 各組大鼠肝組織TUG1、NEAT1和Gas5表達比較
2.2 各組大鼠肝組織SP1、HOXB7、KLF2、Bcl-2、Caspase-3 mRNA相對表達量 各組SP1、HOXB7、KLF2、Bcl-2、Caspase-3 mRNA相對表達量比較見表2。
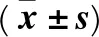
表2 各組大鼠肝組織SP1、HOXB7、KLF2、Bcl-2、Caspase-3 mRNA相對表達量比較
3 討論
異煙肼毒性代謝產物主要通過與肝細胞大分子物質共價結合[5]引起肝細胞壞死和脂肪變性導致ADLI,除此之外過氧化應激反應、人體乙酰化速率、以及藥物代謝酶等均與ADLI有關。最新研究發現表觀遺傳學在ADLI的發生、發展中起重要作用。
NEAT1、Gas5 和TUG1均具有重要的調控功能。Gas5可通過負調控microRNA-21的表達,促進肝癌細胞的侵襲和轉移[4],還可通過調控波形蛋白的表達促進細胞增殖[5]。NEAT1表達改變影響肝癌的發生和轉移,其高表達與MDTH、NM23和MALAT1有關[6]。TUG1能夠影響細胞增殖和凋亡,在很多疾病中都發揮著重要的調控功能,如肝癌[7]、胃癌[8]、肺癌[9]、骨肉瘤[10]、動脈粥樣硬化[11]以及低溫導致的肝細胞損傷[12]等。本研究中NEAT1、Gas5在對照組和各實驗組大鼠肝組織中的表達差異無統計學意義,說明二者在異煙肼所致的ADLI中作用較弱。而TUG1在ADLI大鼠中表達呈下降趨勢,表明TUG1在ADLI的發生和發展中起重要作用。為進一步探討TUG1在ADLI發生、發展中的作用機制,本研究對TUG1的上游分子SP1和下游分子HOXB7、KLF2、Caspase-3、Bcl-2 mRNA進行了檢測和分析。轉錄因子SP1是TUG1的上游分子,它可以通過TUG1啟動子區域的5個結合位點直接與TUG1結合,進而調控TUG1的轉錄[7]。本研究結果顯示,與對照組相比,實驗組SP1 mRNA與TUG1表達水平均呈下降趨勢,在下降至最低點后都略有回升,二者變化趨勢一致且SP1屬于TUG1上游分子,說明在異煙肼引發肝損傷過程中,SP1可能調控了TUG1的表達,其表達量降低進一步導致了TUG1表達下降。
許多lncRNA能夠將蛋白家族以多梳抑制復合物2(PRC2)招募到特定的基因位點[13],使該基因啟動子區發生改變,進而抑制其表達。TUG1也是其中一員,它可以通過與PRC2結合來調控其下游分子p15、p16、p27、p57、HOXB7和KLF2基因的表達,從而影響細胞的增殖和凋亡[7,9,14,15]。
HOXB7參與調控多種信號通路,在癌細胞的增殖、分化、侵襲、遷移、黏附等活動中都扮演著重要的角色[16]。本研究中,隨ADLI時間延長,HOXB7 mRNA的相對表達量先升高后降低,而TUG1的相對表達量在給藥第10天降至最低,給藥第14天有所回升。雖然HOXB7 mRNA變化趨勢與lncRNA TUG1相反,但HOXB7 mRNA發生變化的轉折點早于TUG1,這說明HOXB7可能只是部分受TUG1的調控。
KLF2為鋅指Kruppel樣轉錄因子家族中的一員,肝癌細胞中過表達KLF2可導致G0/G1期阻滯[8],誘導細胞凋亡[17]。此外,KLF2還可調控c-Myc基因的表達[18],c-Myc廣泛參與細胞的增殖、凋亡、細胞周期等進程[19]。由此可見,KLF2在細胞的增殖和凋亡過程中同樣發揮著重要的作用。KLF2 mRNA的表達總體呈上升趨勢,給藥第21天升高,與TUG1總體變化趨勢相反,但其改變滯后于TUG1,提示TUG1可能通過抑制KLF2的表達調控ADLI的發生、發展。研究[15]發現,在小鼠胰島瘤細胞中干擾TUG1表達,細胞凋亡蛋白Caspase-3表達升高,而抗凋亡因子Bcl-2表達降低,細胞凋亡率升高。本研究結果顯示,各實驗組大鼠肝細胞Bcl-2表達下降,與TUG1變化一致,而Caspase-3表達逐漸升高,表明TUG1與肝細胞凋亡有關。但TUG1究竟如何影響Caspase-3和Bcl-2基因的表達還有待進一步研究。
綜上所述,ADLI大鼠肝組織TUG1低表達,其可能通過調控HOXB7、KLF2、Bcl-2、Caspase-3 mRNA表達參與ADLI的發生、發展,但其具體作用機制尚有待于進一步研究。
[1] Schaberg T, Rebhan K, Lode H. Risk factors for side-effects of isoniazid, rifampin and pyrazinomide in patients hospitalized for pulmonary tuberculosis[J]. Eur Respir J, 1996,75(9):2026-2030.
[2] Miyazawa S, Matsuoka S, Hamana S, et al. Isoniazid-induced acute liver failure during preventive therapy for latent tuberculosis infection[J].Intern Med, 2015,54(6):591-595.
[3] Villegas VE, Zaphiropoulos PG. Neighboring gene regulation by antisense long non-coding RNAs[J]. Int J Mol Sci, 2015,16(2):3251-3266.
[4] Hu L, Ye H, Huang G, et al. Long noncoding RNA GAS5 suppresses the migration and invasion of hepatocellular carcinoma cells via miR-21[J].Tumour Biol, 2016,37(2):2691-2702.
[5] Chang L, Li C, Lan T, et al. Decreased expression of long non-coding RNA GAS5 indicates a poor prognosis and promotes cell proliferation and invasion in hepatocellular carcinoma by regulating vimentin[J]. Mol Med Rep, 2016,13(2):1541-1550.
[6] Guo S, Chen W, Luo Y, et al. Clinical implication of long non-coding RNA NEAT1 expression in hepatocellular carcinoma patients[J]. Int J Clin Exp Pathol, 2015,8(5):5395-5402.
[7] Huang MD, Chen WM, Qi FZ, et al. Long non-coding RNA TUG1 is up-regulated in hepatocellular carcinoma and promotes cell growth and apoptosis by epigenetically silencing of KLF2[J]. Molecular Cancer, 2015,14:165.
[8] Ji TT, Huang X, Jin J, et al. Inhibition of long non-coding RNA TUG1 on gastric cancer cell transference and invasion through regulating and controlling the expression of miR-144/c-Met axis[J]. Asian Pac J Trop Med, 2016,9(5):508-512.
[9] Zhang EB, Yin DD, Sun M, et al. p53-regulated long non-coding RNA TUG1 affects cell proliferation in human non-small cell lung cancer, partly through epigenetically regulating HOXB7 expression[J]. Cell Death Dis, 2014,5(5):1243.
[10] Ma B, Li M, Zhang L, et al. Upregulation of long non-coding RNA TUG1 correlates with poor prognosis and disease status in osteosarcoma[J]. Tumour Biol, 2016,37(4):4445-4455.
[11] Chen C, Cheng G, Yang X, et al. Tanshinol suppresses endothelial cells apoptosis in mice with atherosclerosis via lncRNA TUG1 up-regulating the expression of miR-26a[J]. Am J Transl Res, 2016,8(7):2981-2991.
[12] Su S, Liu J, He K, et al. Overexpression of the long noncoding RNA TUG1 protects against cold-induced injury of mouse livers by inhibiting apoptosis and inflammation[J]. FEBS J, 2016,283(7):1261-1274.
[13] Zhao J, Sun BK, Erwin JA, et al.Polycomb proteins targeted by a short repeat RNA to the mouse X chromosome[J]. Science, 2008,322(5902):750-756.
[14] Zhang E, He X, Yin D. Increased expression of long noncoding RNA TUG1 predicts a poor prognosis of gastric cancer and regulates cell proliferation by epigenetically silencing of p57[J]. Cell Death Dis, 2016,7(2):2109.
[15] Yin DD, Zhang EB, Liang H, et al. Downregulation of lncRNA TUG1 Affects Apoptosis and Insulin Secretion in Mouse Pancreatic β Cells[J].Cell Physiol Biochem, 2015,35(5):1892-1904.
[16] 賀松其,姚飛龍,呂志平,等.Wnt/β-catenin信號通路在肝癌轉移侵襲中的調控機制[J].中國實驗方劑學雜志,2011,16(7):35-37.
[17] Huang MD, Chen WM, Qi FZ, et al. Long non-coding RNA ANRIL is upregulated in hepatocellular carcinoma and regulates cell apoptosis by epigenetic silencing of KLF2[J].J Hematol Oncol, 2015,8(1):50.
[18] Zou K, Lu X, Ye K, et al. Kruppel-like factor 2 promotes cell proliferation in hepatocellular carcinoma through up-regulation of c-myc[J]. Cancer Biol Ther, 2016,17(1):20-26.
[19] 白陽, 葉健,王敬澤.c-Myc功能及其下游靶點[J].細胞生物學雜志,2007,37(29):191-196.
唐山市重點實驗室基金資助項目(08150201A-1-8)。
馮福民(E-mail: fm_feng@sina.com)
10.3969/j.issn.1002-266X.2016.39.009
R575
A
1002-266X(2016)39-0030-03
2016-05-25)

