缺血再灌注對大鼠心肌H9c2細(xì)胞活性、凋亡的影響及其機(jī)制
楊瑩瑩,孫曉鷗,譚文,2
(1 華南理工大學(xué)生物科學(xué)與工程學(xué)院,廣州510006;2 廣東工業(yè)大學(xué)生物醫(yī)藥研究院)
?
缺血再灌注對大鼠心肌H9c2細(xì)胞活性、凋亡的影響及其機(jī)制
楊瑩瑩1,孫曉鷗1,譚文1,2
(1 華南理工大學(xué)生物科學(xué)與工程學(xué)院,廣州510006;2 廣東工業(yè)大學(xué)生物醫(yī)藥研究院)
目的 觀察缺血再灌注對大鼠H9c2心肌細(xì)胞活性、凋亡的影響,并探討其作用機(jī)制。方法 H9c2細(xì)胞分為A、B組,1×104/孔接種于96孔板,每組6個(gè)復(fù)孔。細(xì)胞貼壁生長24 h時(shí)B組吸棄原培養(yǎng)基,加入人工缺氧液100 μL,置于含94% N2、1% O2、5% CO2的三氣培養(yǎng)箱中培養(yǎng)90 min;吸棄缺氧液,加入DMEM高糖培養(yǎng)基,置于正常培養(yǎng)箱中培養(yǎng)90 min備用。A組僅加入DMEM高糖培養(yǎng)基,置于正常培養(yǎng)箱中培養(yǎng)90 min備用。采用MTT法檢測細(xì)胞活性,TUNEL法檢測凋亡細(xì)胞,采用激光共聚焦顯微鏡觀察并計(jì)算兩組細(xì)胞活性氧簇(ROS)含量及線粒體膜電位(MMP),采用Western blotting法檢測心肌細(xì)胞熱休克蛋白60(HSP60)、過氧化物氧化還原酶(Prx)、硫氧還原蛋白(Trx)、線粒體分裂蛋白(Fis1)。結(jié)果 A、B組心肌細(xì)胞活性分別為0.77±0.01、0.40±0.02,二者比較,P<0.05。A、B組心肌細(xì)胞凋亡率分別為2.24%±0.12%、41.78%±1.43%,二者比較,P<0.05。A組細(xì)胞ROS含量及MMP分別為0.58%±0.02%、1.12%±0.05%,B組分別為1.13%±0.05%、0.76%±0.01%,組間比較,P均<0.05。與B組相比,A組心肌細(xì)胞HSP60、Fis1蛋白表達(dá)升高,Prx2、Trx1蛋白表達(dá)降低,P均<0.05。結(jié)論 缺血再灌注后H9c2細(xì)胞出現(xiàn)細(xì)胞活性下降、細(xì)胞凋亡,其機(jī)制可能與缺血再灌注促進(jìn)細(xì)胞HSP60、Fis1蛋白表達(dá),抑制Prx2、Trx1蛋白表達(dá)有關(guān)。
缺血再灌注;H9c2心肌細(xì)胞;細(xì)胞活性;細(xì)胞凋亡;活性氧簇;線粒體膜電位;熱休克蛋白60;過氧化物氧化還原酶;硫氧還原蛋白;線粒體分裂蛋白
心肌梗死是目前病死率、致殘率最高的疾病之一[1],早期進(jìn)行溶栓或應(yīng)用經(jīng)皮冠狀動脈介入治療是其有效治療方法。治療過程中心肌組織恢復(fù)血流的同時(shí)可加重心肌組織不可逆損傷程度,這種現(xiàn)象被稱為心肌缺血再灌注[2,3]。探討心肌缺血再灌注時(shí)的損傷機(jī)制對心肌梗死的治療有重要價(jià)值。活性氧簇(ROS)主要包括一些氧自由基及其衍生物,可導(dǎo)致細(xì)胞的急慢性損傷及凋亡[4]。熱休克蛋白60(HSP60)是一種應(yīng)激蛋白,其在心血管疾病的發(fā)生發(fā)展中起重要作用[5]。過氧化物氧化還原酶(Prx)及硫氧還原蛋白(Trx)是一類抗氧化蛋白。線粒體是細(xì)胞供能代謝中心,同時(shí)也是細(xì)胞內(nèi)ROS的主要來源[6]。分裂蛋白(Fis1)是調(diào)控線粒體分裂的主要蛋白,線粒體膜電位(MMP)是常用的線粒體檢測指標(biāo)。本研究觀察了缺血再灌注對H9c2心肌細(xì)胞活性、凋亡的影響,并探討其機(jī)制。
1 材料與方法
1.1 細(xì)胞、試劑及儀器 H9c2心肌細(xì)胞系購自中科院上海細(xì)胞庫,于含10% FBS、1%雙抗的高糖培養(yǎng)基,5 % CO2、37 ℃恒溫恒濕培養(yǎng)箱中培養(yǎng)。待細(xì)胞融合至80%~90%可進(jìn)行傳代,備用。按文獻(xiàn)[7]方法配制人工缺氧液,成分如下:137 mmol/L NaCl、15.8 mmol/L的KCl、0.49 mmol/L的MgCl2、0.9 mmol/L的CaCl2、4.0 mmol/L的HEPES、10 mmol/L的2-脫氧葡萄糖(抑制糖酵解)、20 mmol/L的乳酸鈉(模擬乳酸積累)、1 mmol/L的連二亞硫酸鈉(氧清除劑),pH 6.5(模擬酸中毒)。MTT購自美國Sigma公司;Jc-1、DCF-DA、DAPI購自美國Life technology公司,TUNEL細(xì)胞凋亡檢測試劑盒購自南京凱基生物公司,HSP60、Trx1單克隆抗體購自美國CST公司,Prx2單克隆抗體購自美國Abcam公司,F(xiàn)is1單克隆抗體、β-actin、HRP標(biāo)記的二抗購自美國Santa Cruz公司, FITC標(biāo)記的羊抗兔熒光二抗購自美國Jackson Immuno Research公司,BCA蛋白定量試劑盒購自美國Thermo公司,ECL化學(xué)發(fā)光底物購自美國Thermo公司,PVDF膜購自美國Millipore公司。雙人超凈工作臺購自上海博迅實(shí)業(yè)有限公司,CO2培養(yǎng)箱購自美國NUAIRE公司,三氣培養(yǎng)箱購自美國Thermo公司,激光共聚焦顯微鏡購自德國Zeiss公司;多功能酶聯(lián)檢測儀購自美國PerkinElmer公司,蛋白電泳儀購自美國Bio-Rad公司。
1.2 H9c2細(xì)胞分組及缺血再灌注方法 取對數(shù)生長期的H9c2細(xì)胞,分為A、B組,1×104/孔接種于96孔板,每組6個(gè)復(fù)孔。細(xì)胞貼壁生長24 h時(shí)B組吸棄原培養(yǎng)基,PBS沖洗3次,加入人工缺氧液100 μL,置于含94% N2、1% O2、5% CO2的三氣培養(yǎng)箱中培養(yǎng)90 min;吸棄缺氧液,加入DMEM高糖培養(yǎng)基,置于正常培養(yǎng)箱中培養(yǎng)90 min備用。A組吸棄原培養(yǎng)基,加入DMEM高糖培養(yǎng)基,置于正常培養(yǎng)箱中培養(yǎng)90 min備用。倒置熒光顯微鏡下可見B組細(xì)胞出現(xiàn)明顯的萎縮,細(xì)胞核突出,細(xì)胞邊緣模糊,甚至死亡。
1.3 各組心肌細(xì)胞活性觀察 采用MTT法。H9c2心肌細(xì)胞于96孔板中復(fù)灌完成后開始進(jìn)行細(xì)胞活性的測定。5 mg/mL MTT儲備液用DMEM稀釋100倍后使其終濃度為0.05 mg/mL,吸出原復(fù)灌液,加入稀釋好的MTT溶液100 μL/孔(注意避光),于培養(yǎng)箱中繼續(xù)培養(yǎng)4 h,使其充分反應(yīng)。4 h后,終止培養(yǎng)并小心吸出各孔內(nèi)的上清液,每孔加入150 μL DMSO溶液,避光條件下在搖床上低速振蕩10 min使化合物充分溶解,然后用酶標(biāo)儀測定吸光度值,測定條件設(shè)置為490 nm、37 ℃。以吸光度值代表細(xì)胞活性,每組設(shè)置6個(gè)重復(fù)樣品孔,重復(fù)3次,取平均值。
1.4 各組細(xì)胞凋亡檢測 采用TUNEL法。當(dāng)細(xì)胞融合度達(dá)到90%左右,以5×104/孔接種于24孔板,每組3個(gè)復(fù)孔。缺血復(fù)灌完成后,吸掉培養(yǎng)基,PBS沖洗3次,每孔300 μL,4%多聚甲醛溶液室溫固定20 min;PBS沖洗3次,每孔加入1% Triton X-100溶液200 μL,室溫促滲透5 min;PBS沖洗3次,加入50 μL TdT酶反應(yīng)液,置于37 ℃恒溫箱中避光反應(yīng)60 min;PBS沖洗3次,50 μL Streptavidin-Fluorescein反應(yīng)液,置于37 ℃恒溫箱中避光反應(yīng)30 min;PBS沖洗3次,DAPI染色液復(fù)染細(xì)胞核7 min;PBS沖洗3次,90%甘油封片,采用熒光顯微鏡觀察各組細(xì)胞凋亡情況,每組細(xì)胞隨機(jī)選取6個(gè)不同區(qū)域進(jìn)行拍照,數(shù)據(jù)處理選用Image Pro Plus軟件,計(jì)算細(xì)胞凋亡率。細(xì)胞凋亡率用綠色熒光細(xì)胞核(TUNEL)占藍(lán)色熒光細(xì)胞核(DAPI)的百分比來表示。
1.5 各組細(xì)胞ROS及MMP檢測 采用激光共聚焦顯微鏡測算兩組細(xì)胞ROS和MMP。心肌細(xì)胞缺血復(fù)灌完成后取各組細(xì)胞,吸棄上清液,分別加入含1 μg/mL Jc-1和5 μmol/L DCF-DA染料的染色液,37 ℃孵育30 min,吸棄染色液,PBS沖洗3次,將細(xì)胞置于激光共聚焦顯微鏡下觀察。掃描參數(shù)為分辨率:1 024×1 024,放大倍數(shù)為100倍。每組細(xì)胞隨機(jī)選取6個(gè)視野,每次實(shí)驗(yàn)重復(fù)3次,采用激光共聚焦顯微鏡自帶分析軟件LSM710進(jìn)行數(shù)據(jù)分析,統(tǒng)計(jì)各通道的平均熒光強(qiáng)度,結(jié)果以與正常組的比值表示。
1.6 各組心肌細(xì)胞HSP60、Prx2、Trx1、Fis1蛋白檢測 采用Western blotting法。心肌細(xì)胞缺血復(fù)灌完成后,胰酶消化、離心,用RIPA蛋白裂解液提取細(xì)胞總蛋白,采用BCA試劑盒進(jìn)行蛋白定量。各組取30 μg總蛋白,12% SDS-PAGE電泳后轉(zhuǎn)移至PVDF膜上,5% BSA室溫封閉1 h,加入一抗HSP60、Prx2、Trx1、Fis1、GAPDH(1∶1 000),4 ℃孵育過夜,TBST洗3次,加入HRP標(biāo)記的二抗(1∶3 000)室溫孵育1 h,TBST洗3次,ECL進(jìn)行顯影,凝膠成像儀進(jìn)行掃描并分析條帶灰度值。GAPDH為內(nèi)參,每組樣品重復(fù)檢測3次。以目的條帶灰度值與GAPDH條帶灰度值的比值表示目的蛋白的相對表達(dá)量。
1.7 統(tǒng)計(jì)學(xué)方法 采用SPSS17.0統(tǒng)計(jì)軟件。計(jì)量資料采用表示,結(jié)果比較采用t檢驗(yàn)。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
A、B組心肌細(xì)胞活性分別為0.77±0.01、0.40±0.02,二者比較,P<0.05。A、B組心肌細(xì)胞凋亡率分別為2.24%±0.12%、41.78%±1.43%,二者比較,P<0.05。A組細(xì)胞ROS和MMP分別為58%±2%、112%±5%,B組分別為113%±5%、76%±1%,組間比較,P均<0.05。各組心肌細(xì)胞HSP、Prx2、Trx1、Fis1蛋白的相對表達(dá)量見表1。
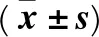
表1 兩組心肌細(xì)胞HSP、Prx2、Trx1、Fis1蛋白相對表達(dá)量比較
3 討論
以往研究[5]表明,心肌缺血復(fù)灌中細(xì)胞內(nèi)氧化應(yīng)激反應(yīng)來源于各種途徑,產(chǎn)生大量活性氧,其在線粒體內(nèi)的大量堆積是造成細(xì)胞凋亡的主要原因;細(xì)胞內(nèi)及線粒體內(nèi)鈣超載也發(fā)生于急性心肌缺血時(shí)期并在復(fù)灌初期急劇增加,導(dǎo)致mPTP的開放,線粒體膜電位下降[1]。目前臨床上尚無有效避免心肌缺血再灌注損傷的治療方法,因此對于復(fù)灌損傷氧化應(yīng)激相關(guān)分子機(jī)制的研究具有重要意義。本研究主要聯(lián)合應(yīng)用兩種缺氧方法,除維持細(xì)胞內(nèi)外電解質(zhì)平衡的離子外,另外添加2-脫氧葡萄糖來抑制糖酵解,并通過加入乳酸鈉來模擬體內(nèi)環(huán)境中“酸中毒”現(xiàn)象,此外聯(lián)合應(yīng)用連二亞硫酸鈉(Na2S2O4)來清除培養(yǎng)基中的氧氣,該條件下細(xì)胞增殖活性顯著下降,細(xì)胞凋亡率增加。在正常生理?xiàng)l件下,線粒體也會不斷產(chǎn)生ROS,線粒體電子傳遞鏈95%~98%的O2·反應(yīng)后都轉(zhuǎn)化為H2O而不產(chǎn)生任何的自由基中間體;而剩余的2%~5%的O2·則會通過其他途徑產(chǎn)生一些超氧化物和H2O2·。此時(shí)所產(chǎn)生的少部分ROS會通過自身的一系列抗氧化系統(tǒng)如谷胱甘肽還原酶(GSH)、硫氧還原蛋白還原酶(TrxR)、超氧化物歧化酶(SOD)及谷胱甘肽過氧化物酶(GPX)來清除;此外,一些抗氧化食物如維生素E、黃酮類、多酚類化合物也會清除一部分ROS。但是在心肌缺血時(shí)機(jī)體自我平衡系統(tǒng)被打破,復(fù)灌時(shí)會產(chǎn)生大量的ROS,此時(shí)mPTP開放引起線粒體功能的紊亂,通常主要表現(xiàn)為線粒體去極化、ATP合成受阻、細(xì)胞內(nèi)Ca2+釋放及呼吸抑制等;同時(shí)會引起線粒體基質(zhì)腫脹,釋放細(xì)胞色素C、核酸內(nèi)切酶G等一系列促凋亡蛋白,啟動Caspase-3級聯(lián)凋亡反應(yīng),進(jìn)一步加劇心肌缺血再灌注損傷[8]。
線粒體功能障礙被認(rèn)為是氧化應(yīng)激誘導(dǎo)的組織損傷的一個(gè)重要的因素。有文獻(xiàn)報(bào)道[9],HSP60是一種線粒體基質(zhì)應(yīng)激誘導(dǎo)蛋白,其對線粒體蛋白質(zhì)的折疊和功能具有很重要作用,且HSP60分布相當(dāng)廣泛,機(jī)體遭受應(yīng)激反應(yīng)后,其變化最為顯著,是主要的應(yīng)激蛋白。因此通過研究HSP60在心肌缺血再灌注時(shí)的變化趨勢可更清楚地了解心肌缺血再灌損傷機(jī)制。而影響線粒體功能的另一個(gè)因素便是由線粒體分裂相關(guān)蛋白介導(dǎo)的線粒體分裂,F(xiàn)is1作為線粒體外膜上Drp1的受體,主要參與Drp1的募集從而促進(jìn)線粒體的分裂,線粒體的分裂進(jìn)一步加重氧化應(yīng)激反應(yīng),有研究稱這是由于細(xì)長狀線粒體比點(diǎn)狀線粒體更能容納線粒體內(nèi)鈣超載和復(fù)灌時(shí)大量爆發(fā)的ROS[10]。Prx2是近幾年發(fā)現(xiàn)抗氧化酶家族中的一員,被發(fā)現(xiàn)在細(xì)胞內(nèi)具有抗過氧化和調(diào)節(jié)H2O2·的功能,介導(dǎo)信號轉(zhuǎn)導(dǎo)作用以及細(xì)胞內(nèi)抗ROS的防御作用[11]。Trx主要分為Trx1和Trx2兩種類型,Trx1主要位于細(xì)胞質(zhì)中,Trx2僅位于線粒體中,其中Trx1研究的最廣泛。有研究表明Trx1具有抗凋亡、抗氧化、抗腫瘤、抗炎、保護(hù)再灌注損傷和調(diào)節(jié)蛋白質(zhì)的亞硝基化等作用[12]。其抗氧化機(jī)制主要包括兩方面:①能直接或間接作為某些過氧化物酶的電子供體清除活性氧,從而減弱脂質(zhì)、DNA、蛋白質(zhì)等過氧化損傷。②作為細(xì)胞內(nèi)蛋白二硫鍵還原酶,它能還原多種蛋白質(zhì)(激酶、磷酸酶和轉(zhuǎn)錄因子)的二硫鍵,使其恢復(fù)生理功能,故其在抗氧化、維持細(xì)胞生理活性過程中具有重要作用[13]。
本研究發(fā)現(xiàn),心肌缺血復(fù)灌后HSP60蛋白表達(dá)水平顯著升高,這也可以作為心臟疾病中的重要標(biāo)志物;Fis1蛋白表達(dá)水平升高也提示線粒體發(fā)生分裂,線粒體動態(tài)網(wǎng)絡(luò)結(jié)構(gòu)被打破,從而加劇細(xì)胞損傷;Prx2和Trx1蛋白表達(dá)水平顯著下降,說明細(xì)胞自身抗氧化能力減弱,Prx2發(fā)揮抗氧化的功能跟Trx1之間有著緊密的聯(lián)系。有研究表明,在氧化應(yīng)激的情況下,過度消耗Prx2會減少Trx的激活和表達(dá),從而導(dǎo)致細(xì)胞凋亡信號調(diào)節(jié)激酶激活,即通過Trx-ASK1-JNK信號通路調(diào)節(jié)細(xì)胞的凋亡[14]。
綜上所述,總?cè)毖俟嘧⒑驢9c2心肌細(xì)胞出現(xiàn)細(xì)胞活性下降、細(xì)胞凋亡,其機(jī)制可能與缺血再灌注可促進(jìn)細(xì)胞HSP60、Fis1蛋白表達(dá),抑制Prx2、Trx1蛋白表達(dá)有關(guān)。
[1] Hausenloy DJ ,Yellon DM. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. J Clin Invest, 2013,123(1):92-100.
[2] de Groot H, Rauen U. Ischemia-reperfusion injury: processes in pathogenetic networks: a review[J]. Transplant Proc,2007,39 (2):481-484.
[3] Yellon DM, Hausenloy DJ. Myocardial reperfusion injury[J]. N Engl J Med,2007,357(11):1121-1135.
[4] Aon MA, Cortassa S, Marbán E, et al. Synchronized whole cell oscillations in mitochondrial metabolism triggered by a local release of reactive oxygen species in cardiac myocytes[J]. J Biol Chem, 2003,278(45):44735-44744.
[5] 涂啟敏, 陳智群. 熱休克蛋白60與心血管疾病關(guān)系的研究進(jìn)展[J].醫(yī)學(xué)綜述,2009,14(15):2100-2102.
[6] Gerald W, Dorn M. Mitochondrial dynamism and heart disease: changing shape and shaping change[J]. EMBO Mol Med, 2015,7(7):865-877.
[7] Markou T, Makridou Z, Galatou E, et al. Multiple signalling pathways underlie the protective effect of levosimendan in cardiac myocytes[J]. Eur J Pharmacol, 2011,667(1-3):298-305.
[8] Petronilli V, Penzo D, Scorrano L, et al. The mitochondrial permeability transition, release of cytochrome c and cell death. Correlation with the duration of pore openings in situ[J]. J Biol Chem, 2001,276(15):12030-12034.
[9] Lin KM, Lin B, Lian IY, et al. Combined and individual mitochondrial HSP60 and HSP10 expression in cardiac myocytes protects mitochondrial function and prevents apoptotic cell deaths induced by simulated ischemia-reoxygenation[J]. Circulation, 2001,103 (13):1787-1792.
[10] Chen H, Chomyn A, Chan DC. Disruption of fusion results in mitochondrial heterogeneity and dysfunction[J]. J Biol Chem, 2005,280(28):26185-26192.
[11] Boulos S, Meloni BP, Arthur PG, et al. Peroxiredoxin 2 overexpression protects cortical neuronal cultures from ischemic and oxidative injury but not glutamate excitotoxicity, whereas Cu/Zn superoxide dismutase 1 overexpression protects only against oxidative injury[J]. J Neurosci Res, 2007,85(14):3089-3097.
[12] Saitoh M, Nishitoh H, Fujii M, et al. Mammalian thioredoxin is a direct inhibitor of apoptosis signal-regulating kinase (ASK) [J]. EMBO J, 1999,117(9):2596-2606.
[13] Masutani H, Bai J, Kim YC, et al. Thioredoxin as a neurotrophic cofactor and an important regulator of neuroprotection[J]. Mol Neurobiol, 29(3):229-242.
[14] Kalinina EV, Chernov NN, Saprin AN. Involvement of thio-, peroxi-, and glutaredoxins in cellular redox-dependent processes[J]. Biochemistry (Mosc), 2008,73(13):1493-1510.
Influence of ischemia reperfusion on viability and apoptosis of H9c2 myocardial cells and its mechanism
YANGYingying1,SUNXiaoou,TANWen
(1SchoolofBioscienceandBioengineering,SouthChinaUniversityofTechnology,Guangzhou510006,China)
Objective To investigate the influence of ischemia reperfusion(IR) on cell viability and apoptosis of rat myocardial cells H9c2 as well as the potential molecular mechanism. Methods H9c2 cells were divided into groups A (control) and B (IR) and were seeded in 96-well plates by 1×104/well. After adhering for 24 h, the culture medium of group B was replaced by 100 μL hypoxia buffer and the cells were incubated in 94% N2, 1% O2, and 5% CO2for 90 min. Then we discarded the hypoxia buffer, and incubated them in normal environment with 100 μL/well DMEM of high glucose medium for another 90 min. The cell viability was detected by MTT, apoptosis by TUNEL, mitochondrial membrane potential (MMP) and reactive oxygen species (ROS) by laser scanning confocal microscope.Furthermore, heat shock protein 60 (HSP60), peroxiredoxin (Prx), thioredoxin (Trx) and mitochondria fission protein (Fis1) were detected by Western blotting. Results The cell viability of groups A and B was 0.77±0.01 and 0.40±0.02, respectively (P<0.05). The apoptosis rates in groups A and B were 2.24%±0.12% and 41.78%±1.43% (P<0.05). Intracellular ROS and mitochondrial membrane potential of group A was 0.58%±0.02% and 1.12%±0.05%, and was 1.13%±0.05% and 0.76%±0.01% in the group B (allP<0.05). Compared with group A, the expression levels of HSP60 and Fis1 were increased, and the levels of Prx2 and Trx1 were decreased (allP<0.05). Conclusion After ischemia reperfusion, the cell viability decreases and the apoptosis increases in H9c2 cells, and its mechanism may be that ischemia reperfusion promotes the expression of HSP60 and Fis1 protein and inhibits the expression of Prx2 and Trx1 protein.
ischemia reperfusion; H9c2 cardiomyocytes; cell viability; apoptosis; reactive oxygen species; mitochondrial membrane potential; heat shock protein 60; peroxiredoxin; thioredoxin; mitochondrial fission protein
華南理工大學(xué)自然科學(xué)基金資助項(xiàng)目(D2154630)。
楊瑩瑩(1990-),女,碩士研究生,主要研究方向?yàn)樾难芩幚怼-mail: yangyingxz@163.com
簡介: 孫曉鷗(1984-),女,博士,講師,主要研究方向?yàn)榧?xì)胞生物學(xué)。E-mail: bixosun@scut.edu.cn
譚文(1958-),男,博士,教授,主要研究方向?yàn)獒t(yī)藥生物學(xué)。E-mail: went@scut.edu.cn
10.3969/j.issn.1002-266X.2016.39.005
R965
A
1002-266X(2016)39-0016-04
2016-05-26)

