基于α螺旋肽與多酚綴合的HIV-1融合抑制劑的設計、 合成及活性初篩
程思綺, 梁國棟, 姜喜鳳, 王 潮, 劉克良,
(1. 沈陽藥科大學制藥工程學院, 沈陽 110016;2. 軍事醫學科學院毒物藥物研究所, 北京 100850)
?
基于α螺旋肽與多酚綴合的HIV-1融合抑制劑的設計、 合成及活性初篩
程思綺1, 梁國棟2, 姜喜鳳2, 王 潮2, 劉克良1,2
(1. 沈陽藥科大學制藥工程學院, 沈陽 110016;2. 軍事醫學科學院毒物藥物研究所, 北京 100850)
將α螺旋多肽與羥基酪醇等多酚類化合物通過共價鍵綴合, 期望二者在發揮各自生物學作用的同時產生協同效應, 據此設計了HIV-1融合抑制多肽. 圓二色光譜表征結果表明, 所設計的綴合多肽呈典型的α螺旋結構特征, 且可以與靶標N36相互作用. HIV-1包膜糖蛋白(Env)介導的細胞-細胞融合活性測試結果表明, 這些具有α螺旋結構的綴合多肽可以在低微摩爾水平抑制病毒融合.
人免疫缺陷病毒Ⅰ型; 融合抑制劑;α螺旋肽; 多酚
人免疫缺陷病毒Ⅰ型(Human Immunodificiency virus type 1, HIV-1)侵染宿主細胞的過程由病毒包膜糖蛋白(Envelope glycoproteins, Env)介導. 包膜糖蛋白跨膜亞基gp41中N末端重復序列(N-heptad repeat, NHR)和C末端重復序列(C-heptad repeat, CHR)可發生相互作用, 形成六股α螺旋束(Six helix bundle, 6HB), 這是病毒膜和細胞膜融合的關鍵步驟[1,2]. 在6HB的形成過程中, 3股NHR首先形成三聚體內核(N-trimer), 3股CHR再以反向平行的方式結合到N-trimer形成的疏水性溝槽中[3]. 一些衍生于病毒CHR區域的多肽可以與靶標N-trimer作用, 干預內源性6HB的生成, 從而阻斷膜融合過程, 抑制病毒進入宿主細胞[4,5]. 這類CHR區域衍生多肽稱為C肽類HIV-1融合抑制劑[6~9]. 其中, T20(商品名Fuzeon, 通用名Enfuvirtide)是衍生于HIV-1 gp41 CHR的36肽, 已于2003年由美國食品藥品管理局(FDA)批準上市[10].
由C34/N36所形成6HB的晶體結構可知, 6HB本質為α螺旋間彼此相互作用形成的卷曲螺旋(Coiled coil)結構[11]. 在該超螺旋結構中, 每隔7個氨基酸殘基, 單股α螺旋正好轉過2圈, 其位置結構可表示為(abcdefg)n. 各位置上的殘基分布具有如下規律: (1) a, d位通常為以亮氨酸(Leu)為代表的疏水性殘基, 而e, g位通常為極性殘基; (2) NHR首先依靠a, d位殘基的疏水相互作用形成N-trimer, 進一步通過其表面的e, g位殘基與CHR中的a, d位殘基相互作用形成6HB[如圖1(A)和(B)所示]. 6HB晶體結構分析結果表明, C肽的活性構象為亮氨酸拉鏈樣的α螺旋. 適度提高天然C肽的α螺旋含量, 可有效提高藥物的抗病毒活性[12,13]. 前文[14]曾從頭設計了一種具有重復拷貝的4-3七殘基序列5HR, 即(AEELAKK)5. 生物物理學及生物學活性評價表明, 5HR在溶液中可形成穩定的α螺旋結構, 且具有一定的HIV-1融合抑制活性. Shi等[15]以5HR為先導結構, 在其N端引入衍生于HIV-1 CHR的寡肽序列PBD(aa: 628~634, WMEWDRE), 同時對螺旋a, d位殘基進行定點突變, 得到了螺旋多肽PBD-m4HR(WMEWEDRE IEELIKK SEELIKK IEEQIKK QEESIKK). 該序列活性與天然C肽相當, 且能與靶標NHR形成穩定的6HB. 由5HR及PBD-m4HR的發現可見, 在6HB形成過程中非特異性的疏水作用和靜電作用的貢獻很大, 殘基一一對應的特異性結合序列有可能被形成α螺旋的多肽序列所替代.
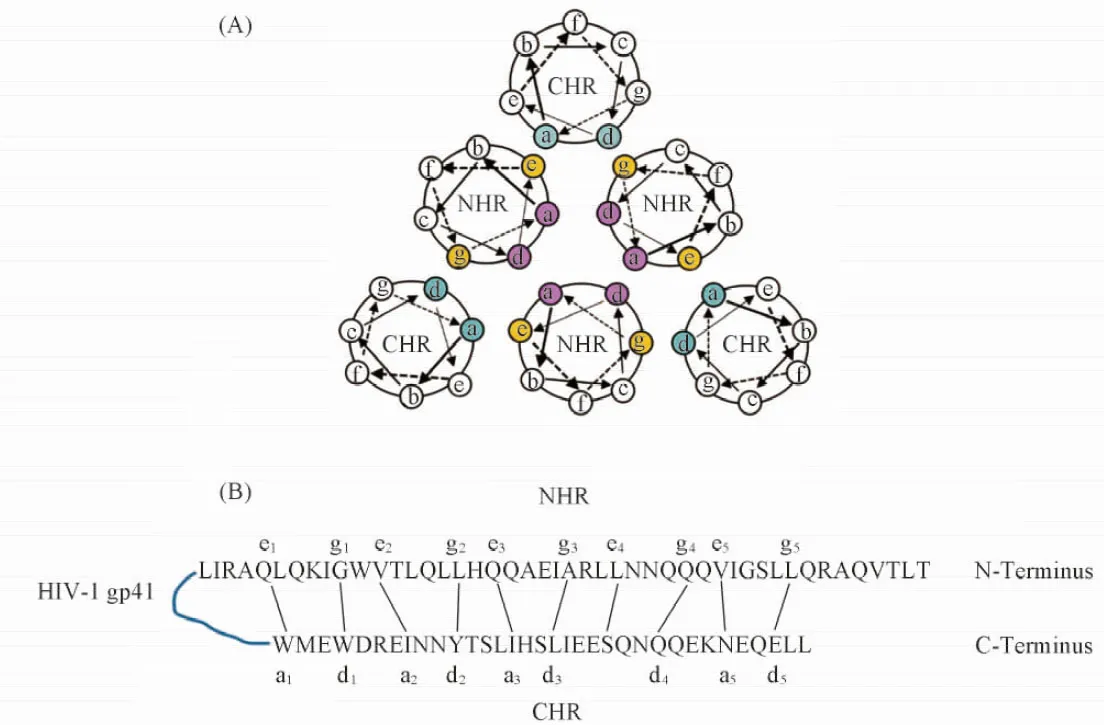
Fig.1 Ineraction between NHR and CHR of HIV gp41
多酚是一類重要的天然產物, 具有抗病毒、 抗腫瘤及抗炎等多種生物學活性[16~19]. 多酚的抗病毒活性具有廣譜性, 如表沒食子兒茶素沒食子酸酯(Epigallocatechin gallate, EGCG)能夠同時阻止HIV-1和流感病毒進入宿主細胞[20]. 此外, 多酚亦可作用于某一病毒生命周期的多個環節, 如在阻止HIV-1侵染宿主細胞的過程中, 多酚不僅能夠通過與逆轉錄酶及多種蛋白酶結合抑制病毒復制過程, 還能作用于病毒的進入階段[21,22]. 上述多酚與靶標之間的非特異性結合特點導致其與靶標的作用力不強、 生物活性不高. 前期研究[23]表明, 從橄欖葉中提取的羥基酪醇(HT)和橄欖苦苷(Ole)能夠阻斷HIV-1與宿主細胞的融合過程, 發揮抗病毒活性. HT的HIV-1融合抑制機制主要是與gp41中的N-trimer結合, 從而抑制內源性6HB的生成.
本文基于6HB的超螺旋結構特征, 將用于靶向病毒NHR的α螺旋多肽與具有非特異性抗病毒作用的多酚類化合物綴合. 在所設計的綴合物中,α螺旋肽具有NHR靶向性, 可以將多酚有效帶至靶標部位, 從而最大程度地釋放出多酚的抗病毒融合活性; 同時, 多酚的存在也勢必會影響α螺旋肽的高級結構與理化性質. 活性多酚和α螺旋肽在結構和功能上互相影響、 互為補充, 可能會取得1+1>2的協同效應, 得到具有HIV-1融合抑制活性的新穎結構. 我們從PBD-m4HR中截取了m4HR部分[24], 并通過不同長度和柔性的連接臂將其與HT衍生物mHT或其它具有類似結構的多酚綴合, 以考察α螺旋肽與多酚的協同作用.
1 實驗部分
1.1 試劑與儀器
Rink-amide樹脂(載量0.44 mmol/g)購于天津南開和成科技有限公司; 三氟乙酸(TFA)購于北京博邁杰科技有限公司; 1,2-乙二硫醇(EDT)、 苯甲醚(Anisole)和間甲酚(m-Cresol)均購于百靈威科技有限公司.
各種保護氨基酸:N-芴甲氧羰基-β-丙氨酸(Fmoc-βAla-OH)、N-芴甲氧羰基-N′-三苯甲基-L-谷氨酰胺[Fmoc-L-Gln(Trt)-OH]、N-芴甲氧羰基-O-叔丁基-L-谷氨酸[Fmoc-L-Glu(OtBu)-OH]、N-芴甲氧羰基-L-異亮氨酸(Fmoc-L-Ile-OH)、N-芴甲氧羰基-L-亮氨酸(Fmoc-L-Leu-OH)、N-α-芴甲氧羰基-N′-叔丁氧羰基-L-賴氨酸[Fmoc-L-Lys(Boc)-OH]、N-芴甲氧羰基-O-叔丁基-L-絲氨酸[Fmoc-L-Ser(t-Bu)-OH]及N-芴甲氧羰基-6-氨基己酸(Fmoc-6-aminocaproic acid)均購自上海吉爾生化有限公司;N-芴甲氧羰基-8-氨基-3,6-二氧雜辛酸(Fmoc-8-amino-3,6-dioxaoctanoic acid)購自浙江嘉興博美生物有限公司; 原兒茶酸(Protocatechuic acid, PA)購自百靈威公司; 沒食子酸(Gallic acid, GA)購自國藥集團; 其它所用試劑均為分析純.
CS Bio Co.多肽合成儀(美國CS公司); Shimadzu LC-20AP型高壓制備液相色譜儀(日本島津株式會社); Phenomenex C8制備液相色譜柱(250 mm×21.20 mm, 美國Phenomenex公司); Shimadzu 10A型高效液相色譜儀(日本島津株式會社); Waters XBridge C8液相色譜柱(250 mm×4.6 mm, 5 μm, 美國Waters公司); Milli-Q 純水機(美國MilliPore公司); Free-Zone 18 L 型冷凍干燥機(美國Labconco公司); REFLEX Ⅲ型MALDI-TOF-MS質譜儀(德國Bruker公司).
1.2 化合物5的合成及表征

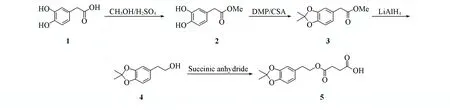
Scheme 1 Synthesis routes of compound 5
1.3 肽序列的合成
采用標準的芴甲氧羰基(Fmoc)固相合成策略, 在CS Bio Co.多肽合成儀上固相合成m4HR. 在m4HR基礎上, 同樣采取標準的Fmoc固相合成策略(以DIC為縮合劑), 手動連接上不同的連接臂β-丙氨酸(β-Alanine,βAla)、 6-氨基己酸(6-Aminocaproic acid, Aca)和8-氨基-3,6-二氧雜辛酸(8-Amino-3,6-dioxaoctanoic acid, PEG3), 再連接不同的多酚化合物, mHT, PA, GA多酚及綴合物結構如圖2所示. 各肽序列均經MALDI-TOF-MS 確證分子量, 利用C8制備型反相色譜柱分離純化, 得到純度>95%的純肽.
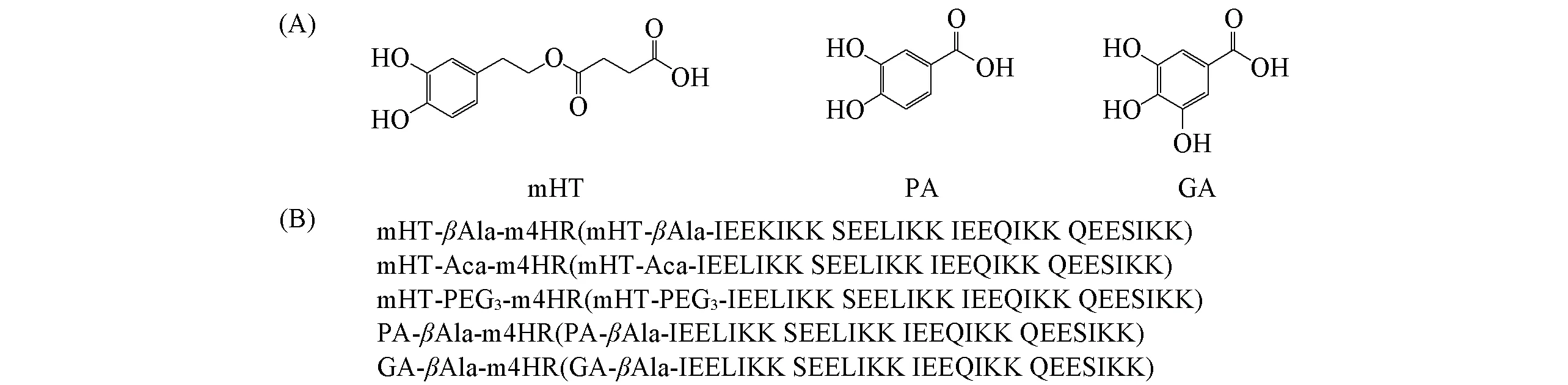
Fig.2 Structures of polyphenols and designed conjugates
1.4 綴合物與N36相互作用的圓二色光譜(CD)測定
配制mHT-βAla-m4HR的PBS(pH=7.4)溶液(10, 20 μmol/L)及N36的水溶液(10, 20 μmol/L). 將mHT-βAla-m4HR溶液(20 μmol/L)及N36溶液(20 μmol/L)各300 μL混合均勻, 在37 ℃下孵育30 min, 得混合溶液, 終濃度為10 μmol/L. 分別測定mHT-βAla-m4HR溶液, N36深液及混合溶液在10 μmol/L濃度水平的CD值.
1.5 HIV-1 Env介導的細胞-細胞融合活性測試
將稀釋后的樣品與含熒光素酶報告基因的TZM-b1細胞(50×104Cell/mL)及HL2/3細胞(100×104Cell/mL)共孵育24 h后, 裂解細胞, 檢測熒光素酶活性(Luciferase assay system). 對樣品劑量-融合抑制百分率曲線進行S形擬合(Origin 7.5軟件), 得到測試樣品的半抑制濃度(IC50)值.
2 結果與討論
2.1 綴合物與靶序列N36的相互作用
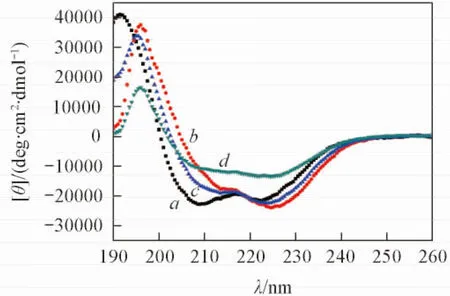
Fig.3 CD spectra of mHT-βAla-m4HR and its complex with gp41 NHR peptides
綴合物與靶序列N36相互作用的CD表征結果如圖3所示, 根據各肽序列在222 nm處的CD值, 利用公式:α螺旋度=CD值/33000計算出對應的α螺旋度. mHT-βAla-m4HR呈現典型的α螺旋結構特征, 其自身α螺旋度達到了68.7%. 此結果表明, 綴合物保持了α螺旋活性構象. 此外, mHT-βAla-m4HR與靶序列N36混合孵育后,α螺旋度實測值為40.4%, 而兩者α螺旋度的理論加和值為67%. 實測值與理論加和值存在顯著差異, 這一結果表明, mHT-βAla-m4HR與靶序列N36產生了一定程度的相互作用[27,28], 破壞了N36所形成的3股α螺旋.
2.2α螺旋肽與多酚之間產生協同效應
HIV-1 Env介導的細胞融合活性測試結果如表1所示, m4HR的活性為36.91 μmol/L. 將多酚類化合物綴合到m4HR的N端后, 綴合物的活性為5.34~22.37 μmol/L, 比m4HR提高了2~7倍. 該結果表明, m4HR和多酚之間產生了協同效應.
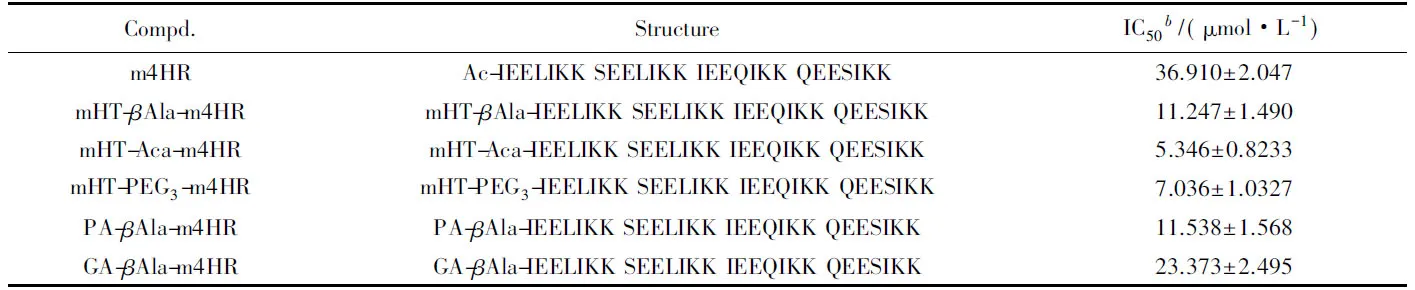
Table 1 Inhibitory activities of conjugates on HIV-1 Env-mediated cell-cell fusiona
此外, 本文還考察了不同類型的多酚及連接臂對協同效應的影響. 在m4HR和mHT之間, 選用了3種不同柔性和長度的連接臂βAla, Aca及PEG3. 其中,βAla結構最簡單, 靈活性最弱; PEG3與Aca長度相近, 因結構中存在氧原子而具有更好的柔性. 通過比較mHT-βAla-m4HR, mHT-Aca-m4HR以及mHT-PEG3-m4HR的HIV-1抑制作用發現, 連接臂的類型對綴合物的活性無顯著影響. mHT, GA和PA這3種不同的多酚均以βAla為連接臂將其綴合到m4HR上, 分別得到mHT-βAla-m4HR, PA-βAla-m4HR及GA-βAla-m4HR, HIV-1 Env介導的細胞-細胞融合活性測試表明, 三者活性相當, 說明多酚的種類對協同效應無顯著影響.
3 結 論
將具有α螺旋的肽序列m4HR與多酚類化合物mHT等通過共價鍵連接, 得到了仍保持α螺旋活性構象的綴合物. 這些綴合物可與靶標N36作用, 且可以在低微摩爾水平抑制HIV-1融合. 由于含Ⅰ型融合蛋白的包膜病毒具有相似的6HB過渡態結構, 本文結果對包括HIV-1在內的Ⅰ型包膜病毒融合抑制劑的設計具有指導意義.
參 考 文 獻
[1] Lu M., Blacklow S. C., Kim P. S.,Nat.Struct.Biol., 1995, 2, 1075—1082
[2] Moore J. P., Doms R. W.,Proc.Natl.Acad.Sci.USA, 2003, 100, 10598—10602
[3] Liu S., Zhao Q., Jiang S.,Peptides, 2003, 24(9), 1303—1313
[4] Donegan E., Stuart M., Niland J. C.,Ann.Intern.Med., 1990, 113(10), 733—739
[5] Cai L. F., Jiang S. B.,Chem.Med.Chem., 2010, 5(11), 1813—1824
[6] Jiang S., Lin K., Strick N., Neurath A. R.,Nature, 1993, 365, 113—114
[7] Wild C. T., Shugars D. C., Greenwell T. K., McDanal C. B., Matthews T. J.,Proc.Natl.Acad.Sci.USA, 1994, 91, 9770—9774
[8] Chen C. H., Greenberg M. L., Bolognesi D. P., Matthews T. J.,AIDSRes.Hum.Retroviruses, 2000, 16(8), 2037—2041
[9] Zhang S., Shi W. G., Wang C., Cai L. F., Zheng B. H., Wang K., Feng S. L., Jia Q.Y., Liu K. L.,Chem.J.ChineseUniversities, 2014, 35(12), 2542—2546(張沙, 史衛國, 王潮, 蔡利峰, 鄭保華, 王昆, 馮思良, 賈啟燕, 劉克良. 高等學校化學學報, 2014, 35(12), 2542—2546)
[10] Joly V., Jidar K., Tatay M., Yeni P.,ExpertOpin.Pharmacother., 2010, 11, 2701—2713
[11] Chan D. C., Fass D., Berger J. M., Kim P. S.,Cell, 1997, 89(2), 263—273
[12] Judice J. K., Tom J. Y., Huang W., Wrin T., Vennari J., Petropoulos C. J., McDowell R. S.,Proc.Natl.Acad.Sci.USA, 1997, 94, 13426—13430
[13] Yu Y. G., Kim K. S., Jin B. S.,PeptidesforInhibitionofHIVInfection, US 6489449 B2, 2002-12-03
[14] Shi W., Qi Z., Pan C., Xue N., Asim K. D., Qie J. K., Jiang S. B., Liu K. L.,Biochem.Biophys.Res.Commun., 2008, 374(4), 767—772
[15] Shi W., Cai L., Lu L., Wang C., Wang K., Xu L., Zhang S., Han H., Jiang X., Zheng B., Jiang S., Liu K.,Chem.Commun., 2012, 48, 11579—11581
[16] Huang S., Li Z., Huang P., Chang Y., Huang P.,Biochem.Biophys.Res.Commun., 2003, 307, 1029—1037
[17] Helieh S., Jeffrey O., Ebersole L.,J.CancerTher., 2010, 1(3), 105—113
[18] Di P. R., Mazzon E., Muià C.,Genovese T., Menegazzi M., Zaffini R., Suzuski H., Cuzzocrea S.,RespirRes., 2005, 6, 66—78
[19] Massimo D., Carmela F., Roberta D., Raffaella G., Claudio G., Roberta M.,AnnIstSuperSanità, 2007, 43(4), 348—361
[20] Liu S., Lu H., Zhao Q., He Y., Niu J., Debnath A. K., Wu S., Jiang S.,Biochim.Biophys.Acta, 2005, 1723, 270—281
[21] Fassina G., Buffa A., Benelli R., Varnier O. E., Noonan D. M., Albini A.,AIDS, 2002, 16, 939— 941
[22] Lee H. S., Huang P. L., Zhang D., Lee J. W., Bao J., Sun Y., Chang Y. T., Zhang J. Z., Huang P. L.,Biochem.Biophys.Res.Commun., 2007, 354, 872—878
[23] Bao J., Zhang D. W., Zhang J. Z. H., Huang P. L., Huang P. L., Huang S. L.,FEBSLetters, 2007, 581, 2737—2742
[24] Wang C., Shi W., Cai L., Lu L., Yu F., Wang Q., Jiang X., Xu X., Wang K., Xu L., Jiang S., Liu K.,J.Antimicrob.Chemo-ther., 2014, 69, 1537—1545
[25] Jayan N., Yoshio H., Junfa F., Kenneth L. K.,Bioorg.Chem., 2003, 31, 191—197
[26] Gambacorta A., Tofani D., Bernini R., Migliorini A.,J.Agric.FoodChem., 2007, 55, 3386—3391
[27] Mary K. L., Shawn B., Kelly I. G., Teresa B. B., Stephen R. P. Jr., Gene M.,Biochemistry, 1996, 35, 13697—13708
[28] Liang G. D., Wang C., Shi W. G., Wang K., Jiang X. F., Xu X. Y., Liu K. L.,Chem.J.ChineseUniversities, 2014, 35(10), 2100—2103(梁國棟, 王潮, 史衛國, 王昆, 姜喜鳳, 許笑宇, 劉克良. 高等學校化學學報, 2014, 35(10), 2100—2103)
(Ed.: P, H, Y, K)
Design, Sythesis and Biological Evaluation of Polyphenol-α-helical Peptide Conjugates as Potent HIV-1 Fusion Inhibitors?
? Supported by the National Natural Science Foundation of China(Nos.81573266, 81373266).
CHENG Siqi1, LIANG Guodong2, JIANG Xifeng2, WANG Chao2*, LIU Keliang1,2*
(1.SchoolofPharmaceuticalEngineering,ShenyangPharmaceuticalUniversity,Shenyang110016,China;2.BeijingInstituteofPharmacologyandToxicology,AcademyofMilitaryMedicalSciences,Beijing100850,China)
Denovo-designed peptide sequences with anα-helical conformation can prevent fusogenic gp41 six-helical bundle(6HB) formation by specifically interacting with the Human Immunodificiency virus type 1(HIV-1) gp41 N-terminal heptad repeat(NHR) region, thus inhibiting HIV-1-cell membrane fusion. Meanwhile, polyphenols, such as hydroxytyrosol(HT) and (-)-epigallocatechin gallate(EGCG), are a major group of natural compounds with a broad spectrum of antiviral activity. In this paper, mHT were designed and obtained based on 3,4-dihydroxymethylacetic acid. Then, mHT and other bioactive polyphenols, were covalently conjugated to a certainα-helical peptide through specific linkers with different lengths and flexibilities. These conjugates interacted with the gp41 NHR region and exhibited promising fusion inhibitory activity, with IC50values in the low micromolar range. This study provides a promising strategy for the development of fusion inhibitors against viruses with class I fusion proteins.
Human immunodificiency virus type 1(HIV-1); Fusion inhibitor;α-Helical peptide; Polyphenol

2016-04-29.
日期: 2016-06-22.
國家自然科學基金(批準號: 81573266, 81373266)資助.
10.7503/cjcu20160295
O629.72
A
聯系人簡介: 劉克良, 男, 博士, 研究員, 博士生導師, 主要從事多肽藥物、 核酸化學及藥用高分子材料研究.
E-mail: keliangliu55@126.com
王 潮, 男, 博士, 助理研究員, 主要從事多肽藥物研究. E-mail: chaow301@gmail.com

