Gli表達下調對人胃腺癌AZ521細胞生長、轉移的影響及機制
米源,杜媛鯤,劉慶熠,廖海江,王林,王雷
(1河北醫科大學第四醫院,石家莊050011;2河北醫科大學期刊社)
?
Gli表達下調對人胃腺癌AZ521細胞生長、轉移的影響及機制
米源1,杜媛鯤2,劉慶熠1,廖海江1,王林1,王雷1
(1河北醫科大學第四醫院,石家莊050011;2河北醫科大學期刊社)
目的 探討鋅指蛋白(Gli)表達下調對人胃腺癌AZ521細胞生長、轉移的影響,并探討其分子機制。方法 將培養好的人胃腺癌AZ521細胞隨機分為實驗組和空白對照組,分別用Gli1&Gli2 siRNA、對照siRNA進行轉染。轉染48 h收集細胞,用RT-PCR技術檢測細胞內Gli1、Gli2 mRNA表達;Western blotting法檢測細胞內Gli1、Gli2、細胞周期蛋白E(CyclinE)、p21、E-鈣黏著蛋白(E-cadherin)、波形蛋白(Vimentin)和基質金屬蛋白酶9(MMP-9)蛋白的表達;流式細胞術檢測細胞周期;Transwell小室實驗檢測細胞侵襲能力。結果 轉染48 h,與空白對照組比較,實驗組Gli1、Gli2 mRNA和蛋白表達下調,CyclinE、Vimentin和MMP-9蛋白表達下調,E-cadherin、p21蛋白表達上調,G0/G1期細胞增多,S期細胞減少,侵襲能力降低(P均<0.05)。結論 同時下調Gli1、Gli2基因表達可阻滯胃腺癌AZ521細胞周期、降低細胞侵襲能力,其機制可能與二者調節CyclinE、p21、E-cadherin、Vimentin和MMP-9的表達有關。
胃腫瘤;鋅指蛋白基因;細胞周期;細胞侵襲
多數胃癌患者就診時已處于進展期,即使經過常規治療,但由于腫瘤細胞的高度侵襲性,復發轉移仍是導致患者死亡的最主要原因。近年來研究表明,Hedgehog(Hh)信號通路的異常活化和下游目的基因的過度表達是多種高侵襲性惡性腫瘤的共同特征,其參與調控多種腫瘤的異常增殖、血管生成、侵襲轉移及耐藥[1~4]。既往關于Hh異常表達和胃癌侵襲轉移的研究集中在對Hh上游通路Smo進行調控[5],而針對胃癌細胞中Hh通路的核心下游靶點鋅指蛋白1(Gli1)和Gli2的調控與胃癌生物學行為關系的研究極少。2015年8月~2016年1月,本研究通過siRNA特異性抑制Gli在胃癌細胞中的表達,初步探討Gli1、Gli2參與胃腺癌細胞生長、轉移的分子機制。
1 材料與方法
1.1 材料 人胃腺癌細胞系AZ521(河北醫科大學第四醫院腫瘤研究所)。胎牛血清(美國Gemini公司),EMEM培養液(美國Gibco公司),SilencerTMSelect Gli1、Gli2和對照siRNA(美國Life Technologies公司),LipofectamineTMRNAiMAX轉染試劑(美國Invitrogen公司);總RNA提取試劑盒(德國 Qiagen公司);TaqManTM基因表達預混液(美國Applied Biosystems公司);TaqManTMGli1、Gli2及GAPDH的引物和探針(購自美國Life Technologies公司);Gli1兔抗人多克隆抗體、E-鈣黏著蛋白(E-cadherin)鼠抗人單克隆抗體、波形蛋白(Vimentin)兔抗人單克隆抗體和基質金屬蛋白酶9(MMP-9)鼠抗人單克隆抗體(美國Abcam公司);細胞周期蛋白E(CyclinE)兔抗人單克隆抗體(美國Cell signaling公司);Gli2鼠抗人單克隆抗體、p21鼠抗人單克隆抗體和GAPDH鼠抗人單克隆抗體均(美國Santa Cruz公司)。Pierce-BCA蛋白分析試劑盒(美國Thermo Scientific公司);ECL 化學發光試劑盒(美國Thermo Scientific公司);ABI 7900HT高通量熒光定量RT-PCR儀(美國Applied Biosystems公司);Epics-XL 型流式細胞儀(美國 Beckman-Coulter公司);Matrigel 膠(美國BD公司);iScriptTMcDNA合成試劑盒(美國Bio-Rad公司);Transwell膜嵌套(美國Corning公司)。
1.2 細胞培養、分組及轉染 將AZ521細胞培養于含10%胎牛血清的 EMEM培養基。將呈對數生長期的AZ521以3×105/孔接種于6孔板,細胞融合生長至50%~60%時更換無血清培養基。將細胞隨機分為實驗組和空白對照組。按照LipofectamineTMRNAiMAX轉染試劑說明書進行siRNA干擾引物的轉染,將Gli1&Gli2 siRNA轉染入實驗組,對照siRNA轉染入空白對照組,濃度均為100 nmol/L,于轉染后6 h更換培養基。
1.3 細胞內Gli1、Gli2 mRNA表達檢測 采用RT-PCR技術。轉染后48 h收集細胞,按照總RNA提取試劑盒說明書提取各組樣本RNA并測定濃度。按照iScriptTMcDNA合成試劑盒說明書進行cDNA逆轉錄,條件:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min。用無R-Nase水稀釋cDNA,將反應體系10 μL(Taqman 基因表達預混液5 μL、cDNA 4.5 μL和TaqManTMGli1、Gli2、GAPDH各自的引物、探針0.5 μL)加樣于384孔板,放置于ABI 7900HT高通量RT-PCR儀進行擴增,擴增條件:95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,40 個循環。以GAPDH的Ct值作為內參,采用2-ΔΔCt法計算目的基因相對表達量。實驗重復3次,取平均值。
1.4 細胞內CyclinE、p21、E-cadherin、Vimentin及MMP-9蛋白表達檢測 采用Western blotting法。轉染后48 h收集細胞,PBS 洗滌3次,每個6孔板內加含有蛋白酶抑制劑的M-PER細胞總蛋白提取試劑100 μL,收集每組樣本的總蛋白提取液,BCA法測定樣本的總蛋白濃度。蛋白上樣與SDS-PAGE凝膠電泳200 V 50 min。冰水浴轉至PVDF膜100 V 1 h。室溫5%脫脂奶粉的TBST液封膜1 h,分別加入一抗,4 ℃搖床孵育過夜。TBST洗膜3次,每次10 min。分別加羊抗鼠或羊抗兔二抗(1∶20 000)室溫孵育1 h,ECL試劑發光5 min后暗室曝光顯影,Image軟件檢測蛋白條帶灰度值。設定GAPDH為內參,蛋白相對表達量=目的蛋白條帶灰度值/內參蛋白條帶灰度值。實驗重復3次,取平均值。
1.5 細胞周期檢測 采用流式細胞術。于轉染后48 h制備單細胞懸液,PBS漂洗后置于4 ℃、70%冰乙醇固定30 min。用冷PBS漂洗3次,于37 ℃含碘化丙啶40 μg和RNaseA 100 μg的PBS中孵育30 min。上機檢測各組樣品的DNA含量,采用MuticycleAV分析軟件對DNA細胞周期進行擬合分析,計算每周期細胞百分比。實驗重復3次,取平均值。
1.6 細胞侵襲能力檢測 采用Transwell小室實驗。將Matrigel膠從-80 ℃冰箱中取出置于4 ℃待其融化,按1∶4比例用培養基稀釋后鋪于聚碳酸酯膜上并放置于培養箱待固化。24 h后收集細胞,吹打為單細胞懸液重懸在無血清培養液中,在Transwell小室上室加入包含7.5×104個細胞的細胞懸液100 μL,下室加含10%血清的培養液500 μL,于37 ℃、5% CO2中培養24 h,用棉棒擦去聚碳酸酯膜上層基質膠和未遷移的細胞,4%甲醇固定,0.1%結晶紫染色。倒置顯微鏡下高倍視野(×400)觀察穿膜細胞數。每張膜隨機觀察4個視野取平均值。

2 結果
2.1 兩組Gli1、Gli2 mRNA表達比較 轉染后48 h,實驗組Gli1、Gli2 mRNA相對表達量分別為0.31±0.03、0.37±0.04,空白對照組分別為1.00±0.02、1.00±0.05;實驗組Gli1、Gli2 mRNA相對表達量低于空白對照組(P均<0.05)。
2.2 兩組各類蛋白表達比較 轉染后48 h,與空白對照組比較,實驗組Gli1、Gli2、CyclinE、MMP-9和Vimentin蛋白相對表達量降低,p21、E-cadherin蛋白相對表達量升高(P均 <0.05)。見表1。
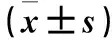
表1 兩組各類蛋白表達比較
2.3 兩組周期比較 轉染后48 h,實驗組G0/G1期細胞百分比(65.10±3.00)%,S期細胞百分比(32.99±2.50)%;空白對照組分別為(47.08±2.45)%、(50.85±2.70)%。與空白對照組比較,實驗組G0/G1期細胞增多,S期細胞減少(P均<0.05)。
2.4 兩組侵襲能力比較 轉染后24 h,實驗組穿膜細胞數(179±7)個/視野,空白對照組為(260±11)個/視野,與空白對照組比較,實驗組穿膜細胞數減少(P<0.05)。
3 討論
Hh信號通路最初在1980年在研究果蠅幼蟲體節發育的基因突變遺傳分析時被發現并命名。經典的Hh信號通路自上而下主要由Hh配體、跨膜蛋白受體Ptch、Smo、核轉錄因子Gli和下游多種靶基因等構成,其通路的異常激活與腫瘤細胞的惡性生物學行為關系密切。因此,闡明Hh通路和腫瘤轉移之間的關系將為臨床腫瘤的治療提供一個新思路。Yoo等[5]發現,Shh在胃癌組織中高表達,與臨床分期和淋巴結轉移等因素相關,應用Hh上游通路拮抗劑Cyclopamine可以抑制腫瘤細胞的轉移和淋巴管生成。此外,有研究發現,核轉錄因子Gli作為Hh信號傳導通路的核心調控樞紐,應用Gli抑制劑下調Gli表達比應用上游通路拮抗劑具有更高效的抑瘤作用,認為Gli可作為神奇的調控靶點[6]。本研究采用RNA干擾技術,應用siRNA下調人胃腺癌AZ521細胞的Gli1和Gli2表達,觀察抗腫瘤效果并探討Gli與胃癌細胞生物學行為的關系。結果顯示,轉染Gli1&Gli2 siRNA的胃癌AZ521細胞中內源性Gli1、Gli2 mRNA和蛋白表達均顯著下調,低于空白對照組,提示在胃癌AZ521細胞中存在Gli異常激活,應用特異性的Gli1、Gli2 siRNA能有效下調胃癌細胞中內源性Gli1、Gli2的表達。
細胞周期紊亂與腫瘤的發生密切相關,因此對細胞增殖的調節最終體現在細胞周期。本研究結果顯示,實驗組較空白對照組G0/G1期細胞增多,S期細胞減少,從而調控腫瘤細胞的異常增殖。CyclinE是參與細胞周期G1與S轉換的重要正性調節因子,在腫瘤細胞G1晚期發揮正調控細胞周期的作用,促進腫瘤的異常增殖。研究發現,在前列腺癌細胞中應用Sox2可下調CyclinE進而抑制腫瘤的增殖[7]。p21作為周期蛋白依賴性激酶抑制劑可以與Cyclin-CDK復合物相結合調節細胞周期。p21表達上調可以通過抑制CDK2和CyclinE從而達到抑制上皮細胞增殖的作用[8]。目前關于胃腺癌細胞Gli表達與CyclinE、p21關系的研究國內外少有報道。本研究發現,沉默Gli1和Gli2基因表達后,胃腺癌AZ521細胞CyclinE蛋白表達下降,p21蛋白表達上調,表明Hh/Gli信號通路異常激活后誘導細胞惡性轉化有可能是通過調節p21和CyclinE表達來完成,抑制Gli的表達可以調控AZ521的細胞周期。
腫瘤細胞除了異常增殖之外,另一個重要特征就是腫瘤細胞通過上皮-間質轉化(EMT)的生物學過程失去了上皮細胞表型的緊密連接,同時獲得間質細胞表型,促進細胞的侵襲、遷移。其中以上皮表型標志E-cadherin下調和間質表型Vimentin上調為重要特征,使腫瘤細胞更加富于侵襲性[9,10]。此外,MMP-9也是EMT的標記物之一,可以通過破壞、降解鄰近腫瘤表面的細胞外基質和基底膜,促進腫瘤侵襲和轉移。Moirangthem等[11]研究發現,下調MMP-9可以通過增加細胞間的黏附和調節EMT過程抑制乳腺癌的進展。Aaij等[12]發現,轉染Vimentin基因的膀胱癌細胞中Vimentin和MMP-9蛋白表達上調,明顯增強了膀胱癌細胞的侵襲性。本研究發現,下調Gli1、Gli2表達后可導致E-cadherin表達上調,Vimentin和MMP-9表達下調;Transwell小室實驗進一步表明下調Gli1、Gli2表達后穿膜細胞數明顯減少。究其原因可能是Gli通過下調E-cadherin和上調Vimentin表達,誘導EMT,促進胃癌細胞的侵襲轉移,抑制Gli1和Gli2表達可以抑制腫瘤細胞的侵襲。
綜上所述,Gli siRNA能顯著下調胃腺癌細胞中內源性Gli mRNA和蛋白的表達,Gli表達下調可以改變胃腺癌細胞周期分布和EMT進程,這可能與Gli調控Cyclin E、p2l、E-cadherin、Vimentin和MMP-9蛋白表達密切相關。
[1] Choe JY, Yun JY, Jeon YK, et al. Sonic hedgehog signalling proteins are frequently expressed in retinoblastoma and are associated with aggressive clinicopathological features[J]. J Clin Pathol, 2015,68(1):6-11.
[2] Giroux Leprieur E, Vieira T, Antoine M, et al. Sonic hedgehog pathway activation is associated with resistance to platinum-based chemotherapy in advanced non-small-cell lung carcinoma[J]. Clin Lung Cancer, 2016,17(4):301-308.
[3] Inaguma S, Riku M, Ito H, et al. GLI1 orchestrates CXCR4/CXCR7 signaling to enhance migration and metastasis of breast cancer cells[J]. Oncotarget, 2015,6(32):33648-33657.
[4] Shigemura K, Fujisawa M. Hedgehog signaling and urological cancers[J]. Curr Drug Targets, 2015,16(3):258-271.
[5] Yoo YA, Kang MH, Lee HJ, et al. Sonic hedgehog pathway promotes metastasis and lymphangiogenesis via activation of Akt, EMT, and MMP-9 pathway in gastric cancer[J]. Cancer Res, 2011,71(22):7061-7070.
[6] Li H, Lui N, Cheng T, et al. Gli as a novel therapeutic target in malignant pleural mesothelioma[J]. PLoS One, 2013,8(3):e57346.
[7] Lin F, Lin P, Zhao D, et al. Sox2 targets cyclinE, p27 and survivin to regulate androgen-independent human prostate cancer cell proliferation and apoptosis[J]. Cell Prolif, 2012,45(3):207-216.
[8] Wang Y, Yuan Z, You C, et al. Overexpression p21WAF1/CIP1 in suppressing retinal pigment epithelial cells and progression of proliferative vitreoretinopathy via inhibition CDK2 and cyclin E[J]. BMC Ophthalmol, 2014(14):144.
[9] Beuran M, Negoi I, Paun S, et al. The epithelial to mesenchymal transition in pancreatic cancer: A systematic review[J]. Pancreatology, 2015,15(3):217-225.
[10] Chiu KY, Wu CC, Chia CH, et al. Inhibition of growth, migration and invasion of human bladder cancer cells by antrocin, a sesquiterpene lactone isolated from Antrodia cinnamomea, and its molecular mechanisms[J]. Cancer Lett, 2016,373(2):174-184.
[11] Moirangthem A, Bondhopadhyay B, Mukherjee M, et al. Simultaneous knockdown of uPA and MMP-9 can reduce breast cancer progression by increasing cell-cell adhesion and modulating EMT genes[J]. Sci Rep, 2016(6):21903.
[12] Aaij R, Adeva B, Adinolfi M, et al. Precision measurement of the mass and lifetime of the Xi(b)(0) baryon Baryon[J]. Phys Rev Lett, 2014,113(3):032001.
王雷(E-mail:yuankundu@163.com)
河北省科技廳科技攻關計劃項目(132077127D)
10.3969/j.issn.1002-266X.2016.37.011
R735.2
A
1002-266X(2016)37-0035-03
2016-03-29)

