外源性硫化氫對人宮頸癌HeLa細胞的影響及作用機制
馮曉冰,陳建國,楊翼鷹,陳景福,甄育蘭
(1高州市第二人民醫院,廣東高州525200;2廣東省人民醫院;3中山大學附屬第一醫院;4廣東醫學院附屬醫院)
?
外源性硫化氫對人宮頸癌HeLa細胞的影響及作用機制
馮曉冰1,陳建國2,楊翼鷹3,陳景福3,甄育蘭4
(1高州市第二人民醫院,廣東高州525200;2廣東省人民醫院;3中山大學附屬第一醫院;4廣東醫學院附屬醫院)
目的 探討外源性硫化氫對人宮頸癌Hela細胞的影響及其作用機制。方法 將培養好的人宮頸癌HeLa細胞隨機分為6組,正常對照組:正常培養,不作任何處理;NaHS組:加入400 μmol/L的NaHS;NaHS+PDTC組:加入400 μmol/L的NaHS和100 μmol/L的PDTC(NF-κB通路抑制劑);NaHS+NS-398組:加入400 μmol/L的NaHS和10 μmol/L的NS-398(COX-2通路抑制劑);PDTC組:加入100 μmol/L的PDTC;NS-398組:加入10 μmol/L的NS-398。各組干預24 h,用CCK-8法測定細胞相對存活率,用ELISA法檢測細胞培養上清液中血管內皮生長因子(VEGF)水平,用Transwell小室實驗檢測細胞遷移能力,用Western blotting法檢測細胞內Caspase-1、Caspase-12、p-NF-κB p65和COX-2蛋白表達。結果 干預24 h,與正常對照組、NaHS+PDTC組、NaHS+NS-398組比較,NaHS組細胞相對存活率、培養上清液VEGF水平、細胞遷移能力及NF-κB p65(除外NaHS+NS-398組)、COX-2蛋白表達升高,Caspase-1、Caspase-12蛋白表達降低(P均<0.05);PDTC組、NS-398組以上指標與正常對照組比較差異無統計學意義(P均>0.05)。結論 外源性硫化氫可通過激活NF-κB/COX-2信號傳導通路促進人宮頸癌HeLa細胞增殖、新生血管形成、細胞遷移。
宮頸腫瘤;硫化氫;HeLa細胞;核因子κB;環氧合酶2
宮頸癌是常見婦科惡性腫瘤之一,對女性健康危害極大,因此對宮頸癌的病因和發病機制進行研究尤為重要。核因子κB(NF-κB)是人體內重要的轉錄調控因子之一,其在宮頸病變組織中的過表達可促使該部位從炎癥反應向宮頸癌轉化[1]。環氧合酶2(COX-2)在腫瘤病理狀態下可被誘導表達,在宮頸癌腫瘤組織中COX-2表達高于宮頸正常組織[2]。研究發現,NF-κB可上調多種腫瘤組織中的COX-2基因表達水平,誘導血管生成和促進腫瘤的轉移[3~5]。然而在宮頸癌的病理過程中,NF-κB通路激活與COX-2表達是否存在相關關系仍未得到證實。硫化氫(H2S)是體內重要的氣體信號分子,多項研究證實H2S有助于腫瘤細胞的生長、增殖、遷移和侵襲[6~9]。研究發現,外源性H2S可促進肝癌細胞或膠質瘤細胞的增殖、血管形成、遷移以及抗腫瘤細胞凋亡[10,11],但目前外源性H2S對宮頸癌細胞的影響及機制仍無相關報道。2015年5月~2016年5月,本研究觀察外源性H2S對宮頸癌HeLa細胞的影響,并探討其與NF-κB/COX-2通路的關系。
1 材料與方法
1.1 材料 人宮頸癌HeLa細胞株,由中山大學實驗動物中心細胞庫提供。細胞計數試劑盒8(CCK-8),購自Dojindo Lab公司;NaHS(H2S的供體)、Hoechst 33258、NF-κB通路抑制劑(PDTC)、COX-2通路抑制劑(NS-398),購自Sigma-Aldrich公司;RPMI1640培養基、特級胎牛血清(FBS),購自Gibco BRL。抗Caspase-1抗體、抗Caspase-12抗體、抗COX-2抗體和抗NF-κB p65抗體,購自Cell Signaling technology Inc。ELISA試劑盒,購自R&D公司;Transwell小室,購自Corning公司。
1.2 細胞培養與分組 HeLa細胞置于RPMI1640培養基(含10%特級FBS)中培養,并置于5% CO2、37 ℃的恒溫箱中。將細胞分為6組,正常對照組:正常培養,不作任何處理;NaHS組:加入終濃度為400 μmol/L的NaHS;NaHS+PDTC組:加入終濃度為400 μmol/L的NaHS和終濃度為100 μmol/L的PDTC;NaHS+NS-398組:加入終濃度為400 μmol/L的NaHS和終濃度為10 μmol/L的NS-398;PDTC組:加入終濃度為100 μmol/L的PDTC;NS-398組:加入終濃度為10 μmol/L的NS-398。
1.3 細胞相對存活率測定 采用CCK-8法。干預24 h,將細胞接種于96孔板中,于每孔中加入CCK-8 10 μL和RPMI1640培養基90 μL,輕搖,37 ℃孵育1.5 h,用酶標儀檢測450 nm波長處各孔光密度值。取5孔光密度值的平均數,計算細胞相對存活率。細胞相對存活率(%)=實驗組光密度值/對照組光密度值×100%。實驗重復3次,取平均值。
1.4 細胞培養上清液中血管內皮生長因子(VEGF)檢測 采用ELISA法。干預24 h,取細胞培養上清液用ELISA法測定VEGF水平。根據ELISA試劑盒說明書進行操作,終止反應。用酶標儀檢測450 nm波長處各孔光密度值,用標準物濃度與光密度值的標準曲線直線回歸方程,計算出樣品濃度,再乘以稀釋倍數,即為VEGF的實際水平。實驗重復3次。
1.5 細胞遷移能力檢測 采用Transwell小室實驗。干預24 h,將Transwell小室置于24孔板,下室加入含10%胎牛血清的RPMI1640培養基800 μL,上室加含1%胎牛血清的RPMI1640培養基300 μL,含對數生長期的HeLa細胞2×105。培養48 h,將小室取出并用PBS清洗,對上室沒有穿過的細胞用濕棉簽輕輕擦掉,以100%結晶紫(無水甲醇配制)染色,在200倍顯微鏡下從小室的上、下、左、右、中共選取5個視野對穿膜細胞進行計數。實驗重復3次,取平均值。
1.6 細胞內p-NF-κB p65、COX-2及Caspase-1、Caspase-12蛋白表達檢測 采用Western blotting法。干預24 h,棄培養基,用預冷的PBS沖洗3次,加入裂解液,4 ℃靜置30 min,12 000 r/min離心10 min,取上清,采用BCA法進行蛋白定量。總蛋白經SDS-PAGE分離后,轉移到PVDF膜上。用5%脫脂奶粉封閉60 min,隨后分別加入抗p-NF-κB p65抗體(1∶1 000)、抗t-NF-κB p65抗體(1∶1 000)作對照、抗COX-2抗體(1∶1 000)、抗Caspase-1抗體(1∶1 000)、抗Caspase-12抗體(1∶1 000),4 ℃過夜,用TBST洗3次,10 min/次。將PVDF膜用發光試劑ECL顯色,暗室曝光到X線片上,凝膠成像系統掃描分析結果。目的蛋白相對表達量=目的蛋白條帶灰度值/GAPDH條帶灰度值,p-NF-κB p65蛋白相對表達量=p-NF-κB p65條帶灰度值/t-NF-κB p65條帶灰度值。實驗重復3次,取平均值。

2 結果
2.1 各組細胞相對存活率比較 干預24 h,正常對照組、NaHS組、NaHS+PDTC組、NaHS+NS-398組、PDTC組、NS-398組細胞相對存活率分別為(100±0.00)%、(132.64±6.39)%、(112.05±7.61)%、(113.16±5.95)%、(98.79±3.45)%、(99.61±6.75)%。與其他各組比較,NaHS組細胞相對存活率升高(P均<0.05),PDTC組、NS-398組細胞相對存活率與正常對照組比較差異無統計學意義(P均>0.05)。
2.2 各組培養上清液VEGF水平比較 干預24 h,正常對照組、NaHS組、NaHS+PDTC組、NaHS+NS-398組、PDTC組、NS-398組培養上清液VEGF水平分別為(100.00±0.00)%、(193.84±8.43)%、(149.13±14.89)%、(138.16±6.52)%、(97.12±6.67)%、(98.97±10.10)%。與其他各組比較,NaHS組培養上清液VEGF水平升高(P均<0.05),PDTC組、NS-398組培養上清液VEGF水平與正常對照組比較差異無統計學意義(P均>0.05)。
2.3 各組遷移能力比較 正常對照組、NaHS組、NaHS+PDTC組、干預24 h,NaHS+NS-398組、PDTC組、NS-398組穿膜細胞數分別為(9.33±3.06)、(44.33±8.33)、(23.00±2.65)、(27.67±3.21)、(11.67±3.51)、(8.33±5.86)個/視野。與其他各組比較,NaHS組穿膜細胞數增多(P均<0.05),PDTC組、NS-398組穿膜細胞數與正常對照組比較差異無統計學意義(P均>0.05)。2.4 各組p-NF-κB p65、COX-2及Caspase-1、Caspase-12蛋白表達比較 見表1。
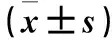
表1 各組p-NF-κB p65、COX-2及Caspase-1、Caspase-12蛋白表達比較
注:與NaHS組相比,△P<0.05。
3 討論
宮頸癌是嚴重危害女性健康的惡性腫瘤之一[12,13]。越來越多的研究表明,宮頸癌的發生發展是一個包括HPV感染和其他協同因素共同作用的復雜過程。某些信號分子、轉錄因子或者信號傳導通路的活性改變在宮頸癌的發病機制中可能發揮了重要作用[14,15]。因此,本研究在既往研究基礎上進一步探究宮頸癌發生發展的相關分子生物學機制,以期為預防及治療宮頸癌提供新的思路。
作為體內重要信號分子之一,H2S擁有多種生物活性,包括促進血管生成[16]、抗氧化[17]和抗炎癥反應[18]等。內源性H2S也參與多種腫瘤的病理生理過程[19~21]。我們在前期研究中證實,外源性H2S能夠作用于肝癌細胞和神經膠質瘤細胞,促進腫瘤細胞增殖、減少腫瘤細胞凋亡、促進新生血管形成及增強腫瘤細胞遷移浸潤能力[10,11]。然而,目前關于H2S與宮頸癌發生發展之間的聯系仍無相關報道。本實驗首次證實了外源性H2S可以提高宮頸癌HeLa細胞存活率、減少其凋亡和促進其遷移,還可以上調HeLa細胞VEGF的分泌水平。VEGF可以由多種腫瘤(如胃癌、肝癌、宮頸癌和肺癌等)細胞產生,是重要的促血管生成因子之一,能增加血管通透性,促進血管內皮細胞增殖,從而促進新生血管形成[22,23]。因此,外源性H2S可能通過促進新生血管形成從而提高宮頸癌細胞的血運功能。以上研究結果與我們前期關于外源性H2S對肝癌細胞和膠質瘤細胞等腫瘤細胞的生理功能影響的研究[10,11]結果一致。
NF-κB屬于Rel蛋白家族,該蛋白家族在哺乳動物體內有5個成員:ReA(p65)、ReB、c-Rel、p105/p50(NF-κB1)和p100/p52(NF-κB2),它們N末端的Rel同源結構域含有使NF-κB形成同源或異源二聚體、核定位信號及識別DNA相應位點的序列。相關研究指出,NF-κB在宮頸癌病變組織中表達升高,并且與宮頸癌的分化程度、侵襲轉移和預后密切相關,提示NF-κB激活在宮頸癌的發生發展過程中有重要作用[15,24]。Kuncharin等[1]在研究宮頸癌細胞系時發現,Notch信號通路相關信號分子可通過對NF-κB通路的激活,從而提高腫瘤細胞的增殖能力和抑制腫瘤細胞凋亡。COX又稱前列腺素類過氧化物合成酶,可催化花生四烯酸轉化為前列腺素類物質。COX-2在大多數組織中可被多種胞外刺激所誘導表達,從而成為炎癥過程中重要的誘導酶。多種腫瘤組織中的COX-2表達與腫瘤的進展有關。現已發現,與正常宮頸表皮組織相比,宮頸癌組織中的COX-2的表達明顯升高,并且與VEGF的表達水平呈正相關,而兩者的高表達與宮頸癌細胞的浸潤和侵襲密切聯系[2]。本研究測定細胞的NF-κB p65的磷酸化水平和COX-2的表達水平,發現外源性H2S作用于HeLa細胞可以明顯促進NF-κB p65的磷酸化,并且提高COX-2的表達水平。為了進一步探究外源性H2S對HeLa細胞的上述生理作用的相關分子機制,本研究分別觀察PDTC(NF-κB通路抑制劑)和NS-398(COX-2通路抑制劑)對外源性H2S作用于HeLa細胞產生相關通路蛋白表達水平的影響以及保護HeLa細胞和促進細胞新生血管形成作用的影響,發現PDTC能減少外源性H2S對NF-κB通路磷酸化蛋白的激活作用,而NS-398能降低外源性H2S對COX-2通路蛋白表達的促進效應。而且,PDTC和NS-398均可對抗外源性H2S對HeLa細胞的毒性保護、抗凋亡、促進新生血管形成和促進細胞遷移的作用。這提示,外源性H2S對HeLa細胞的相關生理功能可能與NF-κB信號通路和COX-2信號通路的激活有關。最為重要的是,本研究發現,應用NaHS與NS-398共處理HeLa細胞后,p-NF-κB p65的表達與NaHS組并無明顯差異;而NaHS和PDTC共處理HeLa細胞后,COX-2的表達水平與NaHS處理組相比則顯著下降。進一步證實了COX-2是宮頸癌細胞中NF-κB信號通路的下游信號分子,抑制NF-κB信號通路活性可以明顯下調COX-2蛋白的表達,抑制COX-2表達對NF-κB信號通路表達則無明顯負反饋作用。而H2S可能是通過NF-κB信號通路調節COX-2的表達,從而對HeLa細胞發揮相關的生理功能。這與此前相關報道結果相一致[3~5]。
本研究以宮頸癌HeLa細胞為研究對象,首次證實了外源性H2S可以減少HeLa細胞毒性作用、提高細胞存活率、抗細胞凋亡、促進細胞的新生血管生成及細胞遷移。而且這些生理功能可能是通過NF-κB/COX-2信號通路的激活而實現;而阻斷該通路的激活則可以抑制H2S對HeLa細胞的上述生理作用。由于H2S是體內重要的活性氣體分子,所以這可能是宮頸癌發病的重要生理機制之一。隨著分子生物學進一步發展,H2S促進子宮頸癌發生發展的生理機制將會更加明確,這將為臨床治療宮頸癌提供新的理論基礎和科學依據。
[1] Kuncharin Y, Sangphech N, Kueanjinda P, et al. MAML1 regulates cell viability via the NF-κB pathway in cervical cancer cell lines[J]. Exp Cell Res, 2011,317(13):1830-1840.
[2] Hammes LS, Tekmal RR, Naud P, et al. Up-regulation of VEGF, c-fms and COX-2 expression correlates with severity of cervical cancer precursor (CIN) lesions and invasive disease[J]. Gynecol Oncol, 2008,110(3):445-451.
[3] Read MA, Whitley MZ, Williams AJ, et al. NF-kappa B and I kappa B alpha: an inducible regulatory system in endothelial activation[J]. J Exp Med, 1994,179(2):503-512.
[4] Karin M, Greten FR. NF-kappaB: linking inflammation and immunity to cancer development and progression[J]. Nat Rev Immunol, 2005,5(10):749-759.
[5] Vakkala M, Kahlos K, Lakari E, et al. Inducible nitric oxide synthase expression, apoptosis, and angiogenesis in in situ and invasive breast carcinomas[J]. Clin Cancer Res, 2000,6(6):2408-2416.
[6] Levine J, Ellis CJ, Furne JK, et al. Fecal hydrogen sulfide production in ulcerative colitis[J]. Am J Gastroenterol, 1998,93(1):83-87.
[7] Rose P, Moore PK, Ming SH, et al. Hydrogen sulfide protects colon cancer cells from chemopreventative agent beta-phenylethyl isothiocyanate induced apoptosis[J]. World J Gastroenterol, 2005,11(26):3990-3997.
[8] Pupo E, Pla AF, Avanzato D, et al. Hydrogen sulfide promotes calcium signals and migration in tumor-derived endothelial cells[J]. Free Radic Biol Med, 2011,51(9):1765-1773.
[9] Du SX, Xiao J, Guan F, et al. Predictive role of cerebrospinal fluid hydrogen sulfide in central nervous system leukemia[J]. Chin Med J (Engl), 2011,124(21):3450-3454.
[10] Zhen Y, Pan W, Hu F, et al. Exogenous hydrogen sulfide exerts proliferation/anti-apoptosis/angiogenesis/migration effects via amplifying the activation of NF-κB pathway in PLC/PRF/5 hepatoma cells[J]. Int J Oncol, 2015,46(5):2194-2204.
[11] Zhen Y, Zhang W, Liu C, et al. Exogenous hydrogen sulfide promotes C6 glioma cell growth through activation of the p38 MAPK/ERK1/2-COX-2 pathways[J]. Oncol Rep, 2015,34(5):2413-2422.
[12] Basu S, Mahajan A. Psoas muscle metastasis from cervical carcinoma: correlation and comparison of diagnostic features on FDG-PET/CT and diffusion-weighted MRI[J]. World J Radiol, 2014,6(4):125-129.
[13] De Bacco F, Luraghi P, Medico E, et al. Induction of MET by ionizing radiation and its role in radioresistance and invasive growth of cancer[J]. J Natl Cancer Inst, 2011,103(8):645-661.
[14] Du CX, Wang Y. Expression of P-Akt, NFkappaB and their correlation with human papillomavirus infection in cervical carcinoma[J]. Eur J Gynaecol Oncol, 2012,33(3):274-277.
[15] Li J, Jia H, Xie L, et al. Association of constitutive nuclear factor-kappaB activation with aggressive aspects and poor prognosis in cervical cancer[J]. Int J Gynecol Cancer, 2009,19(8):1421-1426.
[16] Papapetropoulos A, Pyriochou A, Altaany Z, et al. Hydrogen sulfide is an endogenous stimulator of angiogenesis[J]. Proc Natl Acad Sci U S A, 2009,106(51):21972-21977.
[17] Kimura H. Hydrogen sulfide: from brain to gut[J]. Antioxid Redox Signal, 2010,12(9):1111-1123.
[18] Hegde A, Bhatia M. Hydrogen sulfide in inflammation: friend or foe[J]. Inflamm Allergy Drug Targets, 2011,10(2):118-122.
[19] Lechuga TJ, Zhang HH, Sheibani L, et al. Estrogen replacement therapy in ovariectomized nonpregnant ewes stimulates uterine artery hydrogen sulfide biosynthesis by selectively up-regulating cystathionine beta-synthase expression[J]. Endocrinology, 2015,156(6):2288-2298.
[20] You XJ, Xu C, Lu JQ,et al. Expression of cystathionine beta-synthase and cystathionine gamma-lyase in human pregnant myometrium and their roles in the control of uterine contractility[J]. PLoS One, 2011,6(8):e23788.
[21] Patel P, Vatish M, Heptinstall J, et al. The endogenous production of hydrogen sulphide in intrauterine tissues[J]. Reprod Biol Endocrinol, 2009(7):10.
[22] Ferrara N. Pathways mediating VEGF-independent tumor angiogenesis[J]. Cytokine Growth Factor Rev, 2010,21(1):21-26.
[23] Takahashi S. Vascular endothelial growth factor (VEGF), VEGF receptors and their inhibitors for antiangiogenic tumor therapy[J]. Biol Pharm Bull, 2011,34(12):1785-1788.
[24] Li J, Jia H, Xie L, et al. Association of constitutive nuclear factor-kappaB activation with aggressive aspects and poor prognosis in cervical cancer[J]. Int J Gynecol Cancer, 2009,19(8):1421-1426.
陳建國(E-mail:chenjianguo_gz@163.com)
10.3969/j.issn.1002-266X.2016.37.010
R737.33
A
1002-266X(2016)37-0031-04
2016-06-03)

