糖尿病痛性周圍神經病的臨床及神經電生理特征
張俊清+王亞春+烏日樂
【摘要】 目的 觀察糖尿病痛性周圍神經病的臨床及神經電生理特征。方法 60例臨床表現為肢體疼痛且確診為2型糖尿病的患者, 均進行四肢神經傳導檢測(NCS)、軀體感覺誘發電位(SEP)、皮膚交感反應(SSR)、F波、H反射及肌電圖(EMG)檢測, 以本室的正常值為標準進行判斷。結果 SSR異常率(81.7%)高于其他檢測(P<0.05), 其次為感覺神經傳導檢測(SNCS)(43.3%)、運動神經傳導檢測(MNCS)(35.0%), EMG(6.7%)最低。結論 SSR、NCS是糖尿病痛性周圍神經病變診斷的敏感指標。
【關鍵詞】 糖尿病;痛性周圍神經病;神經電生理
DOI:10.14163/j.cnki.11-5547/r.2016.27.007
【Abstract】 Objective To observe clinical and nerve electrophysiological characteristics of diabetic painful peripheral neuropathy. Methods A total of 60 patients with diagnosed type 2 diabetes mellitus and limb pain symptoms received detection by limb nerve conduction studies (NCS), body sensory evoked potential (SEP), sympathetic skin response (SSR), F wave, H reflex and electromyography (EMG), with standard by normal value. Results SSR showed higher abnormal rate (81.7%) than other tests (P<0.05), followed by sensory nerve conduction studies (SNCS) (43.3%), moter nerve conduction studies (MNCS) (35.0%) and EMG (6.7%). Conclusion SSR and NCS are sensitive indexes in diagnosis of diabetic painful peripheral neuropathy.
【Key words】 Diabetes; Painful peripheral neuropathy; Nerve electrophysiology
糖尿病周圍神經病(DPN)是糖尿病慢性進展中最常見的并發癥之一, 臨床表現因損害的神經不同而各異, 其臨床發病率可達50%~90%, 而用神經電生理學的改變來判斷, 其發病率可達80%~100%[1]。糖尿病周圍神經病患者中, 有一部分患者主要表現為從腳開始出現的疼痛和感覺異常, 疼痛多為隱痛、刺痛、灼燒痛, 夜間尤甚, 部分患者表現為單神經痛, 稱其為糖尿病痛性周圍神經病。疼痛不僅嚴重影響患者的生活質量, 也大大增加社會的負擔。本文分析糖尿病痛性周圍神經病的臨床及神經電生理特征, 以利于早期診斷及治療, 報告如下。
1 資料與方法
1. 1 一般資料 選取本院2012~2015年內分泌科、神經內科住院及門診60例臨床表現為肢體疼痛且確診為2型糖尿病的患者。均符合1999年WHO認可的2型糖尿病診斷標準, 空腹血糖≥7.0 mmol/L和(或)糖負荷后2 h血糖≥11.1 mmol/L。除外慢性炎性脫髓鞘性多發性神經根周圍神經病、營養缺乏、中毒、異常球蛋白血癥、肝功能不全、腎功能不全、甲狀腺功能減退、惡性腫瘤、結締組織病、感染性疾病以及遺傳病等引起的周圍神經病。男36例, 女24例, 年齡39~80歲, 平均年齡60.2歲, 糖尿病病程3個月~30年。患者均有肢體麻木、疼痛, 3例患者伴有面神經麻痹, 21例患者有肢體疲乏無力癥狀, 7例患者伴有行走不穩癥狀。
1. 2 方法 采用丹麥制造丹迪4通道EMG誘發電位儀, 室溫保持22~28℃, 對所有患者進行運動神經傳導檢查, 包括雙側正中神經、尺神經、腓總神經、脛神經, 檢查內容包括運動神經傳導速度(MNCV)、運動末端潛伏期(DL)、波幅;感覺神經傳導檢查, 包括雙側正中神經、尺神經、腓淺神經、腓腸神經, 檢查內容包括感覺神經傳導速度(SNCV)、起始潛伏時、波幅;F波潛伏時檢測, 包括正中神經、脛神經;H反射潛伏時檢測;SSR檢查, 記錄起始潛伏時及波幅;SEP檢測, 包括正中神經、脛神經, 正中神經記錄周圍N9及中樞N13、P15、N20電位, 脛神經記錄周圍N8及中樞N18、P40和N45電位的潛伏期及波幅。EMG:記錄自發電位、輕收縮運動單位時限及大力募集相。所有電生理結果均與本實驗室年齡匹配的正常值進行比較, 判斷是否存在異常。
1. 3 統計學方法 采用SPSS13.0統計學軟件對數據進行統計分析。計數資料以率(%)表示, 采用χ2檢驗。P<0.05表示差異具有統計學意義。
2 結果
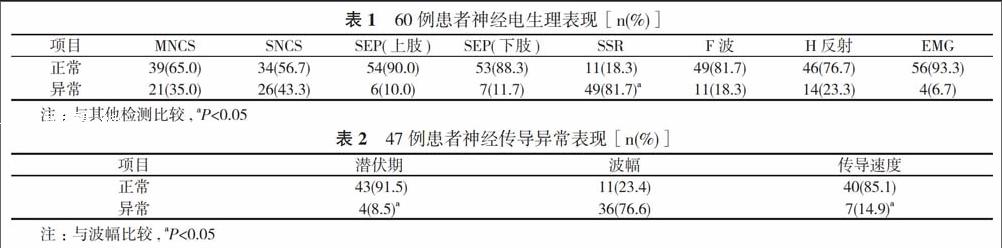
2. 1 神經電生理表現 SSR異常率(81.7%)高于其他檢測, 差異具有統計學意義 (P<0.05), 其次為SNCS(43.3%)、MNCS (35.0%);病程短的患者主要表現為H反射潛伏期的異常;SEP異常率相對低, 多出現在痛性周圍神經病合并有行走不穩的患者;EMG(6.7%)最低, 多出現在伴有疲乏無力的患者。見表1。
2. 2 神經傳導異常表現NCS異常以軸索損害為著, 表現為傳導波幅減低(占76.6%), 部分以脫髓鞘損害為著, 表現為潛伏時延長, 傳導速度減慢(占23.4%)。見表2。
3 討論
痛性周圍神經病分為原因不明確的自發性周圍神經痛, 以及繼發于某些疾病的周圍神經痛, 繼發于感染, 如格林巴利綜合征;繼發于腫瘤如副腫瘤綜合征;繼發于中毒, 如藥物中毒、酒精中毒;繼發于代謝性疾病, 如甲狀腺功能亢進癥、糖尿病等。而糖尿病周圍神經病是糖尿病常見并發癥之一, 是痛性周圍神經病的常見原因, 以疼痛為主要表現, 屬于神經病理性疼痛的一種, 痛性周圍神經病的發病機理復雜, 包括有Na+通道功能異常, 導致異常沖動反復發作;周圍神經損傷, 再生感受器疊加疼痛刺激, 使疼痛持續反復發作。而糖尿病痛性周圍神經病除以上發病機制外, 血糖過高是一個重要因素, 高血糖可使位于施萬細胞內的醛糖還原酶活性增加, 從而增加了高滲物質山梨醇和果糖的濃度, 誘導氧化應激增加、內皮功能失調, 造成水鈉潴留, 導致神經元代謝異常和DNA損害, 致使細胞水腫、變性、壞死, 并引起神經纖維脫髓鞘及軸索變性。炎癥和葡萄糖代謝終末產物對于疼痛的發生也很關鍵[2, 3]。病變早期, 主要影響管痛覺的小神經纖維, 病程較長的患者, 可伴有或不伴有管深感覺的大纖維病變。疼痛包括自發性疼痛與誘發性疼痛, 自發性疼痛指持續或間歇出現的刺痛、酸痛、跳痛、觸痛、痙攣樣疼痛、燒灼樣痛、電擊痛、撕裂樣痛等; 誘發性指感覺過敏、感覺倒錯、感覺異常、感覺過度等[4]。患者大多表現為肢體遠端對稱性疼痛, 且和受損的神經長度有關, 越遠端的神經, 損害越早。多數隱匿起病, 自下向上進展, 下肢重于上肢, 遠端重于近端。早期以小纖維損害為著, 主要癥狀包括從腳開始出現的疼痛和感覺異常, 多為隱痛、刺痛、灼燒痛, 夜間明顯。后期大纖維損害時出現共濟失調、行走不穩、易跌倒等。部分病程長的糖尿病患者可出現上肢神經局部卡壓病變, 引起肢體麻木疼痛不適, 如一側或雙側腕管綜合征、一側或雙側肘管綜合征等。此外, 糖尿病患者還可能出現肋間神經痛、腰骶神經痛等多種單神經痛。與無痛性周圍神經病變相比, 其更加影響患者的生活質量和身心健康。
典型的糖尿病感覺運動性多神經病累及大小神經纖維, 如果電生理檢查證實存在神經傳導異常, 那么可以明顯提高診斷準確性。但是常規運動或SNCV測定主要反映大的有髓神經纖維變化, 并非診斷痛性周圍神經病的特異手段。學者證實2型糖尿病早期相關周圍神經病主要累及感覺小纖維[5]。小纖維神經病是痛性周圍神經病的一個亞型, 累及直徑較小的神經纖維, 導致疼痛, 因為這些患者在早期大的神經纖維不受累, 所以一般的運動感覺神經傳導檢查無法發現異常, 需皮膚活檢或感覺神經定量檢查明確, 但感覺定量檢查缺乏定位功能, 皮膚活檢屬有創檢查, 不易開展。SSR是人體在接受突然的刺激后, 自主神經出現的反應, 主要是交感神經傳出的纖維沖動所致的汗腺分泌。其中樞段包括下丘腦、腦干、邊緣系統和脊髓中間側柱, 其周圍段包括交感神經節、節前纖維和節后纖維以及皮膚和汗腺。SSR能夠檢測小纖維特別是C 類無髓纖維的電生理特點, 可以客觀評價自主神經系統功能狀態。本研究發現, 糖尿病痛性周圍神經病患者SSR異常率高, 可達81.7%, 可作為糖尿病痛性周圍神經病的常規檢測項目。縱向研究顯示在2型糖尿病早期, 在大的有髓神經纖維異常出現之前就可見 C 類纖維的異常[6, 7]。在疾病早期, H反射異常率較高, 臨床上常常遇到疼痛劇烈、燒灼難耐的患者經NCS、SEP檢測都不能發現神經病變, 此時, SSR及H反射往往有異常發現。
本研究顯示, SSR異常率(81.7%)高于其他檢測, 差異具有統計學意義 (P<0.05), 其次為SNCS(43.3%)、MNCS(35.0%);病程短的患者主要表現為H反射潛伏期的異常;SEP異常率相對低, 多出現在痛性周圍神經病合并有行走不穩的患者;EMG(6.7%)最低, 多出現在伴有疲乏無力的患者。對于病程長的患者, 神經傳導異常率高, 尤其以感覺神經異常率高, 下肢重于上肢, 以軸索損害為著[8]。而SEP異常常出現于伴有步態不穩患者。EMG異常率低, 患者多伴有乏力且運動神經軸索損害重。本研究中還發現, MNCV、SNCV和SSR、SEP、F波、H反射檢測方法對不同的臨床癥狀既有針對性, 又有部分交叉, 如運動神經、感覺神經傳導檢查異常有時疊加了體感誘發電位、SSR、F波、H反射的異常。如果運動神經、感覺神經傳導檢查正常時, SSR檢測更具有針對性。
綜上所述, 在臨床工作中, 醫生要根據糖尿病周圍神經病患者不同的臨床表現, 有目的、有針對性的選擇應用一種或幾種不同的神經電生理檢測技術, 來提高糖尿病痛性周圍神經病診斷的陽性率, 從而全面完整地評價糖尿病引起的痛性周圍神經病。
參考文獻
[1] 林厚維, 丁文龍. 糖尿病性神經病變的機理. 解剖科學進展, 2005, 11(3):244-247.
[2] Lupachyk S, Watcho P, Obrosov AA, et al. Endoplasmic reticulum stress contributes to prediabetic peripheral neuropathy. Exp Neurol, 2013, 247(3):342-348.
[3] Sugimoto K, Yasujima M, Yagihashi S. Role of advanced glycation end products in diabetic neuropathy. Curr Pharm Des, 2008, 14(10): 953-961.
[4] Treede RD, Jensen TS, Campbell JN, et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes. Neurology, 2008, 70(18):1630-1635.
[5] Divisova S, Vlckova E, Hnojcikova M, et al. Prediabetes/early diabetes-associated neuropathy predominantly involves sensory small fibres. J Peripher Nerv Syst, 2012, 17(3):341-530.
[6] Myers MI, Peltier AC, Li J. Evaluating dermal myelinated nerve fibers in skin biopsy. Muscle Nerve, 2013, 47(1):1-11.
[7] Smith AG, Ramachandran P, Tripp S, et al. Epidermal nerve innervation in impaired glucose tolerance and diabetes-associated neuropathy. Neurology, 2001, 57(9):1701-1704.
[8] 黨靜霞. 肌電圖診斷與臨床應用.第2版. 北京:人民衛生出版社, 2013:291-293.
[收稿日期:2016-07-29]

