坐骨神經非凍結性冷損傷時血神經屏障損害的研究
李 浩,張 磊,徐 敏
?
坐骨神經非凍結性冷損傷時血神經屏障損害的研究
李浩1,張磊2,徐敏3
目的使用大鼠坐骨神經制造周圍神經非凍結性冷損傷模型,觀察非凍結性冷損傷時神經內部的水腫變化,研究冷損傷時血神經屏障功能的損害情況及相應的病理改變。方法48只雄性Wistar隨機分成冷損傷后1 d組、3 d組和5 d組。每只大鼠一側坐骨神經予以3 ℃~5 ℃持續低溫2 h;以對側坐骨神經作為對照。每組大鼠在相應的時間點取下坐骨神經進行觀察:靜脈注射伊文思藍后1 h,測量坐骨神經中伊文思藍濃度;靜脈注射伊文思藍后1 h,坐骨神經包埋制片,在熒光顯微鏡下觀察伊文思藍的分布;坐骨神經包埋制片,在光學顯微鏡及電子顯微鏡下觀察有髓纖維、無髓纖維及毛細血管的狀況。結果冷損傷后1 d,多數有髓纖維出現以“空、暗”為形式的軸索退變;無髓纖維和緊密連接完好;神經內膜毛細血管管腔狹窄;冷損傷后3~5 d,有髓纖維病變繼續加重;神經內膜毛細血管管腔仍然狹窄,內皮細胞間的緊密連接開放;冷損傷后1 d,冷損傷側坐骨神經中的伊文思藍濃度與對照側相比有顯著升高;在正常的坐骨神經內,伊文思藍紅色熒光局限于神經內膜的血管腔內,未滲漏至血管外;在冷損傷后1 d,坐骨神經的一些受冷部位出現了神經內膜彌漫性紅色熒光;類似熒光也出現冷損傷后3 d與5 d的坐骨神經中,但是其熒光強度有所下降。結論坐骨神經非凍結性冷損傷可以導致血神經屏障功能破壞,引起神經內膜水腫;非凍結性冷損傷早期主要選擇性損害有髓纖維,而對無髓纖維損傷極輕。
非凍結性冷損傷;血神經屏障;坐骨神經;神經變性
非凍結性冷損傷是指0 ℃以上的低溫潮濕環境所導致的人體組織損傷,如戰壕足、浸潰足等[1]。早在古希臘的希波克拉底時代,就已經存在對非凍結性冷損傷的報道。近代以來,隨著低溫天氣下軍事戰爭的增多,非凍結性冷損傷的報道也逐漸增多,例如兩次世界大戰、朝鮮戰爭等[2~4]。在當今的和平年代,我國某些人群的非凍結性冷損傷發病率仍可高達8.7%[5],如新兵、登山愛好者、大海中的漁民、冬天的酗酒者、癡呆者等。2008年雪災時,非凍結性冷損傷在寧波地區發生率為12.78%,占傷害類型的67.28%[6]。雖然非凍結性冷損傷現象已經存在了很長時間,但它對周圍神經的損傷機制卻依然不清楚,許多領域還有待深入研究。本研究以大鼠坐骨神經內的血神經屏障功能為研究對象,探討非凍結性冷損傷下血神經屏障功能的損害情況。
1 材料與方法
1.1實驗材料體質量300~400 g的3~4月齡SPF級成年雄性Wistar大鼠48只(北京維通利華實驗動物技術有限公司,合格證號:SCXK(京)2002-003),室內飼養溫度25 ℃,相對濕度50%。制冷裝置選擇德國Julabo公司生產的制冷和加熱循環器(F12-ED),測溫裝置選擇優利德專業型數字測溫表(UT325A)。
1.2實驗方法
1.2.1坐骨神經非凍結性冷損傷模型非凍結性冷損傷模型的制作參考賈建平等人[7]的方法:用2%戊巴比妥鈉以0.25 ml/100 g體質量的劑量腹腔麻醉大鼠;麻醉后大鼠俯臥位固定,在其左側大腿根部常規備皮、消毒,于菱形窩處皮膚上作一個3 cm長切口;充分暴露坐骨神經后,將其置于已預冷的實驗裝置(見圖1)中,使神經溫度維持在3 ℃~5 ℃,持續2 h,受冷結束后直接將神經從銅槽中移出。同樣暴露右側坐骨神經,僅給予暴露坐骨神經,不給予低溫處理,作為對照。造模過程中監測大鼠直腸溫度、心率。術中大鼠身下用電熱毯維持肛門溫度在35 ℃以上。術中每20 min記錄一次循環水及神經的溫度。
1.2.2動物分組將48只大鼠隨機分組,冷損傷后1 d組(16只):對大鼠左側坐骨神經手術暴露后進行2 h的持續冷處理(3 ℃~5 ℃),縫合傷口后于室溫下飼養24 h。冷損傷后3 d組(16只):對大鼠左側坐骨神經手術暴露后進行2 h的持續冷處理(3 ℃~5 ℃),縫合傷口后于室溫下飼養72 h。冷損傷后5 d組(16只):對大鼠左側坐骨神經手術暴露后進行2 h的持續冷處理(3 ℃~5 ℃),縫合傷口后于室溫下飼養120 h。對上述3組大鼠右側坐骨神經手術暴露后不給予冷處理,2 h后縫合傷口,于室溫下飼養相應時間作為各組的對照。
1.2.3標本取材、處理在冷損傷后的23 h,給予每組各8只大鼠靜脈注射伊文思藍溶液(1 ml伊文思藍溶液/100 g體質量)。伊文思藍溶液是含有1%伊文思藍的生理鹽水溶液。在注射后1 h,取下每只大鼠雙側坐骨神經,吸去多余水分后稱重。坐骨神經放置于1 ml甲酰胺內50 ℃下孵育24 h。使用分光光度儀(日本島津公司蘇州市分公司生產,型號:UV-1800)對所得到藍色溶液測量伊文思藍吸光度,并根據標準曲線轉換為其濃度,除以神經重量。同樣采用上述實驗方法,每組各4只大鼠的雙側坐骨神經切成5 mm長的數段,包埋于Tissue-Tek Optical Cutting Temperature Compound(美國SAKURA公司生產)中,冷凍于液氮內,儲存于-80 ℃環境下。這些組織使用時制成10 μm 厚的橫切片,經過甘油-生理鹽水封存后在熒光顯微鏡(日本奧林巴斯公司東京生產,型號:CX41-32RFL)下觀察伊文思藍在神經內的分布。在冷損傷后的24 h,每組4只大鼠被麻醉后迅速取下雙側坐骨神經,按以下步驟操作:(1)2%多聚甲醛-2.5%戊二醛中4 ℃固定2 h;(2)0.1 mmol/L磷酸鹽緩沖液(pH值7.4)浸泡3次,每次10 min;(3)四氧化鋨固定,乙醇脫水,環氧樹脂Epon812包埋;(4)制備1 μm半薄切片,甲苯胺藍染色后光學顯微鏡(型號:Eclipse 50i POL;尼康公司,Melville,USA)下觀察;(5)制備5 nm超薄切片,醋酸鈾-枸櫞酸鉛染色后用透射電子顯微鏡(型號:EM208s;荷蘭 Eindhoven市,皇家飛利浦公司)觀察。
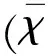
2 實驗結果
2.1各組坐骨神經中伊文思藍的濃度比較將一定量的伊文思藍分別溶解于甲酰胺內,配制成濃度為2 μg/ml、5 μg/ml、8 μg/ml、10 μg/ml、12 μg/ml、25 μg/ml、50 μg/ml的標準溶液,使用分光光度法測定標準溶液的吸光度,繪制出標準曲線,吸光度與濃度呈線性關系(見表1、圖2)。各組坐骨神經放置于甲酰胺內孵育24 h,得到藍色溶液,使用分光光度法測量溶液吸光度,根據標準曲線將吸光度轉換為濃度,并除以神經重量。結果發現:冷損傷后第3天、第5天時低溫側的伊文思藍濃度均顯著低于第1天時,而第1天時低溫側的伊文思藍濃度顯著高于對照側(具體數據見表2)。
2.2各組坐骨神經中伊文思藍的分布靜脈注射伊文思藍1 h 后觀察作為對照的坐骨神經,發現紅色熒光局限于神經內膜的血管腔內,未見有熒光滲漏至血管外。觀察低溫處理的坐骨神經發現:在冷損傷后第1天,大多數坐骨神經的受冷部位出現了神經內膜彌漫性紅色熒光,但也有一些受冷部位始終未見熒光滲漏。類似的彌漫性熒光也出現冷損傷后第3天,第5天的坐骨神經中,但是其熒光強度明顯下降(見圖3)。
2.3各組大鼠坐骨神經光學顯微鏡下的形態比較對照側坐骨神經僅少量有髓纖維出現空或暗軸索,伴隨正常的神經內膜毛細血管。低溫處理后1 d,許多有髓纖維出現以巨大、空或萎縮、暗為形式的軸索退變。由于內皮細胞腫脹,神經內膜毛細血管管腔狹窄。低溫處理后3~5 d時有髓纖維顯示出更加嚴重的以“空或萎縮、暗”為形式的軸索退變,并且神經內膜毛細血管管腔仍然狹窄(見圖4)。
2.4各組大鼠坐骨神經電子顯微鏡下的形態比較對照側1 d時僅少量有髓纖維輕微板層松散,無髓纖維與神經內膜血管基本正常。低溫處理后1 d時,坐骨神經的有髓纖維已經出現嚴重病變,表現為:髓鞘板層結構松散,乃至于結構完全消失;軸索輕則微絲溶解,重則結構消失,表現為“空軸索”。無髓纖維基本正常。神經內膜血管管腔狹窄,血管內皮細胞增生,但緊密連接未見破壞,血管內未見血小板激活與紅細胞淤滯。低溫處理后3~5 d時,大鼠坐骨神經中有髓纖維出現更加明顯的軸索退變和髓鞘分裂。內皮細胞仍然腫脹,緊密連接出現開放。直到第5天時才能發現散亂的無髓纖維退變(見圖5)。

表1 伊文思藍在甲酰胺中的吸光度-濃度標準曲線
r=0.999

表2 各組坐骨神經中伊文思藍的濃度比較
與冷損傷后1 d相同側比較*P<0.05;同一組內與對照側比較#P<0.05
圖1實驗裝置的設計[7]致冷管道(自制)由銅管組成,表面覆蓋環氧樹脂,做成一個中空的半圓形。在入水口和出水口之間有15 mm的間距。通過加熱制冷循環器(型號:F12-ED;德國Julabo公司)驅動,使冷水不斷循環通過管道,從而冷卻坐骨神經。在銅管底部和神經之上可放置測溫裝置,用于測定制冷溫度和神經實際溫度,兩點間溫差不超過0.2 ℃

圖2伊文思藍在甲酰胺中的吸光度-濃度標準曲線
3 討 論
在中樞神經系統內,血腦屏障使腦組織和血液隔絕,并對血液和腦組織之間的多種物質交換進行調控。當機體受到寒冷損傷時,由于氧化損傷導致血腦屏障通透性增加,血管內液體滲出,可以引起繼發性腦水腫[8]。在周圍神經系統內,神經組織的內環境也由相似的屏障進行維持,該屏障即稱為血神經屏障,它主要由神經內膜微血管上皮細胞和神經束膜鞘構成[9]。它對許多物質都具有低通透性,可以阻止一些溶質、大分子物質、白細胞及細菌通過被動擴散方式進入周圍神經組織,從而將周圍神經與血液系統分隔,起到一種保護作用[10]。同時,它通過一些轉運蛋白調節某些離子、營養物質及其他外源性物質出入神經組織,并通過維持鈉、鉀離子濃度的梯度差,調節軸索去極-復極化過程,保證神經信號正常傳導[10~12]。在大部分周圍神經疾病中,如熱損傷、糖尿病、神經壓榨傷,人們都發現了血神經屏障的破壞[13,14]。同樣地,在非凍結性冷損傷中也存在血神經屏障的破壞。
人們通過對動物靜脈注射多種示蹤劑,并對示蹤劑所浸潤的組織進行化學固定來觀察血-神經屏障的完整性變化。熒光類示蹤劑如臺盼藍、熒光素鈉及伊文思藍等,已經被廣泛應用于此類研究。我們的研究使用了一種分子量為66200 Da的熒光示蹤劑-伊文思藍。該物質可以在特殊顯微鏡下發出高亮度的紅色熒光。在其630 nm的最大吸收值時,通過比色法可以由吸光度算出它的濃度。Olsson[15]發現在正常情況下,神經內膜血管對伊文思藍不具備通透性。但是,當神經發生損傷,如壓榨傷或切割傷時,神經內膜血管對它的通透性會增大,該物質就可以通過損傷部位的細胞間隙滲漏出去,這種現象反映了血神經屏障完整性的損害。目前,伊文思藍已經被廣泛應用于周圍神經熱損傷后屏障功能破壞的研究[16~18],卻沒有用于研究周圍神經非凍結性冷損傷后屏障功能的破壞。因此,我們采用靜脈注射伊文思藍來觀察非凍結性冷損傷時坐骨神經屏障功能的損害。
研究發現冷損傷后1 d時,坐骨神經某些經過低溫處理的節段出現神經內膜彌漫性高亮度紅色熒光。直到冷損傷后3~5 d時,這種紅色熒光依然存在。它提示由于血神經屏障功能的損傷,冷損傷后1 d時神經內膜血管的通透性明顯增加,伊文思藍隨著液體從血管內大量滲出至神經內膜中。而電鏡發現冷損傷后3 d時,神經內膜中的血管內皮細胞間緊密連接出現開放的現象也支持血-神經屏障功能存在損傷。此外,在大型有髓纖維軸索嚴重退變時,無髓纖維較好地得到了保存,提示非凍結性冷損傷主要選擇性破壞有髓纖維。
周圍神經的冷損傷改變了神經內膜中的血管通透性,損傷了血神經屏障,導致液體滲入神經內膜,破壞其微環境,引起神經內膜水腫。這些過多的液體將會進一步擠壓周圍的神經束膜,使其超出正常調節范圍,造成神經內膜壓力的迅速上升[19],破壞內部的神經纖維。此外,神經內膜水腫也會進一步降低內部的血流量,加重神經內膜缺氧,繼續破壞血神經屏障功能。但是,血神經屏障功能的損傷并非是一個簡單過程,而是涉及了兩個階段:早期階段中(冷損傷后24 h)主要由內皮細胞中的吞飲小泡轉運有害物質,而后期階段(冷損傷后3~5 d)則是有害物質通過損傷的血管內皮細胞間隙滲透進入神經內膜[20]。這就可以解釋為什么第1天時已經存在液體滲出至神經內膜,電鏡卻沒有發現內皮細胞緊密連接的開放,直到冷損傷后第3天才發現緊密連接的開放。同時發現當神經內的血流量逐漸恢復到基線狀態時[7,21,22],第3天~第5天時的伊文思藍滲出量卻比第1天時明顯減少,原因不是很清楚,我們認為可能是由于神經內膜中的液體壓力升高,阻止了液體從微血管繼續滲出至神經內膜[19]。
與我們的研究發現類似,在許多實驗性周圍神經疾病中也存在神經內膜血管通透性改變,但是具體過程仍然不清楚。Olsson[23,24]曾指出這種血管通透性的異常可能是由于神經內膜中的肥大細胞脫顆粒釋放的血管活性胺引起。因此,冷損傷時血神經屏障的通透性增高也可能是由于血管活性胺的釋放。但是,由于實驗條件的限制,我們沒有進行對血管活性胺的釋放進行觀察,這是需要繼續深入研究的領域。
[1]Loseth S,Bagenholm A,Torbergsen T,et al.Peripheral neuropathy caused by severe hypothermia[J].Clinical Neurophysiology,2013,124(5):1019-1024.
[2]Smith JL,Ritchie J,Dawson J.Clinical and experimental observations on the pathology of trench frostbite[J].J Path Bact,1915,20:159-190.
[3]Ungley CC,Blackwood W.Peripheral vasoneuropathy after chilling “immersion foot and immersion hand”[J].Lancet,1942,2:447-451.
[4]Lewis RB,Moen PW.Experimental immersion leg[J].Am J Med Sci,1952,224:529-539.
[5]宋波,張涌泉.北方海島部隊新兵訓練凍傷情況分析[J].白求恩軍醫學院學報,2008,6(6):363-364.
[6]應焱燕,朱銀潮,徐榮,等.2008年寧波地區雨雪冰凍災害所致傷害的流行病學調查[J].衛生研究,2009,38(4):463-464.
[7]Jia J,Pollock M.The pathogenesis of non-freezing cold nerve injury.Observations in the rat[J].Brain,1997,120(4):631-646.
[8]張鍇,李積勝.寒冷環境對機體的影響及其機制[J].國外醫學:衛生學分冊,2006,33(4):212-215.
[9]Choi YK,Kim KW.Blood-neural barrier:its diversity and coordinated cell-to-cell communication[J].BMB Rep,2008,41:345-352.
[10]Yosef N,Ubogu E.An immortalized human blood-nerve barrier endothelial cell line for in vitro permeability studies[J].Cell Mol Neurobiol,2013,33:175-186.
[11]Ubogu EE.The molecular and biophysical characterization of the human blood-nerve barrier:current concepts[J].J Vasc Res,2013,50:289-303.
[12]Kusunoki S.How is the blood-nerve barrier involved in the pathogenetic mechanisms of multifocal motor neuropathy[J].J Neurol Neurosurg Psychiatry,2014,85:473.
[13]Dyck PJ,Giannini C.Pathologic alterations in the diabetic neuropathies of humans:a review[J].J Neuropathol Exp Neurol,1996,55:1181-1193.
[14]Omura K,Ohbayashi M.The recovery of blood-nerve barrier in crush nerve injury-a quantitative analysis utilizing immunohistochemistry[J].Brain Res,2004,1001:13-21.
[15]Olsson Y.Microenvironment of the peripheral nervous system under normal and pathological conditions[J].Crit Rev Neurobiol,1990,5:265-311.
[16]Kiang JG,Wei ET.Corticotropin-releasing factor inhibits thermal injury[J].J Pharmacol Exp Ther,1987,243:517-520.
[17]Berger J,Sprague SM,Wu Y,et al.Peripheral thermal injury causes early blood-brain barrier dysfunction and matrix metalloproteinase expression in rat[J].Neurol Res,2007,29:610-614.
[18]Patel TH,Sprague S,Lai Q,et al.Blood brain barrier (BBB) dysfunction associated with increased expression of tissue and urokinase plasminogen activators following peripheral thermal injury[J].Neurosci Lett,2008,444:222-226.
[19]Myers RR,Powell HC,Heckman HM.Biophysical and pathological effects of cryogenic nerve lesion[J].Ann Neurol,1981,10:478-485.
[20]Nukada H,Pollock M,Allpress S.Experimental cold injury to peripheral nerve[J].Brain,1981,104:779-811.
[21]Jia J,Pollock M,Jia J.Cold injury to nerves is not due to ischaemia alone[J].Brain,1998,121:989-1001.
[22]Jia J,Pollock M.Cold nerve injury is enhanced by intermittent cooling[J].Muscle Nerve,1999,22:1644-1652.
[23]Olsson Y.Studies on vascular permeability in peripheral nerves 2 Distribution of circulating fluorescent serum albumin in rat sciatic nerve after local injection of 5-hydroxytryptamine,histamine and Compound 48/80[J].Acta Physiol Scand,1966,42:284.
[24]Olsson Y.Mast cells in the nervous system[J].Int Rev Cytol,1968,24:27-70.

A.在對照側,紅色熒光局限于血管腔內,神經內膜中未見熒光外漏出血管;B.冷損傷后1 d 坐骨神經內膜可見彌漫紅色熒光;C.冷損傷后3 d,在大鼠坐骨神經受冷段可見神經內膜紅色熒光減少;D.冷損傷后5 d,在大鼠坐骨神經受冷段可見神經內膜紅色熒光減少
圖3冷損傷后坐骨神經內伊文思藍的分布變化 (伊文思藍染色,×40)
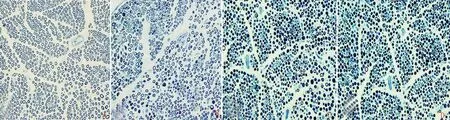
A.對照側坐骨神經;B.低溫組冷損傷后1 d,神經軸索出現以“暗、空”為主要表現的退變,并出現血管管腔狹窄和內皮細胞腫脹;C.冷損傷后3 d,大鼠坐骨神經中出現更多的神經軸索出現嚴重的暗退變;D.冷損傷后5 d大鼠坐骨神經出現退變軸索
圖4坐骨神經非凍結性冷損傷光學顯微鏡下所見圖像(甲苯胺藍染色,×400)

A.對照側神經內膜血管內皮細胞大致正常(×13000);B.低溫后1 d時低溫組神經內膜血管管腔狹窄,內皮細胞增生(×10000);C.低溫后3 d時低溫組神經內膜血管管腔狹窄,內皮細胞增生(×10000);D.低溫后5 d時低溫組神經內膜血管管腔狹窄,內皮細胞增生(×10000)
圖5坐骨神經非凍結性冷損傷電子顯微鏡下所見圖像(醋酸鈾-枸櫞酸鉛染色)
The study of blood-nerve barriers in non-freezing cold injury of the sciatic nerves
LIHao,ZHANGLei,XUMin.
(DepartmentofNeurology,TheFirstPeople’sHospitalofYibin,Yibin644000,China)
ObjectiveTo make the model of non-freezing cold injury in peripheral nerves,observe edema in endoneurium in non-freezing cold injury,and study the effect of barrier function and corresponding pathological changes.MethodsMale Wistar rats were randomly divided into the 1st group,3rd group and 5th group.One side of sciatic nerves wastreated at 3 ℃ ~5 ℃ for 2 hours,the other side was as control.The bilateral sciatic nerves of each group were harvested on the 1st,3rd and 5th day after cooling.The structure of nerves and blood-nerve barrier were examined.ResultsOn the 1st day,most of the myelinated fibres in sciatic nerves showed “empty or dark” axons,with normal unmyelinated fibres and tight junction.Endoneurial capillary lumen was seriously narrowed.From the 3rd day to 5th day,myelinated fibre degeneration became more widespread and unmyelinated fibres also began to degenerate.The vasculature was similar to that of the 1st day,with tight junction open.There was significant difference between the cooled group and control group in the 1st day.Normal rat sciatic nerve showed a bright red fluorescence confined to the lumen of endoneurial blood vessels and none appeared outside the vascular walls.The segments at the cooling sites of sciatic nerves were examined on 1st day after the cooled injury,the sciatic nerve showed intense red fluorescence in endoneurium,outside the vascular.On the 3rd and 5th day after nerve cooled,the red fluorescence was also seen,but the intensity decreased.ConclusionNon-freezing cold injury to rat sciatic nerve could resulted in breakdown of the blood-nerve barrier function,causing endoneurial edema.Myelinated fibers were mainly selectively damaged,but unmyelinated fibers were preserved.
Non-freezing cold injury;Blood-nerve barrier;Sciatic nerve;Nerve degeneration
1003-2754(2016)02-0104-05
2015-12-16;
2016-01-29
四川省醫學會“施慧達”課題(SHD12-21)
(1.宜賓市第一人民醫院神經內科,四川 宜賓 644000;2.宜賓市第一人民醫院藥劑科,四川 宜賓 644000;3.首都醫科大學宣武醫院神經內科,北京 100053)
李浩,E-mail:lihao119@sohu.com
R745
A

