內鏡黏膜下剝離術治療直腸累及齒狀線的側向發育型腫瘤療效分析
王洪波 徐明垚 陳清波 郭銀 潘夏
鐘漓 趙志 朱小寶 冉福林 陳霄
?
內鏡黏膜下剝離術治療直腸累及齒狀線的側向發育型腫瘤療效分析
王洪波徐明垚陳清波郭銀潘夏
目的 探討直腸累及齒狀線的側向發育型腫瘤(laterally spreading tumor,LST)的特點,評估內鏡下黏膜剝離術(endoscopic submucosal dissection,ESD)治療直腸累及齒狀線LST的療效及安全性。方法 收集2012年10月至2014年10月湖北省腫瘤醫院內鏡科采用ESD術治療的45例直腸累及齒狀線的LST的臨床資料,回顧性分析病變類型、大小、手術時間、一次性完整切除率、并發癥的發生、病理診斷、隨訪情況等。結果 45例直腸累及齒狀線的LST,腫瘤直徑12 mm~66 mm,平均28±15 mm,45例(100%)均一次性完整切除,ESD手時間45 min~240 min,平均100±25 min。遲發性出血6例,發生率13.3%(6/45),均行內鏡下止血成功,發生術中穿孔2例,發生率4.4%(2/45),經止血夾夾閉創面后內科治療后痊愈。術后病理診斷低級別上皮內瘤變37例,高級別上皮內瘤變8例,病變均局限于黏膜層。45例患者平均隨訪時間30.2個月(10~46個月),所有患者均無腫瘤復發或殘留,術后排便功能正常。結論 ESD治療直腸累及齒狀線的LST切除徹底,安全性好,復發率低,對肛管排便功能無明顯影響。
直腸腫瘤; 直腸鏡檢查; 側向發育型腫瘤(LST); 內鏡下黏膜剝離術(ESD)
大腸側向發育型腫瘤(laterlly spreading tumor,LST)為直徑>10 mm,呈側向而不是垂直生長的腫瘤性病變,最早由日本學者Kudo[1]提出,其特點是沿腸壁表淺黏膜側向擴展,較少侵襲腸壁深層,由于普通內鏡不易發現,而癌變率高,因此有必要對其進行深入研究。隨著色素染色聯合放大內鏡或內鏡窄帶成像技術(narrow band imaging,NBI)結合放大內鏡(NBI-ME)的運用,LST的檢出率逐步提高[2],ESD技術的日趨成熟,LST的治療取得巨大進展,但是對于累及肛管齒狀線的LST,ESD切除仍然比較困難[3],湖北省腫瘤醫院內鏡科近年來采用ESD術治療直腸累及齒狀線的LST患者45例,療效較好,現將結果報道如下。
資料與方法
一、一般資料
2012年10月至2014年10月,收集湖北省腫瘤醫院內鏡科行ESD治療的直腸累及齒狀線的LST患者45例,其中男性29例,女性16例;最大年齡85歲,最小年齡22歲,平均年齡68歲;12例患者為外科局部切除術后殘留或者復發病例;腫瘤直徑為12 mm~66 mm。
二、器械與設備
Olympus CV-260SL具備NBI及高清放大功能主機;Olympus EU-ME1內鏡超聲系統;Olympus CF-Q260及CF-H260腸鏡;CO2氣泵;ERBE ICC200D高頻電切裝置及APC 300氬離子凝固器;Olympus NM-4L-1注射針、KD-620LR刀(Hook knife)、KD-612U刀(ITknife nano)、KD-650Q刀(Dual knife)、FD-1U-1熱活檢鉗;Olympus HX-110UR型及HX-110QR型夾子裝置本體,HX-600-135止血鈦夾,Olympus SD-221U-25型圈套器;透明帽型號為D-201-13404。黏膜下注射液體為1 ml腎上腺素+2 ml靛胭脂+100 ml生理鹽水混合液,并于肛側注射時另外加入2%利多卡因10 ml。
三、方法
(一)術前鏡下診斷
經普通內鏡常規檢查發現的直腸累及齒狀線的LST病例,均需通過NBI或色素內鏡評估范圍,并結合放大內鏡進行分型:顆粒型(LST-granular type,LST-G)和非顆粒型(LST-nongranular type,LST-NG)。術前尚需行超聲內鏡(EUS)檢查,初步判斷病灶起源層次,為ESD術做好準備。排除標準:(1)放大染色腸鏡下觀察黏膜pit分型為V型(不規則的VA型或無結構的VN型);(2)病灶未做過活檢或治療,而抬舉征陰性者;(3)術前超聲內鏡或盆前CT明確提示病灶侵犯黏膜深層或腸外,以及淋巴結有明確轉移者。
(二)術前準備
完善血液、心電圖、腹盆腔CT等相關檢查排除手術禁忌,口服抗凝藥患者需停藥一周以上,告知手術方式及風險,簽署特殊治療知情同意書。術前一天禁食,當夜口服蓖麻油30 ml,手術當天口服聚乙二醇電解質散劑兩包+2000 ml水,至排出清水樣便。術前15 min山莨菪堿10 mg及地西泮10 mg肌注。
(三)ESD手術過程
NBI及染色放大內鏡確定病灶范圍,Dual knife標記范圍,黏膜下注射含有腎上腺素及靛胭脂的生理鹽水,使病變明顯抬舉,病灶肛側于齒狀線周邊注射時,每100 ml混合液需另加入2%利多卡因注射液10 ml。距標記點外側5 mm處以Dual knife插入黏膜下,緩慢切開黏膜,顯露黏膜下層,以Hook knife及IT knife nano分離黏膜下層,術中遇細小血管以切開刀直接電凝止血,較粗血管以止血鉗電凝夾閉血管,近肛管處由于操作空間有限,止血夾使用比較困難,所以術中徹底而有效的止血非常重要,齒狀線周邊黏膜下血管網豐富,需采用以凝代切的方法剝離,盡量減少術中出血。術中為使病灶位于重力上方,可適當變換體位,盡量顯露黏膜下層,便于直視下剝離。剝離病灶口側時,可采用倒鏡方式進行,必要時可選取治療胃鏡(GIF-Q260J)進行手術。對于外科手術后復發病例,因手術后病灶局部形成疤痕,分離黏膜與黏膜下層比較困難,可用Hook knife勾住黏膜下組織,挑起后切除。病灶完整剝離后,需仔細檢查創面,及時電凝夾閉顯露血管,預防出血。為防止創面感染,影響愈合,術畢退鏡時盡量將腸腔殘留糞水及氣體抽吸干凈,并給與復方角菜酸酯栓1枚塞肛保護創面。
(四)標本處理及評估
術后標本固定于平板上,測量標本大小后送病理檢查。病理標本以2 mm間隔連續切片,每個切片結果包括標本基底和周邊切緣是否有腫瘤累及,是否有血管及淋巴管浸潤。整塊切除指內鏡下完整切除病灶,標本連續無破損;完整切除指整塊切除的病變標本基底和周邊切緣無腫瘤累及;完整治愈切除指完整切除的標本無血管及淋巴管浸潤。
(五)術后處理及隨訪
術后患者行止血、補液、抗炎等治療3 d~5 d,觀察有無腹痛、便血、皮下氣腫等癥狀,術后禁食水1 d,若無消化道穿孔及出血癥狀,第2 d即可行全流飲食,第3 d后可進無渣飲食,2周內避免劇烈活動,必須保持大便通暢,若有便秘及時行灌腸通便。術后1、3、6、12月復查腸鏡,觀察病變部位是否愈合,有無腫瘤殘留或復發,直腸及肛管創面有無狹窄。
結 果
一、內鏡下分型及術后病理結果
全部45例直腸LST累及齒狀線患者,LST-G 17例,其中顆粒均一型7例,結節混合型10例;LST-NG 28例,其中扁平隆起型26例,假凹陷2例;直徑最大為42 mm×66 mm,最小為12 mm×18 mm,平均(28±15)mm。NBI放大染色鏡下觀察腺管開口形態,以Ⅳ型及IIIL型為主,其中Ⅳ型28例,IIIL型12例,Ⅱ型5例。病灶內鏡下分型及病理結果見表1。
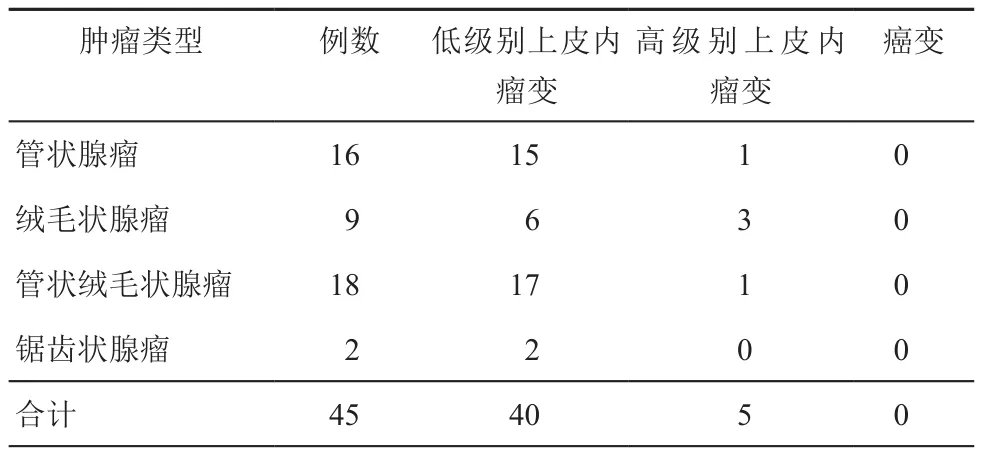
表1 45例累及齒狀線的大腸側向發育型腫瘤術后病理情況
二、ESD手術情況
45例直腸累及齒狀線的LST患者均順利完成ESD術,且均為整塊切除,術后病理診斷證實45例標本周邊及基底部切緣均為陰性,無淋巴血管侵犯,達到完整治愈性切除。手術時間45 min~240 min,平均(100±25)min,其中1例患者病灶幾乎為全周型,術中剝離困難,耗時240 min。術中病灶剝離時均有少量出血,最多約100 ml,均行電凝止血成功,發生遲發性出血6例,發生率13.3%(6/45),4例為術后24小時內出血,2例為術后一周內出血,均在內鏡下電凝止血成功。發生術中穿孔2例,發生率4.4%(2/45),經止血夾夾閉創面后未出現明顯癥狀,術后常規處理后痊愈,無需行外科手術治療。6例患者為近環周型病變,為預防狹窄,術后第2周即行球囊擴張,后每周擴張一次,共四次后停止。
三、術后隨訪結果
45例患者均納入隨訪,平均隨訪時間30.2個月(10~46個月),所有患者均無復發,臨床癥狀完全消失,創面疤痕愈合,無腫瘤復發。6例行擴張術后患者腸鏡復查提示病灶處腸腔輕度狹窄,排便通暢。
討 論
大腸側向發育型腫瘤(LST)是一類較為特殊的大腸腫瘤性病變,以側向生長為特征,其沿大腸黏膜淺表側向擴展而較少侵襲腸壁深層,病理類型以絨毛狀腺瘤為主,少數為管狀腺瘤,常伴高級別上皮內瘤變或癌變[4]。Kim等[5]報道LST顆粒型以結節混合型為主,非顆粒型以扁平隆起型為主,與本組結果基本一致。約30%的LST為高級別上皮內瘤變或癌變,在大腸癌的發生中具有重要意義[6],Kudo等[7]報道結直腸LST總惡變率為8.4%~52.5%,可在3年內發展為進展期癌,由此可見LST惡變率較一般隆起型病變高,應及早發現及治療。LST為平坦性病變,普通內鏡難以發現,色素染色內鏡或NBI結合放大內鏡是診斷LST的重要方法[8-9]。普通內鏡檢查發現大腸黏膜不平展、色澤變紅或變白、表面粗糙、血管網中斷等可疑征象時,需及時行色素染色或NBI結合放大內鏡檢查進行診斷,并通過放大內鏡對大腸腺管開口形態進行pit分型,可大致判斷病理類型及病變侵犯的深度[10]。LST分型中假凹陷型較為少見,其形態更加隱蔽,而該型發生黏膜下癌變比例較高,尤其應足夠重視。本組比例中假凹陷型2例(4.4%),術后病理結果均為絨毛狀腺瘤合并局部高級別上皮內瘤變。
隨著ESD技術的成熟,其已成為LST首選治療手段,尤其是巨大的LST更應行ESD術切除[6,11],由于ESD術僅能切除病灶及周邊部位的黏膜層、黏膜肌層及黏膜下層,并且侵犯至黏膜下層的病變有脈管和淋巴結轉移的可能,所以術前對浸潤深度的判斷尤其重要。色素染色放大內鏡pit分型為V型提示為黏膜下癌,抬舉征陰性也表明病灶可能侵犯至黏膜下層或固有肌層[12],不宜行ESD術切除,應及時外科手術治療。超聲內鏡(endoscopic ultrasonography,EUS)對于病變侵犯深度的判斷特異性只有14.3%[13],只能作為術前判斷的參考因素。本組患者術前經過pit分型及抬舉征陽性判斷侵犯深度,與術后病理結果一致。
直腸累及齒狀線的LST,多無明顯臨床癥狀,而出現癥狀者多為便血,往往被誤診為痔瘡而沒有得到及時治療。本組45例患者中有15例首次診斷為痔瘡,均行數月痔瘡治療后無好轉,腸鏡檢查診斷為LST。所以對于便血患者,因直腸指診對LST的敏感度不高,必須行腸鏡檢查,以免誤診。直腸累及齒狀線的LST行外科手術治療可能會損傷直腸括約肌,影響肛門功能,降低患者術后生活質量。本組患者中有12例為外科局部切除術后殘留或復發,可能因外科手術時對LST的邊界無法準確判斷造成。ESD術為微創治療,操作精細,一般不會損傷深層肌肉,結合色素染色及NBI放大內鏡,能準確判斷病灶邊界,對于直腸累及齒狀線的LST治療有明顯優勢。本組45例患者經ESD術切除后隨訪10~46個月,均未出現殘留或復發,肛門排便功能正常。
直腸累及齒狀線的LST行ESD術切除時,因手術操作空間局限,且直腸肛管有豐富的靜脈叢及感覺神經,完整切除難度較大。本組45例患者均完成治愈性切除,未出現嚴重并發癥,除了由熟練醫師按照ESD術標準程序操作以外,尚有以下幾點需注意:1.直腸及肛管血供豐富,腫瘤滋養血管較多,一旦出血往往不宜止血,且該處空間局限,鈦夾使用困難,因此需行預防性止血,止血滿意后再行剝離,盡量避免邊剝離邊出血的情況發生。對于黏膜下層較小的血管可用切開刀刀頭直接電凝止血,粗大血管需行止血鉗鉗夾后遠離腸壁行電凝止血,對于血管網豐富的區域尚可選用以凝代切的方式進行剝離。術中黏膜下注射要充分,必要時需反復行黏膜下注射,使手術視野暴露完全,便于發現粗大滋養血管,提前進行電凝止血。本組患者術中均未出現較多出血,而6例術后出血,考慮可能與病灶處由直腸下動脈及肛周動脈雙重供血有關;2.對于剝離順序,考慮到肛管處空間最為局限,而直腸處空間較寬大,因此先從肛側局部切開剝離,再行口側切開剝離,最后再剝離病灶兩側黏膜,術中通過變換體位,使病灶位于重力上方,利于黏膜下層的暴露,剝離口側時如倒鏡困難,可選用胃鏡進行手術;3.肛管有豐富神經叢,術中行肛側黏膜下注射時,混合液中需加入2%利多卡因,避免患者疼痛影響手術;4.對于外科手術后殘留或者復發的病灶,接近疤痕處局部抬舉征為陰性,可選用Hook knife或Dual knife挑起粘連的黏膜下層進行剝離,避免損傷深層組織,防止穿孔;5.術后創面鈦夾縫合困難,且縫合后腸腔易變形狹窄,為避免術后狹窄,不宜縫合創面,可予以復方角菜酸酯栓1枚塞肛進行保護,對于超過腸腔1/2周的病變,術后兩周需行球囊擴張術以預防腸腔狹窄的發生;6.ESD的手術并發癥之一為腸腔穿孔,剝離時充分的黏膜下注射,對手術層次的清晰掌握,操作時需小心謹慎,均可避免穿孔的發生;7.術中盡量少注氣注水,術后退鏡前盡量將腸道殘留氣體及液體抽吸干凈,CO2注氣設備可減少ESD所造成的腹脹、腹痛和穿孔的發生[14],本組使用CO2注氣設備患者腹脹、腹痛發生率明顯低于未使用該設備患者,與文獻報道一致。
直腸累及肛管齒狀線的側向發育型腫瘤LST,外科手術治療往往會影響肛門功能,并且術后易殘留、復發,隨著ESD技術的成熟,內鏡下切除直腸累及齒狀線的LST已得到運用。本研究顯示,ESD術前行色素內鏡或NBI染色放大內鏡確定病變范圍,根據pit分型及超聲內鏡、黏膜下注射結果,正確評估病變的組織學類型及黏膜下侵犯深度,有利于完整切除病變部位,減少殘留、復發,并保障肛門功能。術中局部麻醉藥物的使用及對止血的特別重視,使手術安全、有效,減輕患者痛苦。ESD術對于直腸累及齒狀線的LST,具有較好療效,值得推廣。
[1]Kudo S.Endoscopic mucosal resection of liat and depressed types of early colorectal cancer[J].Endoscopy,1993,25(7):455-461.
[2]Matsude T,Saito Y,Hotta K,et al.Prevalence and clinicopathological features of nonpolypoid colorectal neoplasms:should we pay more attention to identifying flat and depressed lesions ?[J].Dig Endosc,2010,22 (suppl s1):S57-S62.
[3]Kenichiro I,Kinichi H,Yuichiro Y,et al.Safety and efficacy of endoscopic submucosal dissection of rectal tumors extending to the dentate line[J].Endoscopy,2015,47(6):529-532.
[4]Kusaka T,Fukui H,Sano Y,et al.Analysis of K-ras codon 12 mutations and p53 overexpression in colorectal nodule-aggregating tumors[J].J Gastroenterol Hepatol,2010,15(10):1151-1157.
[5]Kim BC,Chang HJ,Han KS,et al.Clinicopathological differences of laterally spreading tumors of the colorectum according to gross appearance[J].Endoscopy,2011,43(2):100-107.
[6]Terasaki M,Tanaka S,Oka S,et al.Clinical outcomes of endoscopicsubmucosal dissection and endoscopic mucosal resection for laterally spreading tumors larger than 20 mm[J].J Gastroenterol Hepatol,2012,27(4):734-740.
[7]Kudo S,Lambert R,Allen JI,et al.Nonpolypoid neoplastic lesions of the colorectal mucosa[J].Gastmintest Endosc,2008,68(4 Suppl):S3-S47.
[8]姜泊,劉思德,智發朝,等.染色內鏡和放大內鏡診治大腸側向發育型腫瘤[J].中華消化內鏡雜志,2003,20(1):9-12.
[9]柳娟,劉宇虎,吳清時,等.染色內鏡及放大內鏡在大腸側向發育型腫瘤診治中的價值[J].實用預防醫學,2009,16(3):646-648.
[10]Liu HH,Kudo SE,Juch JP.Pit pattern analysis by magnifying chromoendoscopy for the diagnosis of colorectal polyps[J].J Formos Med Assoc,2003,102(3):178-182.
[11]Kaku E,Oda Y,Murakami Y,et al.Proportion of flat-and depressed-type and laterally spreading tumor among advanced colorectal neoplasia[J].Clin Gastroenterol Hepatol,2011,9(6):503-508.
[12]Tamegai Y,Saito Y,Masaki N,et al.Endoscopic submucosal dissecting:a safe technique for colorectal tumors[J].Endoscopy,2007,39(5):418-422.
[13]Tanabe R,Higaki S,Gondo T,et al.Preoperative Evaluation of Early Colorectal Cancer Using an Ultrasound Mini Probe[J].Hepatogastroenterology,2011,14(59):118-119.
[14]Saito Y,Uraoka T,Matsuda T,et al.A pilot study to assess the safety and efficacy of carbon dioxide insufflation during colorectal endoscopic submucosal dissection with the patient under conscious sedation[J].Gastrointest Endosc,2007,65(3):537-542.
(本文編輯:楊明)
王洪波,徐明垚,陳清波,等.內鏡黏膜下剝離術治療直腸累及齒狀線的側向發育型腫瘤療效分析[J/CD].中華結直腸疾病電子雜志,2016,5(5):419-423.
腹腔內注射貝伐珠單抗治療結直腸癌患者惡性腹腔積液的療效和安全性評價
鐘漓趙志朱小寶冉福林陳霄
【摘要】目的探討腹腔內注射貝伐珠單抗治療惡性腹腔積液的近期療效及安全性;方法收集46例桂林醫學院附屬醫院胃腸外科2010年3月至2014年5月伴有難以控制的惡性腹腔積液的晚期結直腸癌患者。檢測其腹腔積液中VEGF含量;并利用單因素生存分析對比兩組患者的預后。結果對照組的血清VEGF平均值為(671.8±499.15)pg/mL,與治療組[平均值為(665.19.19±499.15)pg/mL]相比差異無統計學意義。治療組中,治療前腹腔積液VEGF量的平均值為(1 225.11±609.71)pg/mL,無穿刺中位生存時間為6個月(1~21個月)。與對照組相比,治療組的穿刺引流時間明顯延長(t值=6.328,P<0.05)。治療后,腹腔積液的VEGF量(317.69±172.14)pg/mL,與治療前相比差異存在統計學意義。治療后的血清VEGF平均值為(170.61±115.92)pg/mL,與治療前差異具有統計學意義。在生存分析中,治療組的預后明顯好于對照組(P<0.05)。結論對于一部分合適的患者,腹腔內注射貝伐珠單抗對于惡性腹腔積液的治療可能是一種有效地、安全的治療手段。
【關鍵詞】結直腸腫瘤;治療;抗VEGF;貝伐珠單抗;惡性腹水
Corresponding author: Zhong Li,E-mail: zhongli0302@163.com
【Abstract】Objective To investigate the short-term effect and safety of anti-malignant ascites treated with intraperitoneal injection of bevacizumab.Methods 46 colorectal cancer patients with uncontrolled malignant ascites at the Affiliated Hospital of Guilin Medical College from 2010 to 2014 were enrolled in this study.Investigate the VEGF value of malignant ascites and analyze the survival time of two groups.Results The mean VEGF value of control group is 671.8±499.15 pg/mL,and has not statistically significant than treatment group (mean value:1225.11±609.71 pg/mL).In treat group,the mean VEGF value is 1225.11±609.71 pg/mL before treatment.The median survival time of non-paracentesis is 6 months(1~21 months).In contrast with control group,the time of non-paracentesis is significantly longer in treatment group (6.328,P<0.05).After treatment,the mean VEGF value is 317.69±172.14 pg/mL in treatment group.There is statistically significant than control group.In survival analysis,treatment group shows significantly better overall survival (OS) (P<0.05).Conclusion For a part of appropriate patients,treated with intraperitoneal injection of bevacizumab is an effective and safety method.
【Key words】Colorectal neoplasm;Therapy;Anti-VEGF;Bevacizumab;Malignant ascites
在美國,結直腸癌在腫瘤的發病率和死亡率中都占據著第三位[1]。據估計,每年都有142 820例新增患者并有50 830例患者死于結直腸癌。在過去的十年,結直腸癌的死亡率下降了3%,但是仍有30%~40%的結直腸癌患者出現肝轉移,并有半數左右的患者死于腫瘤的復發[2]。
惡性腹水是指由于惡性腫瘤所導致的胸腔、腹腔壁層胸腹膜所發生的彌漫性病變而導致體腔液體異常增多的現象。惡性胸腹水是癌癥晚期的并發癥之一,常伴隨著一系列的復雜的臨床問題,并對我們的治療提出了一系列的挑戰[3]。據文獻報道,卵巢癌,子宮內膜癌,結直腸癌,胃癌,胰腺癌及腹膜惡性腫瘤常導致惡性腹水的發生。而在胃腸道惡性腫瘤中,大約有15%的病例會發展為惡性腹水[4]。目前,對于惡性腫瘤引起的腹水主要的治療方式有限制鈉鹽的攝入,利尿,穿刺引流以及腹腔靜脈分流術等,但是這些方法對于惡性腹水的治療效果仍欠佳。
血管生成對于腫瘤的發生、發展有著重要的意義。腫瘤細胞通過分泌一些調節因子,如血管內生長因子(vascular endothelial growth factor,VEGF)來誘導腫瘤細胞血管壁的形成,從而誘導新生血管的形成。目前,以貝伐珠單抗為代表的抗VEGF靶向治療藥物被應用于多種腫瘤,并取得了良好的療效[5-6]。但是,目前對于貝伐珠單抗能否抑制惡性腹水的形成還存在著許多未知。
在本研究中,我們利用貝伐珠單抗腹腔內注射到已有惡性腹水形成的結直腸癌患者,觀察注射后患者腹水形成的情況以及其毒副作用,為惡性腹水的治療提供一定的實驗數據。
資料與方法
一、一般資料
選取2010年3月至2014年5月在桂林醫學院附屬醫院病理證實為晚期結直腸癌患者。其納入標準如下:①出現腹水;②常規化療藥物無法控制腹水的發生。實驗分為對照組和治療組。對照組患者以傳統的腹腔穿刺術、利尿等對癥處理。治療組患者于腹腔內注射貝伐珠單抗。并在注射前測量其腹水和血清中VEGF含量作為治療前對照。然后將腹水充分引流后,在腹腔內注射貝伐珠單抗(每3周一次,5 mg/kg)后再測定其腹水和血液中的VEGF含量作為實驗后對照。腹腔內注射貝伐珠單抗后每隔1~2周利用彩色多普勒超聲觀察的腹水控制情況,并監測患者的無穿刺生存時間、毒副作用。本研究由桂林醫學院附屬醫院倫理道德委員會批準并且符合赫爾辛基宣言。所有參與實驗的患者及其家屬都簽署了同意書。
二、VEGF測定的實驗方法
病人的血液和腹水在實驗前冷凍在-80 ℃。檢測前利用低溫離心機以2500 rmp,4 ℃離心20 min后提取上清;然后根據ELISA試劑盒(Sigma,美國)說明書檢測其VEGF含量的大小。實驗結果根據標準樣品濃度曲線換算成pg/mL。
三、統計學分析
所有的數據都采用SPSS17.0分析;兩個樣本均數之間的比較采用獨立樣本t檢驗或配對t檢驗;生存率分析采用Kaplan-Meier分析,生存率曲線比較采用log-rank檢驗;P值<0.05為差異有統計學意義。
結 果
在本研究中,共納入病人46例,對照組20例,治療組26例。對照組中結腸癌11例,直腸癌9例。男性12例,女性8例。治療組中結腸癌15例,直腸癌15例。男性11例,女性10例。中位年齡55歲(33~77歲)。
在治療組中,人均接受貝伐珠單抗的注射次數為2.5次,其中病情得到控制的為22例,其中16例為部分緩解,6例為完全緩解,治療無效為4例。治療后患者的平均無穿刺生存時間為(6.92±3.47)個月(表1)。與對照組相比,治療組的無穿刺生存時間明顯延長(t值=6.328,P<0.001)。在毒副作用方面,一例患者出現了消化道穿孔,經保守治療后痊愈,一例患者出現高血壓,一例患者出現腹腔出血,經治療后好轉。
在對照組中,血清VEGF的平均值為(671.8± 499.15)pg/mL,治療組中的血清VEGF的平均值是(665.19±499.15)pg/mL。在治療組中,在腹腔內注射貝伐珠單抗前的腹水VEGF量的平均值為(1 225.11±609.71)pg/mL。在腹腔內注射貝伐珠單抗后,腹水的VEGF量的平均值為(317.69±172.14)pg/mL,與治療前相比,兩者存在統計學差異(t值=4.332,P<0.001,表2);而治療后血清中的VEGF的平均值為(170.61±115.92)pg/mL,與治療前相比,兩者存在統計學差異(t值=5.841,P<0.001,表2)。
在生存分析中,經單因素生存分析發現,治療組的總體預后也明顯好于對照組(P<0.001,圖1)。
討 論
惡性胸腹水是癌癥晚期的并發癥之一,常伴隨著一系列復雜的臨床問題,給腫瘤晚期患者的生活帶來了極大的痛苦[7-8]。目前,對于惡性腹水的治療方法相當有限,效果也不顯著。這使得我們亟需尋找到新的治療方法。
目前,越來越多的文獻報道VEGF在腫瘤的惡性腹水的形成中具有重要的作用[9-10]。貝伐珠單抗,以VEGF為靶點的靶向治療藥物,目前在臨床上的使用已較為廣泛。在我們的研究中,我們在腹腔內注射貝伐珠單抗后發現,使用了貝伐珠單抗的治療組其腹水的量明顯減少,血清和腹水中的VEGF的量與治療前相比也明顯下降,治療后患者的無穿刺生存時間也明顯延長,而在毒副作用方面,其發生率卻極低。在預后方面,經單因素生存分析后發現,治療組的總體生存明顯較對照組高。
表1 對照組與治療組中血清VEGF與無穿刺生存時間對比(±s)
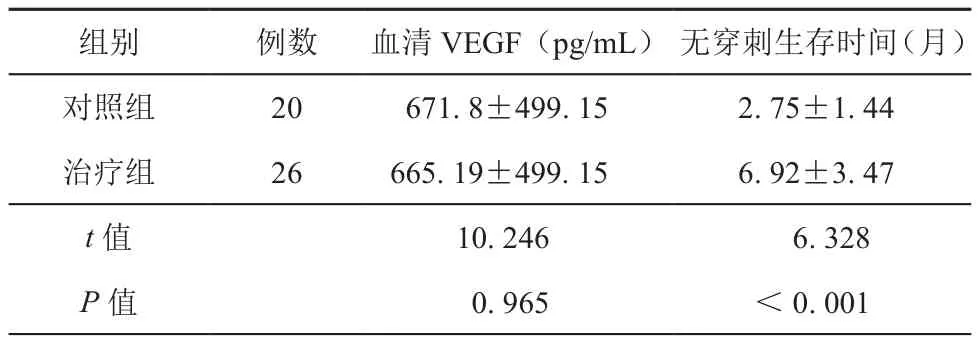
表1 對照組與治療組中血清VEGF與無穿刺生存時間對比(±s)
組別例數血清VEGF(pg/mL)無穿刺生存時間(月)對照組20671.8±499.152.75±1.44治療組26665.19±499.156.92±3.47 t值10.2466.328 P值0.965<0.001
表2 治療組治療前后VEGF值的比較(±s)
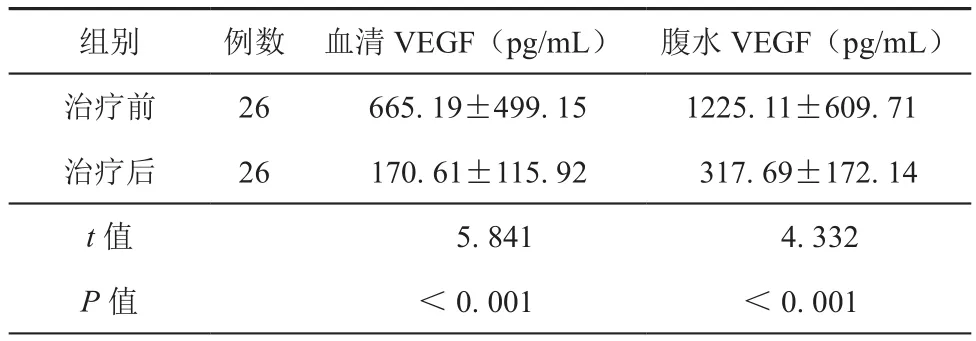
表2 治療組治療前后VEGF值的比較(±s)
組別例數血清VEGF(pg/mL)腹水VEGF(pg/mL)治療前26665.19±499.151225.11±609.71治療后26170.61±115.92317.69±172.14 t值5.8414.332 P值<0.001<0.001
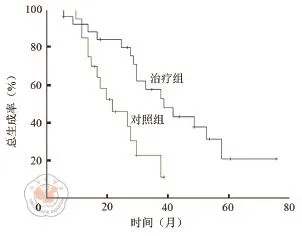
圖1 治療組與對照組的總體生存的比較
腹水的產生主要由血管的靜脈壓、血漿膠體滲透壓、水鈉潴留及血管的通透性等諸多因素決定。惡性腹水形成的原因較為復雜,其中原因之一就是腫瘤細胞破壞淋巴系統的回流,從而影響腹水的吸收[11-12]。在過去許多腫瘤的研究中發現,由于血管通透性的增加常導致壁層腹膜有許多新生血管形成以及許多糖蛋白形成,從而導致惡性腹水的形成[7,13]。抗血管治療這一理論是由Judah Folkman于20世紀70年代提出,是以抑制腫瘤細胞的血管形成來達到腫瘤的生長這一理論作為基礎[14]。目前,以貝伐珠單抗作為代表的抗VEGF藥物在臨床上已廣為應用。并取得了較好的成績。
在我們的研究中,我們發現,經腹腔內注射貝伐珠單抗的治療組,其腹腔內的腹水的形成明顯減少;并且,在治療組中,其腹水及血液中的VEGF的含量較治療前也明顯下降。這些結果與文獻報道也相符。Numnum等報道利用貝伐珠單抗成功抑制了卵巢癌患者的腹水的形成,減少了腹腔穿刺引流的次數,提高了患者的生活質量[15]。El-Shami等報道了腹腔內注射貝伐珠單抗治療9例因晚期腫瘤導致的惡性腹水患者,明顯的抑制了患者腹水的形成[16]。Pichelmayer等利用貝伐珠單抗治療結直腸癌引起的惡性腹水后發現,貝伐珠單抗能有效抑制腹水的形成并減少血漿中的VEGF的含量[17]。
由于目前對于惡性腫瘤引起的腹水的原因未完全明了,其治療的方式以及治療的效果目前都尚欠佳。因此,對于晚期腫瘤引起的惡性腹水的患者,我們的首選目標是減輕其痛苦并提高其晚期生活質量。在我們的研究中,經貝伐珠單抗治療后的病人,其腹水形成時間明顯延長,與對照組相比,其無穿刺生存時間明顯得到提高。而且,治療組的預后與對照組相比也明顯得到提高。
此外,腹腔內注射貝伐珠單抗還有以下優點:腹腔內注射貝伐珠單抗并不會增加腹腔內的壓力,因為目前對于惡性腹水病人來說,腹腔穿刺引流是一種常見的治療手段。另外,腹水的形成與腹腔內VEGF的分泌有著密切的關系,而腹腔內注射能使得腹腔內的藥物濃度達到最高,從而可以有效的抑制VEGF的形成。
因此,基于以上證據,對于一部分合適的病人,腹腔內注射貝伐珠單抗對于惡性腹水的治療可能是一種有效地、安全的治療手段。
參考文獻
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012.CA:a cancer journal for clinicians,2015,65(2):87-108.
[2]Sinclair P,Singh A,Riaz AA,et al.An unsolved conundrum:the ideal follow-up strategy after curative surgery for colorectal cancer.Gastrointestinal endoscopy,2012,75(5):1072-1079.
[3]Becker G,Galandi D,Blum HE.Malignant ascites:systematicreview and guideline for treatment.European journal of cancer,2006,42(5):589-597.
[4]Montero E,Miguel J,Lopez-Alvarez J.Care of patients with ascites.The New England journal of medicine,1994,330(25):1828.
[5]Liu Y,Luan L,Wang X.A randomized Phase II clinical study of combining panitumumab and bevacizumab,plus irinotecan,5-fluorouracil,and leucovorin (FOLFIRI) compared with FOLFIRI alone as second-line treatment for patients with metastatic colorectal cancer and KRAS mutation.OncoTargets and therapy,2015,8:1061-1068.
[6]Hurwitz HI,Fehrenbacher L,Hainsworth JD,et al.Bevacizurnab in combination with fluorouracil and leucovorin:An active regimen for first-line metastatic colorectal cancer.Journal of Clinical Oncology,2005,23(15):3502-3508.
[7]Adam RA,Adam YG.Malignant ascites:past,present,and future.Journal of the American College of Surgeons,2004,198(6):999-1011.
[8]Saada E,Follana P,Peyrade F,et al.Pathogenesis and management of refractory malignant ascites.Bulletin du cancer,2011,98(6):679-687.
[9]Yabushita H,Shimazu M,Noguchi M,et al.Vascular endothelial growth factor activating matrix metalloproteinase in ascitic fluid during peritoneal dissemination of ovarian cancer.Oncology Reports,2003,10(1):89-95.
[10]Atanackovic D,Cao Y,Kim J-W,et al.The local cytokine and chemokine milieu within malignant effusions.Tumor Biology,2008,29(2):93-104.
[11]Cavazzoni E,Bugiantella W,Graziosi L,et al.Malignant ascites:pathophysiology and treatment.International journal of clinical oncology,2013,18(1):1-9.
[12]Smolle E,Taucher V,Haybaeck J.Malignant ascites in ovarian cancer and the role of targeted therapeutics.Anticancer research,2014,34(4):1553-1561.
[13]Brown PD.Matrix metalloproteinase inhibitors:a novel class of anticancer agents.Adv Enzyme Regul,1995,35:293-301.
[14]Folkman J.Tumor angiogenesis:therapeutic implications.The New England journal of medicine,1971,285(21):1182-1186.
[15]Numnum TM,Rocconi RP,Whitworth J,et al.The use of bevacizumab to palliate symptomatic ascites in patients with refractory ovarian carcinoma.Gynecologic Oncology,2006,102(3):425-428.
[16]el-Shami K,Griffiths E,Streiff M.Nonbacterial thrombotic endocarditis in cancer patients:pathogenesis,diagnosis,and treatment.The oncologist,2007,12(5):518-523.
[17]Pichelmayer O,Zielinski C,Raderer M.Response of a nonmalignant pleural effusion to bevacizumab.New England Journal of Medicine,2005,353(7):740-741.
(收稿日期:2016-05-17)
(本文編輯:劉正)
鐘漓,趙志,朱小寶,等.腹腔內注射貝伐珠單抗治療結直腸癌患者惡性腹腔積液的療效和安全性評價[J/CD]中華結直腸疾病電子雜志,2016,5(5):424-427.
Analysis of therapeutic effect of endoscopic submucosal dissection for treating laterlly spreading tumor extending to the dentate line in the rectum
Wang Hongbo,Xu Mingyao,Chen Qingbo,Guo Yin,Pan Xia.Department of Endoscopy,Hubei Cancer Hospital,Wuhan 430079,China
Chen Qingbo,Email: zdccqcqb8@sina.com
Objective To investigate the effect and safety of endoscopic submucosal dissection(ESD) for treating rectal laterally spreading tumor (LST) extending to the dentate line.Methods Data of 45 cases of rectal LSTs extending to the dentate line were collected,which were treated by ESD in endoscopy center in Hubei Tumor Hospital from Oct 2012 to Oct 2014.The lesion types of LST,size,procedure time,the en-bloc complete resection rate,complications,pathological diagnosis and fellow-up were retrospective analyzed.Results Among 45 LSTs in the rectum,average size of the lesion was 28 mm.en bloc R0 curative resection rate was 100%.The procedure time of ESD was 45 min~240 min,The average procedure time was (100±25) min.Delayed bleeding occurred in six patients (13.3%),all of which underwent successful endoscopic hemostasi.Perforation developed in 2 cases (4.4%),the perforation was cured by hemostat and conservative medical management.Thirty-seven cases were diagnosed post-surgically as low grade intraepithelial neoplasia and eight cases as high grade intraepithelial neoplasia,all of the lesion invasion was confined to mucosal layer.The average time of the follow-up was 30.2 months(10~46 months).None of the cases had recurrent or residual,and the anal defecation function was normal.Conclusions ESD was an effective and safe treatment for rectal LSTs for its high resection rate and low recurrence rate.ESD had no influence on the anal defecation function.
Rectal neoplasms; Endoscopes; Laterally spreading tumors; Endoscopic submucosal dissection
The short-term effect and safety of anti-malignant ascites treated with intraperitoneal injection of bevacizumab
Zhong Li,Zhao Zhi,Zhu Xiaobao,Ran Fulin,Chen Xiao.Department of Gastrointestinal Surgery,Guilin Medical College Affiliated Hospital,Guilin 541000,China.
2016-05-21)
10.3877/cma.j.issn.2095-3224.2016.05.011
吳階平醫學基金資助項目(No.320.6750.13390)
541000桂林醫學院附屬醫院胃腸外科
鐘漓,Email:zhongli0302@163.com
DOI:10.3877/cma.j.issn.2095-3224.2016.05.010
作者單位:430079 武漢,湖北省腫瘤醫院內鏡科
通訊作者:陳清波,Email:zdccqcqb8@sina.com

