關于氮、磷元素異同的問題
◇ 北京 王篤年
◇ 黑龍江 盧國鋒
?
關于氮、磷元素異同的問題
◇北京王篤年
1) 作為同一主族且在周期表里相鄰的元素,為什么氮元素的單質為N2而磷元素的單質則是P4(白磷)?
與此類似的問題還有很多,如,同主族的氧元素和硫元素,其單質分子結構也有很大不同——氧元素的單質有O2和O3等小分子,而常溫下硫元素的穩定單質則主要是S8;再如,同屬第ⅣA族的碳元素有金剛石(微觀四面體結構)和石墨(微觀平面六邊形結構)及“球碳”“碳納米管”等多種,而硅元素則難以形成類似石墨的微觀平面層狀結構,“球硅”“硅納米管”是理論化學家和實驗化學家一直在追求的物種,說明它們并不常見.
對這樣一些事實,目前我們只能從原子半徑不同導致原子間結合時軌道重疊程度不同等角度加以理解.根據價鍵理論,當2個N原子相互結合時,首先通過2p軌道的“頭碰頭”重疊形成1個σ鍵,為滿足每個原子最外層的8電子穩定結構,其余2個相互平行的2p軌道從側面以“肩并肩”的形式發生電子云重疊,形成2個π鍵.我們不妨這樣想象,氮原子半徑較小,所以2p軌道可以發生較大程度的重疊,形成的π鍵比較牢固.而半徑相對較大的磷原子,2個原子間距離大,3p軌道重疊程度小,會導致形成的“3p-3p”π鍵不夠牢固,故而不易形成P2分子.相反,如果4個P原子彼此間結合形成正四面體結構的P4分子,每個P原子都與另外3個P原子間以σ鍵結合(盡管鍵角并不理想,分子內部張力相對較大,但是由于P原子半徑大,可在一定程度上緩解張力作用)則比較容易,一般說來,σ鍵比π鍵的電子云重疊程度大,鍵更穩定一些.
科學研究表明,在800℃以上,P4也會分解為P2,其分子結構與N2相似,2個P原子間形成共價三鍵.
2)P的最高價氧化物是P2O5還是P4O10?同一物質為什么會有2種不同寫法?
P2O5叫化學式,P4O10才是分子式.請參考圖1.

圖1
P4氧化時(紅磷氧化也發生類似過程),先斷開各個P—P鍵,在中間插入氧原子,形成P4O6分子(化學式P2O3),這時每個磷原子還有1對孤對電子,它們分別再向1個氧原子配位,即形成P4O10分子.可以看出,無論P4O6還是P4O10分子中,磷原子、氧原子都是滿足最外層8電子穩定結構的,所以它們都可以獨立存在.
在化學研究的早期,人們并沒有分子結構的概念,那時主要通過質量測定換算物質的元素組成情況,大量的實驗數據表明,磷元素的最高價氧化物中磷元素與氧元素的質量比是31∶40,人們由此推知,該化合物的組成比例為P2O5.
3) 為什么硝酸分子式為HNO3而磷酸分子式為H3PO4?
請參考本刊2013年第13期《篤年老師問與答——關于含氧酸命名規則及酸性強弱的問題》.
4) 為什么磷酸難揮發而硝酸卻易揮發?
液體是否容易揮發,一般看其沸點是否低于水的沸點100℃.磷酸沸點為261℃,而硝酸沸點只有83℃,所以我們說磷酸為難揮發性酸而硝酸則屬于揮發性酸.物質的沸點高低決定于其內部分子間作用力的強弱,從磷酸和硝酸的分子結構看,它們都含有羥基,因此似乎都具備形成分子間氫鍵的條件,但是由于硝酸分子中只有1個氫原子,它首先參與分子內氫鍵的形成(圖2),以至于分子間氫鍵的強度受到影響,所以硝酸的沸點并不高.而磷酸分子內有3個氫原子,不可能都形成分子內氫鍵,所以分子間氫鍵作用很強,故而沸點高.

圖2
上述“硝酸分子內氫鍵”的說法只是教科書的描述,其實根據氫鍵理論可知,該分子內氫鍵在方向性方面存在很大問題(理想的氫鍵應該是X—H…Y直線結構).我們不妨用“硝酸分子內氫原子數少,因而分子間形成的氫鍵數量少”來理解它與磷酸沸點的差異.
5) 為什么常見的3類化學肥料(氮肥、磷肥、鉀肥)中,氮族元素就占了2類?
這涉及元素觀問題.構成植物的化學物質主要是糖類(淀粉和纖維素)、油脂、蛋白質,從元素的視角看,主要有H、C、O、N、S、P等元素,H、C、O可以從大氣和土壤中吸收H2O和CO2獲得,N、P等雖然也可以從土壤中獲取,但對于現代農業的產量需求來說,自然土壤提供不了所需要的量,所以需要人為補充這些元素(以作物能夠吸收利用的方式,所謂“肥料”).
其實,氮、磷、鉀肥只是人們對于傳統農業肥料的經驗性認識,不同的作物、不同的種植方式決定著土壤需要肥料的種類.首先我們知道,封閉的大棚種植需要施用CO2“氣肥”,因為大棚內氣體不參與大氣循環,CO2供應不足;有些作物不宜“重茬”種植,除了考慮病蟲害等因素外,更重要的原因則是植物生長需要的某些微量元素(有些可能是目前尚未認識到的)供應不足.所以,現代農業不再像傳統農業那樣只依據觀察和經驗施用化學肥料,而是依據科學研究的結果,進行“測土施肥”——先測定土壤中各元素的含量,再依據所種植植物的生長需要科學合理地設計配方,向土壤中施加各種營養元素,包括氮、磷、鉀肥及硫、硼、鈣、鉬等微量元素肥料.
1 原子結構與元素的性質
1.1基態原子(離子)的核外電子排布
1) 1~18號元素按構造原理1s2s2p3s3p填充電子,19~36號元素E3d>E4s, 1s2s2p3s3p4s3d4p,書寫時按能層調整為1s2s2p3s3p3d4s4p,同時書寫順序也是由外向內失去電子形成離子順序.
2) 畫電子排布圖時遵循泡利原理和洪特規則,每個軌道最多容納2個自旋狀態相反的電子,當電子排布在等價軌道上時,電子總是優先單獨占據1個軌道,而且自旋方向相同.
3) 審題時注意書寫微粒狀態是原子還是離子,是外圍排布式(也叫價電子排布式)還是核外電子排布式,是電子排布式還是電子排布圖.教材第7頁“思考與交流”,提供了電子排布式的簡化書寫方法,[稀有氣體元素符號]外圍排布式.如:鈉原子的電子排布式1s22s22p63s1;鈉離子的電子排布式1s22s22p6.鈉原子可簡寫:[Ne]3s1,若刪除稀有氣體部分得外圍電子排布式3s1.過渡元素中不僅最外層電子為價電子,次外層電子也可成為價電子,如:Cu[Ar] 3d104s1,刪除稀有氣體結構得外圍電子排布式3d104s1,K外圍電子排布式4s1,外圍電子排布式不同,但最外層電子數相同.


1.2元素性質——電離能和電負性
1) 元素第一電離能變化規律:每一周期的第一種元素(氫和堿金屬)的第一電離能最小,最后一種元素(稀有氣體)的第一電離能最大,同周期從左到右元素第一電離能呈增大趨勢,但第ⅡA族s2全充滿結構和第ⅤA族p3半充滿結構,原子的能量較低,該元素具有的第一電離能比鄰近的元素大.
2) 電離能的應用:判斷元素的金屬性強弱.I1越大,元素的金屬性越弱;I1越小,元素的金屬性越強.根據電離能數據,確定元素在化合物中的化合價.鈉和鎂第一、二、三電離能,如表1所示.

表1
從表1可以看出鈉的第一電離能較小而第二電離能突躍地升高,表明鈉易失去1個電子達到8電子穩定結構,形成+1價Na+,不易再失去第2個電子;而鎂的第一、二電離能均較低,第三電離能突躍地升高,說明鎂易失去2個電子,形成+2價Mg2+后達到8電子穩定結構,再失去第3個電子很困難.
3) 電負性變化規律:同一周期從左到右,元素的電負性逐漸增大,同一主族從上至下電負性減小.在所有元素中,氟的電負性(4.0)最大,非金屬性最強,鈁的電負性(0.7)最小,金屬性最強.




2 化學鍵與物質的性質考點
2.1σ鍵和π鍵的形成,鍵的極性和分子的極性
1) 共價鍵按成鍵原子關系分為非極性鍵、極性鍵;按電子云重疊方式分為δ鍵、π鍵;按共用電子對的來源分為一般共價鍵、配位鍵A→B.判斷鍵的極性方法:看成鍵原子是否相同.
2) 判斷分子極性方法:a) 中心原子化合價法.組成為ABn型化合物,若中心原子A的化合價(只考慮數值)等于族的序數,則該化合物為非極性分子,如CH4、CCl4、SO3、PCl5.b) 受力分析法.若已知鍵角(或空間結構),可進行受力分析,合力為0者為非極性分子,如CO2、C2H4、BF3.
3) 判斷δ鍵和π鍵成鍵數目方法: 共價單鍵是δ鍵,共價雙鍵有1個δ鍵、1個π鍵,共價三鍵由1個δ鍵、2個π鍵組成.

5) 鮑林從實驗中總結出經驗規律,含氧酸用通式表示為(HO)mROn,其中n為非羥基氧原子(即不與氫相連的氧原子)的數目,n越大,酸性越強.結構解釋是成酸R元素相同,n值越大,R的正電性越高,導致R—O—H中O的電子向R偏移,水分子作用下,越容易電離出H+,即酸性越強.如酸性由強到弱為HClO4、HClO3、HClO2、HClO.




2.2簡單配合物的成鍵
配位鍵是特殊的共價鍵.一方有孤對電子,而另一方有空軌道,這是形成配位鍵的必要條件,常用電子對給予體→電子對接受體符號表示.在配合物中,與配合物形成體(中心原子或離子)直接結合的配位原子總數,叫配位數.


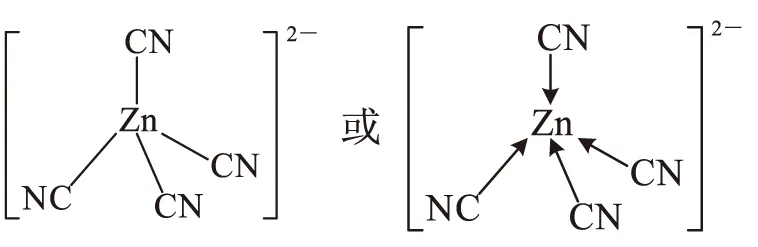


2.3金屬晶體常見的堆積方式
在討論各種類型晶體結構時,也常借用配位數這個名詞,指1個原子(或離子)周圍連接的其他原子(或異號離子)的數目.金屬有4種堆積模型,簡單立方堆積、體心立方堆積、面心立方最密堆積、六方最密堆積,其配位數分別6、8、12、12.


2.4雜化軌道類型與分子構型







3 分子間作用力與物質的性質考點
3.1氫鍵的存在對物質性質的影響
氫鍵是H原子特有的性質,半徑很小的H原子與電負性大的X(符合條件的有F、O、N)形成共價鍵后,由于X吸引價電子能力大,使H幾乎成為“裸露”的質子,由于質子的半徑特別小,可以與另一個電負性大的Y相互作用形成氫鍵,一般表示為X—H…Y,X—H鍵是共價鍵,其中H…Y的結合力就是氫鍵.氫鍵是介于化學鍵和分子間作用力之間的一種特殊的作用,其強度遠小于化學鍵,略大于分子間作用力.氫鍵分為分子間氫鍵、分子內氫鍵2種.如HF、H2O、HCOOH可以結合為(HF)n、(H2O)n、(HCOOH)n.分子間形成的氫鍵會使物質的熔點和沸點升高.

A第4周期元素中,錳原子價電子層中未成對電子數最多;
B第2周期主族元素的原子半徑隨核電荷數增大依次減小;
C鹵素氫化物中,HCl的沸點最低的原因是其分子間的范德華力最小;
D價層電子對互斥理論中,π鍵電子對數不計入中心原子的價層電子對數

3.2分子晶體與原子晶體、離子晶體、金屬晶體的結構微粒、微粒間作用力的區別
晶體熔、沸點的比較方法: 1) 不同晶體類型的物質,一般情況下,熔、沸點由高到低順序為原子晶體、離子晶體、分子晶體,而金屬晶體的熔、沸點差異較大,有的很高(鎢),有的很低(汞).2) 原子晶體:原子半徑越大,共價鍵越長,共價鍵就越弱,熔、沸點越低;離子晶體:離子所帶電荷越多,離子半徑越小,則離子鍵越強,熔、沸點越高;金屬晶體:金屬陽離子帶的電荷越多,半徑越小,金屬鍵越強,熔、沸點越高;分子晶體:組成和結構相似的分子晶體,一般相對分子質量越大,分子間作用力越強,熔、沸點越高;組成和結構不相似的物質,分子的極性越大,熔、沸點越高;若分子間存在氫鍵,則熔、沸點會反常高. 3) 對于有明顯狀態差異的物質,根據常溫下狀態進行判斷.


表2
Ge單晶具有金剛石型結構,微粒之間存在的作用力是________.



3.3根據晶胞確定晶體的組成并進行相關計算
1) 用均攤的方法來確定晶體的化學式(圖1).

圖1
空間利用率=[V(球總體積)/V(晶胞體積)]×100%.
注意單位換算: 1m=10dm=102cm=103mm=106μm=109nm=1012pm.

圖2



圖3
(作者單位:黑龍江省大慶市第五十六中學)
北京十一學校)

◇黑龍江盧國鋒
2016年全國卷和地方卷共10套,《物質結構與性質》模塊在全國卷3套中以“三選一”的形式作答,海南卷中必考與選考相結合,江蘇卷“二選一”,四川卷一道必考題,上海卷一道必考題中的一部分,7套卷都涉及此模塊試題.本文按照考試大綱考點,將相關試題分解,揭示命題規律,歸納解題常用方法.

