骨骼肌細(xì)胞自噬相關(guān)研究進(jìn)展
李 恩,葉 魁,蘇全生
骨骼肌細(xì)胞自噬相關(guān)研究進(jìn)展
李 恩1,葉 魁1,蘇全生2
細(xì)胞自噬是普遍存在于真核細(xì)胞中的生命現(xiàn)象。細(xì)胞內(nèi)蛋白質(zhì)和細(xì)胞器發(fā)生變形、衰老或損傷時(shí)可通過細(xì)胞自噬轉(zhuǎn)運(yùn)至溶酶體內(nèi)進(jìn)行消化降解。細(xì)胞自噬水平的調(diào)節(jié),可以通過適宜的運(yùn)動(dòng)強(qiáng)度使其上升,并且降解細(xì)胞內(nèi)損傷的細(xì)胞器和代謝廢物。同時(shí),針對(duì)有效的運(yùn)動(dòng)訓(xùn)練來調(diào)節(jié)與細(xì)胞自噬相關(guān)信號(hào)通路,對(duì)骨骼肌質(zhì)量產(chǎn)生重要作用。
運(yùn)動(dòng);細(xì)胞自噬;骨骼肌;胰島素抵抗
1 細(xì)胞自噬
1.1細(xì)胞自噬概述
細(xì)胞自噬,也稱之為“自體吞噬”,自噬廣泛存在于真核細(xì)胞中。自噬在進(jìn)化的過程中是極度保守的,都可以找出與其有關(guān)的同源基因,例如:酵母、果蠅到脊椎動(dòng)物和人類[1]。細(xì)胞自噬在機(jī)體中維持內(nèi)環(huán)境的穩(wěn)態(tài)扮演十分重要的角色;同時(shí),在調(diào)控細(xì)胞生存中,細(xì)胞自噬是扮演一把雙刃劍的作用。因?yàn)樵诩?xì)胞饑餓、生長(zhǎng)因子缺乏和缺氧與一些病理狀態(tài)下等條件,為了維持細(xì)胞的存活,自噬是起著積極作用的。有相關(guān)文獻(xiàn)報(bào)道[2]:細(xì)胞自噬過高、過低都是不利于骨骼肌的健康,當(dāng)細(xì)胞自噬過高會(huì)導(dǎo)致骨骼肌的質(zhì)量下降或細(xì)胞自噬過低又會(huì)導(dǎo)致骨骼肌纖維下調(diào)和肌纖維無力。按照細(xì)胞內(nèi)底物進(jìn)入溶酶體腔的形式,細(xì)胞自噬可分為[3]:大自噬、小自噬和分子伴侶介導(dǎo)的自噬(三種不同的自噬進(jìn)程,如圖1所示)。大自噬指以小泡方式通過溶酶體直接消化降解胞漿中老化或損傷蛋白質(zhì)和細(xì)胞器的過程;小自噬指溶酶體直接包裹吞噬細(xì)胞內(nèi)容物并降解的過程;分子伴侶自噬指帶有KFERQ-氨基酸序列的可溶性蛋白與分子伴侶熱體克蛋白 70(HSC70)選擇性結(jié)合形成符合物,同時(shí),結(jié)合2型溶酶體膜蛋白受體(Lamp2),并轉(zhuǎn)運(yùn)到溶酶體降解的過程[4]。
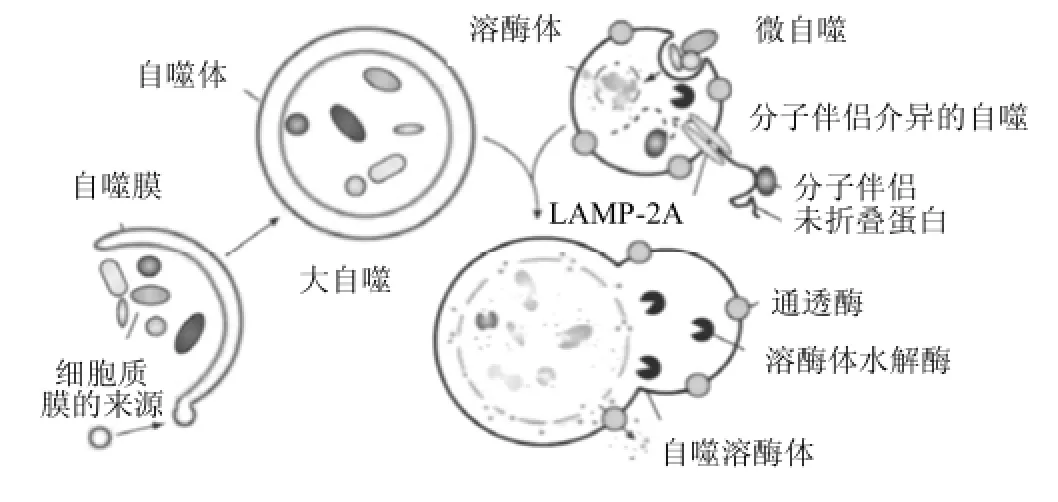
圖1 細(xì)胞自噬進(jìn)程圖
1.2自噬發(fā)生過程的分子機(jī)制
自從在哺乳動(dòng)物中發(fā)現(xiàn)細(xì)胞自噬后,對(duì)細(xì)胞自噬的分子機(jī)制研究越來越深入。目前已經(jīng)從酵母中發(fā)現(xiàn)30多種與細(xì)胞自噬相關(guān)的特異性基因[5],且大多數(shù)都可在哺乳動(dòng)物中找到同源基因。細(xì)胞自噬可以分為初始階段、自噬體形成階段、自噬體與溶酶體的結(jié)合階段和溶酶體降解階段。(1)自噬的初始階段:在細(xì)胞自噬的初始階段,主要是對(duì)自噬的信號(hào)通路的調(diào)控進(jìn)行管理的。在細(xì)胞自噬的信號(hào)通路中,PI3K是最主要的信號(hào)調(diào)控通路,PI3K的上游蛋白和自身可以成為調(diào)控的靶點(diǎn),但最主要的靶點(diǎn)還是PI3K自身;(2)自噬體的形成階段:在自噬體形成的這一階段和自噬膜的產(chǎn)生與延伸階段,主要是由mTOR控制。mTOR對(duì)ULK1 和Atg13是具有抑制作用的,因此,抑制mTOR是可以誘發(fā)自噬的發(fā)生。Vps34在自噬調(diào)控中,也是一個(gè)重要的靶點(diǎn),因此,利用RNA干擾技術(shù)直接作用在Vps34上,也可以實(shí)現(xiàn)對(duì)細(xì)胞自噬的調(diào)控;(3)自噬體與溶酶體的結(jié)合階段:在自噬體與溶酶體的結(jié)合過程中對(duì)其進(jìn)行阻斷,可以達(dá)到抑制細(xì)胞自噬的效果。目前可以用來阻斷自噬體與溶酶體結(jié)合的阻斷物質(zhì)有:巴伐洛霉素A1、CQ、HCQ等;(4)溶酶體的降解階段:在自噬體與溶酶體結(jié)合后,最終會(huì)出現(xiàn)被溶酶體的水解酶進(jìn)行水解,最先會(huì)通過囊泡的酸化,達(dá)到所需的PH值后,再經(jīng)過多種蛋白酶的作用使囊內(nèi)的物質(zhì)進(jìn)行降解。
當(dāng)哺乳動(dòng)物收到饑餓信號(hào)時(shí)自噬發(fā)生,mTOR活性被抑制,使相應(yīng)的由(ULK1等)自噬蛋白的抑制作用被減弱。在Atg/ULK1復(fù)合體與Beclin-1復(fù)合體的雙重作用下,自噬體開始形成。自噬膜的形成和延伸是由兩條蛋白鏈接系統(tǒng)主導(dǎo)。Atg12-Atg5-Atg16復(fù)合物與自噬膜特異性相結(jié)合促進(jìn)自噬膜的延伸,使開始自噬的小面積雙層膜逐漸呈口袋狀。當(dāng)雙層的自噬膜將要閉合時(shí),Atg12-Atg5-Atg16復(fù)合物從自噬膜上脫落,而LC3-II最終被留下。所以,LC3-II是判斷自噬變化的金標(biāo)準(zhǔn)。LC3-II數(shù)量與自噬泡數(shù)量呈正比。細(xì)胞自噬發(fā)生時(shí),細(xì)胞內(nèi)LC3-I向LC3-II轉(zhuǎn)化明顯增多。因此,檢測(cè)細(xì)胞內(nèi)LC3-II含量可用于判斷自噬變化情況。
1.3細(xì)胞自噬的調(diào)控
自噬的調(diào)控主要包括兩個(gè)方面:(1)誘導(dǎo)自噬;(2)抑制自噬。研究發(fā)現(xiàn)[6]: PI3K在細(xì)胞自噬信號(hào)通路中具有重要的調(diào)控功能;蛋白激酶mTOR是細(xì)胞中營(yíng)養(yǎng)感受器和自噬的重要調(diào)節(jié)者,并且是PIKK的家族成員。細(xì)胞內(nèi)氨基酸和葡萄糖水平可以調(diào)節(jié)mTOR激酶的活性。mTOR有兩種不同的復(fù)合物形式:(1)mTORC1,參與細(xì)胞生長(zhǎng)、凋亡、自噬和能量代謝的調(diào)節(jié);(2)mTORC2,與細(xì)胞骨架蛋白的構(gòu)建和細(xì)胞存活有關(guān)[7]。
能量變化影響細(xì)胞自噬,主要通過調(diào)節(jié)mTOR調(diào)控通路來實(shí)現(xiàn)。饑餓狀態(tài)時(shí),ATP:AMP比值降低,AMPK被激活,進(jìn)而激活 TSC1/2復(fù)合物,同時(shí)抑制酶 Rheb,mTOR被抑制,從而上調(diào)細(xì)胞自噬的水平。氨基酸的攝入水平也可以影響mTOR的活性,主要是通過GTPases與MAP4K3來實(shí)現(xiàn),使其活性進(jìn)行上調(diào),達(dá)到對(duì)mTOR的激活,即抑制細(xì)胞自噬的發(fā)生。
Beclin1是酵母Atg6的同源基因,含4個(gè)非常重要的結(jié)構(gòu)域[8]:與 Bcl-2結(jié)合的結(jié)構(gòu)域(BH3)、進(jìn)化保守結(jié)構(gòu)域(ECD)、螺旋-螺旋結(jié)構(gòu)域(CCD)和核輸出結(jié)構(gòu)域。有研究報(bào)道[9]:在細(xì)胞自噬調(diào)節(jié)中,Beclin-1是不能直接進(jìn)行調(diào)節(jié)的,而是必須通過與mVps34、Bcl-2等相關(guān)因子的相互作用,間接的調(diào)節(jié)細(xì)胞的自噬水平。Bcl-2作為一種凋亡抑制蛋白,可與BH3結(jié)構(gòu)域結(jié)合形成Beclin1-Bcl-2復(fù)合物,從而抑制細(xì)胞自噬。mVps34則可與CCD、ECD結(jié)構(gòu)域結(jié)合形成mVps34-Beclin1復(fù)合物,并與其它蛋白相互作用調(diào)節(jié)細(xì)胞自噬[10]。
p53是一種腫瘤抑制因子,在細(xì)胞的氧化應(yīng)激、損傷和低氧刺激的時(shí)候,均可以刺激引發(fā)p53水平的升高。p53具有雙重的調(diào)節(jié)模式來調(diào)節(jié)細(xì)胞自噬的活性,在細(xì)胞核中,具有多種方式與途徑激活細(xì)胞自噬。如可通過激活 mTOR上游的一些自噬調(diào)節(jié)因子激活細(xì)胞自噬。這些調(diào)節(jié)因子包含AMPKβ、TSC2和PTEN等,都是調(diào)控細(xì)胞自噬的關(guān)鍵性抑制因子。在細(xì)胞質(zhì)中,p53在細(xì)胞自噬過程中具有負(fù)調(diào)節(jié)作用,因此,可以抑制細(xì)胞自噬的發(fā)生。相關(guān)實(shí)驗(yàn)指出:利用基因消除與相關(guān)抑制藥物對(duì) p53進(jìn)行干預(yù),人和大鼠等均出現(xiàn)了細(xì)胞自噬水平的升高。
2 胰島素抵抗與細(xì)胞自噬
胰島素抵抗的發(fā)生機(jī)制是十分復(fù)雜的,有多種影響作用。其中遺傳因素和環(huán)境因素的共同作用會(huì)導(dǎo)致出現(xiàn)IR的結(jié)果,并且存在以多個(gè)水平的缺陷特征。外部環(huán)境因素對(duì)IR是起著關(guān)鍵作用的,其中導(dǎo)致IR的最主要因素為肥胖。除此之外,生活方式也是影響 INS生理作用的主要原因,稱為“非遺傳性IR”。其中,高脂高糖飲食和缺乏鍛煉是導(dǎo)致胰島素抵抗的主要原因。當(dāng)胰島素和胰島素受體結(jié)合后,傳送過程中發(fā)生障礙的結(jié)果是導(dǎo)致絕大多數(shù)出現(xiàn)胰島素抵抗,其中主要缺陷包含:(1)胰島素受體的酪氨酸激酶活性降解;(2)胰島素傳導(dǎo)信號(hào)異常;(3)C6H6O6磷酸化和糖原合成的酶活性減弱等。
自噬對(duì)于維持內(nèi)環(huán)境穩(wěn)定是十分重要的,自噬缺陷引起內(nèi)質(zhì)網(wǎng)應(yīng)激,導(dǎo)致胰島素抵抗[11]。在高脂飲食誘導(dǎo)的肥胖小鼠的模型下[12],骨骼肌、心肌基礎(chǔ)狀態(tài)下自噬水平下降已有研究證實(shí)[13]:長(zhǎng)期高脂飲食誘導(dǎo)的胰島素抵抗的小鼠模型中,其骨骼肌細(xì)胞mTORC1的活性顯著上升。同時(shí),[14]mTORC1是在細(xì)胞自噬水平的調(diào)節(jié)中重要的抑制性調(diào)控信號(hào)通路,胰島素抵抗與細(xì)胞自噬可能密切相關(guān)。通過大量相關(guān)研究指出[11]:通過 7周的高脂飲食,并未明顯引起細(xì)胞自噬的改變。而在后期過程中,細(xì)胞自噬水平逐漸下降。因此,這一實(shí)驗(yàn)研究表明在高脂飲食膳養(yǎng)的模型下,細(xì)胞自噬的變化具有時(shí)程性的特點(diǎn)。
3 運(yùn)動(dòng)訓(xùn)練對(duì)骨骼肌細(xì)胞自噬的影響
骨骼肌主要是具有收縮和舒張功能的肌細(xì)胞組成,機(jī)體在參加任何活動(dòng)與運(yùn)動(dòng)時(shí),都需要骨骼肌的收縮與舒張來完成的。長(zhǎng)期有氧運(yùn)動(dòng)是一種健康的生活方式,不僅可以增強(qiáng)肌肉力量、控制體重,而且防止糖尿病、腫瘤等疾病方面發(fā)揮著重要作用。骨骼肌在機(jī)體的代謝過程中是十分旺盛的,并且在內(nèi)環(huán)境的穩(wěn)定狀態(tài)中對(duì)骨骼肌的正常生理功能是起著十分重要的作用。骨骼肌大約占 40%的重量比,是一種哺乳動(dòng)物蛋白儲(chǔ)存庫和能量耗竭時(shí)氨基酸的主要來源,因此,維持骨骼肌的穩(wěn)定性是需要適宜的自噬水平。通過有效的運(yùn)動(dòng)鍛煉可以使機(jī)體產(chǎn)生良好的生理變化,例如:提高骨骼肌的蛋白質(zhì)和線粒體的生理功能,并且可以延緩骨骼肌的衰老,但是長(zhǎng)時(shí)間以來,人們把運(yùn)動(dòng)與自噬之間的關(guān)系和自噬對(duì)運(yùn)動(dòng)效應(yīng)的影響一直被忽略的。就如德科斯坦大學(xué)西南醫(yī)學(xué)中心Beth Levine專家所講“運(yùn)動(dòng)與自噬之間的關(guān)系是十分明顯的,但是被人類完全忽略掉了”。
相關(guān)研究指出[15、16]:自噬對(duì)骨骼肌內(nèi)環(huán)境的穩(wěn)態(tài)是起著十分重要的作用,并且細(xì)胞自噬的缺陷與骨骼肌自身多種疾病是密切相關(guān)的。當(dāng)細(xì)胞自噬出現(xiàn)缺陷時(shí),會(huì)引發(fā)骨骼肌自身的糖代謝、脂代謝的異常和出現(xiàn)胰島素抵抗,并且會(huì)使耐力的運(yùn)動(dòng)能力下降。Masiero,F(xiàn)等人發(fā)現(xiàn)[17]:阻止細(xì)胞自噬的過度禁食或去神經(jīng)手術(shù)均導(dǎo)致了肌萎縮,可見,細(xì)胞自噬水平是影響骨骼肌質(zhì)量和肌纖維完整性的重要因素。Salminen等人研究[18、19]發(fā)現(xiàn)小鼠在運(yùn)動(dòng)2-7天后,細(xì)胞自噬的活性程度是最強(qiáng)的,自噬泡中會(huì)呈現(xiàn)不同下降程度的線粒體,這說明損傷的細(xì)胞器可以通過細(xì)胞自噬清除,成為機(jī)體能量代謝的底物。Lira等人報(bào)道[20]:28天自主運(yùn)動(dòng)后,小鼠趾肌Beclin-1、LC3-II和LC3-II:LC3-I含量分別增加 33%、43%和 21%,說明細(xì)胞自噬水平對(duì)保持骨骼肌的生理功能具有重要作用。此外,Wohlgemuth等人也指出[21]:大鼠進(jìn)行自主訓(xùn)練和熱量(8%CR)限制運(yùn)動(dòng)后,骨骼肌 Lamp2mRNA表達(dá)及 Atg7、Atg9、LC3-I、LC3-II蛋白表達(dá)全部上調(diào),LC3-II:LC3-I的比值也明顯上調(diào)。提示自主運(yùn)動(dòng)可能會(huì)改變骨骼肌細(xì)胞自噬的活性或抑制骨骼肌衰老過程中導(dǎo)致的細(xì)胞損傷或凋亡。Sun等人研究[22],耐力運(yùn)動(dòng)可同時(shí)上調(diào)自噬有關(guān)蛋白LC3-I、LC3-II、Beclin-1,表明細(xì)胞自噬的上調(diào)可改善機(jī)體對(duì)訓(xùn)練的適應(yīng)性。Kim等研究表明[23],氧化損傷與細(xì)胞自噬是呈互相關(guān)的,但是,通過自主運(yùn)動(dòng)和熱量限制運(yùn)動(dòng)的途徑細(xì)胞自噬可以對(duì)抗氧化損傷。Feng等人也研究發(fā)現(xiàn)[24],過度訓(xùn)練可以使肌肉組織的細(xì)胞自噬過度激活,表現(xiàn)為 Atg7、Beclin-1、LC3和FoxO3的表達(dá)增加,降解骨骼肌細(xì)胞質(zhì)中過量的蛋白質(zhì)和細(xì)胞器,致使肌肉的萎縮和肌力的下降。
綜上所述,運(yùn)動(dòng)訓(xùn)練是具有雙重調(diào)節(jié)作用的。細(xì)胞自噬水平的升高可以通過適宜的運(yùn)動(dòng)強(qiáng)度進(jìn)行改善,從而降解細(xì)胞內(nèi)的殘留物和損傷的細(xì)胞器,維持細(xì)胞內(nèi)穩(wěn)定效應(yīng);而大強(qiáng)度運(yùn)動(dòng)卻可能會(huì)過度激活細(xì)胞自噬,使得蛋白質(zhì)或細(xì)胞器過度下降,進(jìn)而引起細(xì)胞的疲勞和損傷,嚴(yán)重時(shí)甚至?xí)霈F(xiàn)II型程序性細(xì)胞凋亡。說明骨骼肌的質(zhì)量紊亂可能是因?yàn)榧?xì)胞自噬的紊亂導(dǎo)致,因此,可以通過改變細(xì)胞自噬的敏感性來參與骨骼肌的質(zhì)量調(diào)節(jié)。
[1] Kourtis N and Tavemarakis N. 2009, Autophagy and cell death in model organisms, Cell Death and Differentiation, 16(1): 21~30.
[2] SANDRI M,Autophagy in health and disease.3.Involvement of autophagy in muscle atrophy[J],Am J Phys Cell Phys,2010,298(6):1291~1297.
[3] Hussey S,Terebiznik M R,Jones N L.Autophagy: Healthy and self-digestion for gastroenter-ologists[J].PediatrGastroenterol Nutr,2008, 46(5): 496~506.
[4] BejaranoE, Cuervo A M.Chaperone-mediated autophagy[J].Proc Am ThoracSoc, 2010, 7(1): 29~39.
[5] GengJ,BabaM,Nair U ,et al.Quantitative analysis of autophagy-related protein stoichiometry by fluorescence[J].Semin Cell Dev Biol. 2008, 182(1): 29~40.
[6] BumanC,Ktistakis NT.2010.Regulation of autophagy by phosphatidylinositol3-phosphate.FEBS Letters, 584(7): 1 302~1 312.
[7] Jung CH, RoSH, Cao J etal.2010.mTOR regulation of autophagy. FEBS Letters, 584(7): 1 287~1 295.
[8] 張秀春,李丹妮,李 豐.細(xì)胞的調(diào)控通路與腫瘤[J].生命科學(xué),2011,23(1):19~25.
[9] Kang R, ZehHJ, LotzeMT. et al.Bcl-2 complexed with Beclin-1 maintains full anti-apoptotic function[J].Oncogene, 2009, 28(21): 2 128~2 141.
[10] Cao Y, KlionskyDJ. Physiological functions of Atg6/Beclin1: a unique autophagy-related protein[J]. Cell Res, 2007, 17(10): 837~849.
[11] Yang L Li P, FuS, etal. Autophagy in obesity promotes ER stress and causes insulin resistance.Cell Metab,2010,11(6): 467~478.
[12] He C, BassikMC, MoresiV, etal. Exercise-induced BCL2-regulated autophagy is require for muscle glucose homeostasis. Nature, 2012, 481(7 382): 511~515.
[13] 錢 林,胡小宣.非酒精性脂肪肝分子發(fā)病機(jī)制的研究進(jìn)展[J],世界華人消化雜志,2008,9,8;16(25):2 848~2 852.
[14] YoungjeonLee, Joo-HeonKim, YunkyungHong, etal. Prophylactic effects of swimming exercise on autophagy-induced muscle atrophy in diabetic rats. Laboratory Animal Researh 2012: 28(3), 171~179.
[15] Holton JL, BeesleyC, JacksonM, etal. Autophagic vacuolar myopathy in twin girls. Neuro-patholAppl Neurobiol, 2006, 32(3):253~259.
[16] He C, BassikMC, MoresiV, etal. Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis. Nature, 2012, 481(7382): 511~515.
[17] MasieroE, AgateaL ,MammucariC, etal. Autophagy is required to maintain muscle mass[J].Cell Metab, 2009, 10(6): 507~515.
[18] SalminenA, KaarnirantaK,Kauppinen A.Beclin-1 interactome controls the crosstalk between apoptosis,autophagy and inflammasomeactivation; Impact on the aging process[J],Ageing Res Rev, 2012, 12(2): 520~534.
[19] SalminenA,KaarnirantaK,KauppinenA.Crosstalk between Oxidative Stress and SIRT1: Impact on the aging process[J],Int J Mol Sci,2013,14(2): 3 834~3 859.
[20] Yan Z,Lira V A, Greene N P.Exercise training-induced regulation of mitochondrial quality[J]. Exerc Sport Sci Rev, 2012, 40(3):159~164.
[21] Wohlgemuth S E, Seo A Y,MarzettiE,etal.Sketetal muscle autophagy and apoptosis during aging: effects of calorie restriction and life-long exercise[J]. Exp Gerontol,2010, 45(2): 138~148.
[22] Sun M, ShenW,ZhongM etal. Nandrolone attenuates aortic adaptation to exercise in rats[J]. Cardiovasc Res, 2013, 97(4):686~695.
[23] Kim J H, Kwak H B, LeeuwenburghC, etal. Lifelong exercise and mild(8%)caloric restriction attenuate age-induced alterations in plantaris muscle morphology, oxidative stress and IGF-1 in the Fischer-344 rat[J]. Cardiovasc Res, 2013, 97(4): 317~329.
[24] FengZ, BaiL, YanJ, etal. Mitochondrial dynamic remodeling in strenuous exercise-induced muscle and mitochondrial dysfunction:regulatory effects of hydroxytyrosol[J]. Free RadicBiol Med, 2011,50(10): 1 437~1 446.
Research Progress of Autophagy in Skeletal Muscle Cells
LI En1, YE Kui1, SU Quansheng2
Cell autophagy is a common life phenomenon that exists in eukaryotic cells. Cellular proteins and organelles deformation, aging or damage can occur through cell autophagy to dissolve enzyme to digest the degradation in the body. Cell autophagy level adjustment, can rise by appropriate exercise intensity, and degradation of cell damage organelles and metabolic waste, at the same time for effective training to regulate cell autophagy related signaling pathways, have important role on skeletal muscle quality.
Movement; Cell autophagy; Skeletal muscle; Insulin resistance
G804.7
A
2016-01-04
1.雅安職業(yè)技術(shù)學(xué)院,四川 雅安,625000;2.成都體育學(xué)院,四川 成都,610042。1.Ya'an Polytechnic College, Ya'an Sichuan, 625000, China;2. Chengdu Sport University, Chengdu Sichuan, 610042,China.

