反轉(zhuǎn)錄環(huán)介導等溫擴增技術(shù)對丙型肝炎病毒可視化分型檢測
趙 娜,劉金霞,孫殿興
?
反轉(zhuǎn)錄環(huán)介導等溫擴增技術(shù)對丙型肝炎病毒可視化分型檢測
趙娜1,2,劉金霞2,孫殿興2
1.承德醫(yī)學院病原生物學教研室,承德067000;2.中國人民解放軍白求恩國際和平醫(yī)院全軍肝病診治中心,石家莊050082
摘要:目的應用反轉(zhuǎn)錄環(huán)介導等溫擴增技術(shù)(RT-LAMP)可視化檢測丙型肝炎病毒(HCV)1b和2a基因型,為RT-LAMP技術(shù)應用于現(xiàn)場或基層醫(yī)院提供初步探索經(jīng)驗。方法首先,收集臨床陽性樣本并用熒光定量PCR分型檢測,把樣本基本分為1型和非1型。然后分別根據(jù)HCV 1b和2a基因型設計RT-LAMP引物并優(yōu)化反應條件,通過互換模板實驗驗證這2套引物的特異性,并通過檢測稀釋的模板以驗證引物的靈敏度。同時用鈣黃綠素進行產(chǎn)物顯色,使HCV分型檢測可視化。最后用RT-LAMP方法檢測臨床樣本,并計算陽性率,應用配對卡方檢驗比較RT-LAMP和熒光定量PCR的統(tǒng)計學差異。結(jié)果優(yōu)化好的RT-LAMP體系的特異性好,對HCV 1b型的檢測靈敏度為103 IU/mL,2a型的檢測靈敏度為104 IU/mL。另外,利用鈣黃綠素進行產(chǎn)物檢測的效果和電泳結(jié)果相當。通過對臨床樣本分型檢測,HCV 1b型樣本的RT-LAMP檢測結(jié)果和熒光定量PCR差異無統(tǒng)計學意義(P>0.05),HCV 2a型樣本的RT-LAMP檢測結(jié)果和熒光定量PCR差異有統(tǒng)計學意義(P<0.05),但是未檢出的樣本中有2例為HCV 2b型。結(jié)論RT-LAMP對HCV的可視化分型檢測具有較好的特異性和靈敏度,操作簡便,具有在現(xiàn)場或基層醫(yī)院的應用前景。
關(guān)鍵詞:丙型肝炎病毒(HCV);反轉(zhuǎn)錄環(huán)介導等溫擴增(RT-LAMP);分型檢測
Supported by the Medicine and Hygiene Research Foundation of the PLA (No. CBJ14C010)
丙型肝炎病毒(Hepatitis C virus,HCV)是僅次于乙型肝炎病毒引起慢性肝炎的主要病原體,如果不進行正確治療,將有相當比例的患者會發(fā)展為肝硬化甚至肝癌。根據(jù)HCV序列之間超過30%的差異,可將HCV主要分為6個基因型,每一型又可細分為不同的亞型。HCV基因分型檢測具有重要的臨床意義:1)HCV基因型分布具有地區(qū)差異。在湖北以1b型為主,其次為2a型[1],在山東則以2a型為主,其次為1b型[2]。我國HCV的流行株幾乎全部是1b型和2a型。2)不同基因型患者的臨床表現(xiàn)也不同。眾多學者認為1b型與肝硬化和肝癌有密切關(guān)系[3-5],也有學者提出1b型患者的肝硬化程度還與甘油三酯、脂蛋白等指標有關(guān)[6]。3)不同基因型患者使用干擾素的療效也不同。在干擾素加利巴韋林的治療中,HCV 1型的治療效果劣于非1型[7]。
雖然熒光定量PCR技術(shù)對HCV進行分型在大型醫(yī)院已經(jīng)十分普遍,但是這項技術(shù)對實驗環(huán)境和操作能力有較高的要求,因此無法普及到現(xiàn)場或基層醫(yī)院。反轉(zhuǎn)錄環(huán)介導等溫擴增(Reverse transcription loop-mediated isothermal amplification,RT-LAMP)技術(shù)是一種特異性和靈敏度均較高、操作簡單的等溫RNA擴增技術(shù),尤其是這項技術(shù)對實驗環(huán)境和人員的操作技能要求不高。雖然已經(jīng)有學者介紹過RT-LAMP對HCV的檢測[8-10],但是RT-LAMP對HCV進行分型檢測未見介紹;雖然對HCV分型的方法還有直接測序法、型特異性引物PCR分型法[11]等,但是上述技術(shù)操作繁瑣,不適合在現(xiàn)場或基層醫(yī)院應用。本研究針對1b型和2a型HCV的5′UTR區(qū)保守序列設計分型引物,并使用鈣黃綠素使產(chǎn)物顯色,初步實現(xiàn)了HCV的可視化分型檢測。
1材料與方法
1.1主要試劑病毒RNA提取試劑盒(Viral RNA Mini Kit)購自QIAamp公司,TIANScript cDNA第一鏈合成試劑盒購自凱杰公司,逆轉(zhuǎn)錄酶(M-MLV Reverse Transcriptase)購自Vazyme公司,Bst DNA聚合酶和10×reaction buffer購自NEB公司,重組核糖核酸酶抑制劑(RNA酶抑制劑)購自Invitrogen公司,鈣黃綠素購自Sigma公司,100 bp DNA Marker購自TaKaRa公司。
1.2模板來源收集中國人民解放軍白求恩國際和平醫(yī)院肝病科2015年4月至2015年7月住院患者血清并按照RNA提取試劑盒的操作說明提取RNA,送該院檢驗科用熒光定量PCR進行分型檢測(其靈敏度為1×103IU/mL),選擇HCV RNA含量范圍為1×104~1×107IU/mL的74例樣本,其中1型有38例,非1型有36例。檢驗科另提供HCV RNA含量為1×107IU/mL的HCV 1b和HCV 2a定值質(zhì)控品進行條件優(yōu)化、特異性和靈敏性實驗。另收集10例健康人血清提取RNA后做陰性對照。
1.3RT-LAMP型特異性引物根據(jù)GenBank公布的HCV 1b型(GenBank登錄號:L02836、KC844051、GU451222、AY460204、KC844052、EF638081、EU857431、DQ071885、AB779562、HQ639947、KF676352)和2a型(GenBank登錄號:HQ639938、HQ639939、HQ639943、HQ639944、HQ639945、KC844043、KF676351、KF676352、KP721475)參考序列,應用Clustal Omega軟件進行序列對比,根據(jù)兩型的5′非編碼區(qū)區(qū)段(5′UTR)確定HCV 1b和2a的型特異性位點,然后借助引物設計軟件Primer Explorer V4(http://primerexplorer.jp/e/)設計型特異性引物。型特異性引物設計要求:在F2/B2或F3/B3的3′端有分型位點,在F1c/B1c的5′端有分型位點(但不要求每條引物末端都要有分型位點)。擴增HCV 1b和2a的型特異性引物由上海生工公司合成,引物序列見表1。表1中F3和B3為外引物,F(xiàn)IP(由F1c和F2組成)和BIP(由B1c和B2組成)為內(nèi)引物。
1.4RT-LAMP體系的優(yōu)化RT-LAMP 50 μL反應體系包括:內(nèi)引物(FIP/BIP)、外引物(F3/B3)、dNTPs、甜菜堿、MgSO4、反應緩沖液、Bst DNA聚合酶、AMV、RNA酶抑制劑和RNA模板。逐步改變對擴增影響較大的因素(甜菜堿、MgSO4)的濃度:甜菜堿以0.4、0.8、1.2、1.6 mol/L的濃度順序擴增;MgSO4以2、4、6、8 mmol/L的濃度順序擴增。根據(jù)電泳條帶的亮度確定最優(yōu)反應條件。擴增時間約60 min,擴增溫度為65 ℃,將反應管置于冰上終止反應。
表1HCV 1b和2a型的RT-LAMP引物
Tab.1RT-LAMP primers of HCV genotypes 1b and 2a
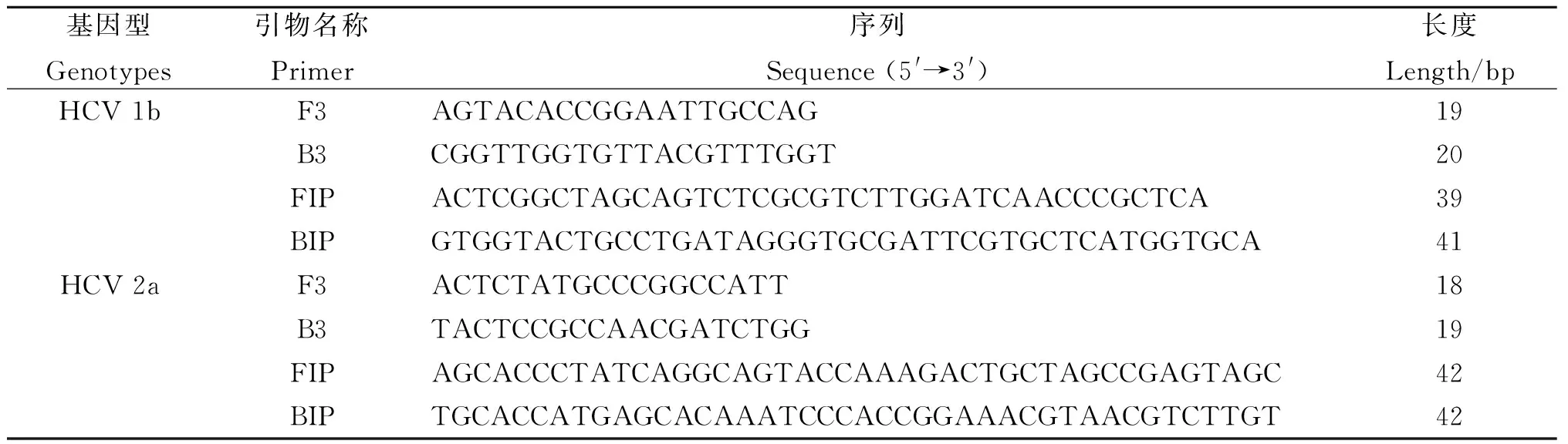
基因型Genotypes引物名稱Primer序列Sequence(5'→3')長度Length/bpHCV1bF3AGTACACCGGAATTGCCAG19B3CGGTTGGTGTTACGTTTGGT20FIPACTCGGCTAGCAGTCTCGCGTCTTGGATCAACCCGCTCA39BIPGTGGTACTGCCTGATAGGGTGCGATTCGTGCTCATGGTGCA41HCV2aF3ACTCTATGCCCGGCCATT18B3TACTCCGCCAACGATCTGG19FIPAGCACCCTATCAGGCAGTACCAAAGACTGCTAGCCGAGTAGC42BIPTGCACCATGAGCACAAATCCCACCGGAAACGTAACGTCTTGT42
1.5擴增結(jié)果判定本研究用以下2種方法進行判斷:1)瓊脂糖凝膠電泳:將5 μL擴增產(chǎn)物上樣于2%瓊脂糖中電泳約40 min,在紫外光下觀察擴增條帶。陽性擴增可見特征性的梯狀條帶,陰性結(jié)果無此現(xiàn)象。2)鈣黃綠素可視化檢測:在反應前向體系中加入1 μL配好的鈣黃綠素和MnCl2混合液(鈣黃綠素和MnCl2的終濃度分別為5 mmol/L和10 mmol/L),反應結(jié)束后將反應管置于黑色背景下裸眼觀察,呈現(xiàn)綠色為陽性,保持橙色為陰性。
1.6分型特異性和靈敏度特異性實驗:分別以HCV RNA質(zhì)控品、健康人RNA提取物和雙蒸水做模板進行RT-LAMP擴增,根據(jù)電泳和染色結(jié)果判定兩套引物的特異性。靈敏度實驗:將HCV 1b和2a質(zhì)控品分別用雙蒸水進行一系列10倍稀釋至102IU/mL,將稀釋后的樣本分別進行RT-LAMP擴增,評價RT-LAMP的靈敏度。將特異性和靈敏度實驗重復4次。
1.7統(tǒng)計學分析RT-LAMP分別將38例1型、36例非1型和10例陰性樣本的RNA進行檢測。以熒光定量PCR為標準,計算陽性率,應用SPSS 17.0軟件對該結(jié)果和熒光定量PCR做McNemar配對卡方檢驗,雙側(cè)檢驗進行統(tǒng)計學推斷,P<0.05為差異有統(tǒng)計學意義。
2結(jié)果
2.1RT-LAMP條件優(yōu)化通過對擴增效率影響較大的甜菜堿和MgSO4進行一系列濃度梯度實驗后,優(yōu)化好的RT-LAMP反應體系為:內(nèi)引物(FIP和BIP)各1.6 μmol/L,外引物(F3和B3)各0.2 μmol/L,甜菜堿 0.8 mol/L,MgSO46 mmol/L,dNTPs 1.4 mmol/L,模板10 μL(HCV RNA含量為1×107IU/mL),8U Bst DNA聚合酶、5 μL 10×反應緩沖液,100 U AMV,20 U RNA酶抑制劑。

(A)RT-LAMP電泳圖:1-4 HCV 1b型的特異性引物對4種模板的檢測結(jié)果,其中,1表示HCV 1b型為模板;2表示HCV 2a型為模板;3表示健康人RNA提取物為模板;4表示雙蒸水為模板;5-8 HCV 2a型的引物對4種模板的檢測結(jié)果,其中5表示HCV 2a位模板;6表示HCV 1b為模板;7表示健康人RNA提取物為模板;8表示雙蒸水為模板。(B)鈣黃綠素可視化檢測效果,各管的排列順序同上。M:100 bp DNA marker。(A) Electrophoresis pattern of RT-LAMP. 1-4: 4 templates detection results by HCV genotype 1b specific primers, among which, 1 indicates HCV genotype 1b as template; 2 indicates HCV genotype 2a as template; 3 indicates RNA extract from healthy human as template; 4 indicates ddH2O as template; 5-8 templates detection results by HCV genotype 2a specific primers, among which, 5 indicates HCV genotype 2a as template; 6 indicates HCV genotype 1b as template; 7 indicates RNA extract from healthy human as template;8 indicates ddH2O as template.(B) Visualized detection by calcein, the order of each tube is the same as above. M: 100 bp DNA marker.圖1 RT-LAMP分型特異性實驗Fig.1 Specificity of genotyping assay by RT-LAMP
2.2分型特異性實驗模板互換實驗驗證HCV 1b型引物特異性:以HCV 1b型質(zhì)控、2a型質(zhì)控、健康人RNA 提取物和雙蒸水為陰性對照模板進行擴增;模板互換實驗驗證HCV 2a型引物特異性:以HCV 2a 型質(zhì)控、1b型質(zhì)控、健康人RNA 提取物和雙蒸水為陰性對照模板進行擴增。電泳結(jié)果如圖1A所示,HCV 1b型特異性引物只使HCV 1b型模板發(fā)生擴增,其他模板均沒有被擴增;HCV 2a型特異性引物只使HCV 2a型模板發(fā)生擴增,其他模板也均沒有被擴增,說明引物未受到其他無關(guān)的RNA的影響,特異性較好。另外,由圖1B可知,鈣黃綠素的可視化效果和電泳結(jié)果相當。4次重復實驗結(jié)果與上述實驗結(jié)果相當。
2.3分型靈敏度實驗RT-LAMP對HCV 1b型質(zhì)控稀釋樣本的擴增結(jié)果如圖2A表示,隨著稀釋倍數(shù)的逐漸增大,模板量從106IU/mL~103IU/mL呈現(xiàn)逐漸減弱的條帶,模板量為102IU/mL未見擴增,可知RT-LAMP檢測HCV 1b型的靈敏度為103IU/mL,這和熒光定量PCR的靈敏度相當。另外,圖2B中鈣黃綠素可視化效果同電泳結(jié)果相當。RT-LAMP對HCV 2a型稀釋樣本的擴增結(jié)果如圖2C所示,隨著稀釋度的逐漸增大,模板量從106IU/mL~104IU/mL呈現(xiàn)逐漸減弱的條帶,模板量為103IU/mL和102IU/mL未見擴增,可知RT-LAMP檢測HCV 2a型的靈敏度為104IU/mL,這比熒光定量PCR的靈敏度低1個數(shù)量級。圖2D中的鈣黃綠素可視化效果同電泳結(jié)果相當。
對HCV 1b和2a質(zhì)控分別重復擴增4次,驗證檢測的重復性。結(jié)果如表2所示,和上述實驗結(jié)果相當,重復性較好。
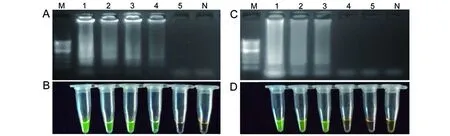
(A)RT-LAMP檢測HCV 1b型的電泳圖,其中,1-5表示HCV RNA含量分別為106、105、104、103、102 IU/mL。(B)RT-LAMP檢測HCV 1b型的鈣黃綠素可視化效果,各管的排列順序同上圖。(C)RT-LAMP檢測HCV 2a型的電泳圖,其中,1-5表示HCV RNA含量分別為106、105、104、103、102 IU/mL。(D)RT-PCR檢測HCV 2a型的鈣黃綠素可視化效果,各管的排列順序同上圖。M:100 bp DNA marker;N:雙蒸水陰性對照。(A) Electrophoresis pattern for detection of HCV genotype 1b by RT-LAMP.1-5 indicate the electrophoresis results of HCV RNA including 106, 105, 104, 103, and 102 IU/mL.(B) Calcein effect for detection of HCV genotype 1b by RT-LAMP, the order of each tubes is the same as above.(C) Electrophoresis pattern for detection of HCV genotype 2a by RT-LAMP. 1-5 indicate the electrophoresis results of HCV RNA including 106,105,104,103,102 IU/mL.(D) Calcein effect for detection of HCV genotype 2a by RT-LAMP, the order of each tube is the same as above.M:100 bp DNA Marker. N: negative control using ddH2O.圖2 RT-LAMP的分型靈敏度實驗Fig.2 Genotyping sensitivity assay of RT-LAMP
表2RT-LAMP的重復性實驗Tab.2Repeatability assay of RT-LAMP
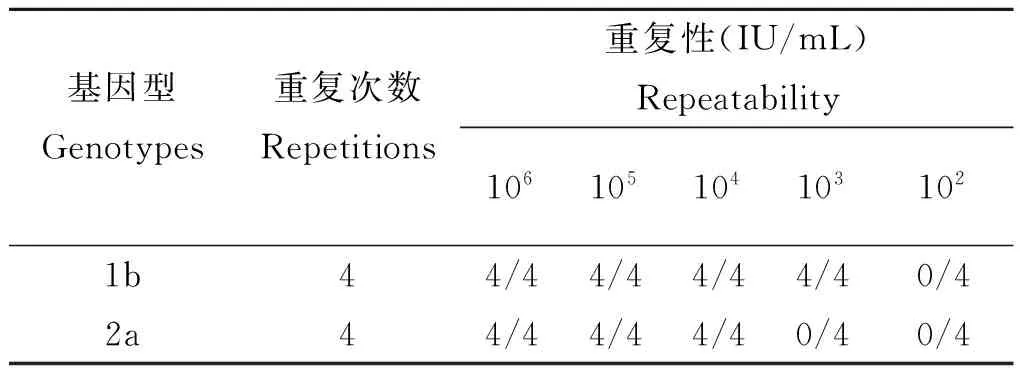
基因型Genotypes重復次數(shù)Repetitions重復性(IU/mL)Repeatability1061051041031021b44/44/44/44/40/42a44/44/44/40/40/4
2.4臨床樣本的分型檢測RT-LAMP分別擴增經(jīng)熒光定量PCR檢測的38例HCV 1型、36例HCV非1型和10例陰性對照。計算陽性率,應用SPSS17.0軟件,配對卡方檢驗對擴增結(jié)果進行統(tǒng)計學分析,結(jié)果如表3所示。
對HCV 1b型樣本的檢測結(jié)果:RT-LAMP法檢出34例,陽性率為89.47%,和熒光定量PCR的差異沒有統(tǒng)計學意義(P>0.05);對HCV 2a型樣本檢測結(jié)果:RT-LAMP法檢出30例,陽性率為83.33%,經(jīng)配對卡方檢驗,和熒光定量PCR的差異有統(tǒng)計學意義(P<0.05)。對RT-LAMP未檢出的樣本凝膠電泳后的產(chǎn)物送測序,結(jié)果未檢出的4例1型樣本為HCV 1a型;未檢出的6例非1型樣本中有兩例為HCV 2b型,另4例其HCV RNA含量約為103IU/mL,低于RT-LAMP對HCV 2a型的檢測靈敏度(104IU/mL)。
表3RT-LAMP的臨床分型結(jié)果
Tab.3Clinical genotyping results of RT-LAMP
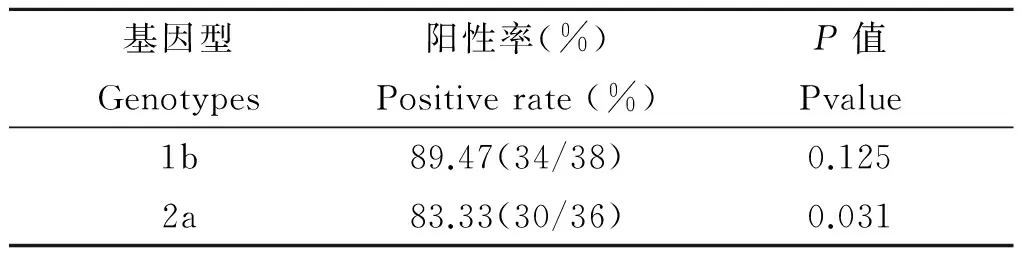
基因型Genotypes陽性率(%)Positiverate(%)P值Pvalue1b89.47(34/38)0.1252a83.33(30/36)0.031
3討論
本研究應用RT-LAMP對HCV進行可視化分型檢測,為HCV 1b和2a這兩類基因型不同的患者的臨床治療提供一定的科學依據(jù),有利于在現(xiàn)場或基層醫(yī)院的丙肝患者的個體化治療。
使用RT-LAMP對HCV分型檢測有如下優(yōu)勢:第一,操作的優(yōu)勢。本研究操作簡單、設備廉價,僅需一臺保證恒溫的普通水浴箱即可,不用如熒光定量PCR昂貴的儀器,也不用設定退火延伸的溫度值、循環(huán)次數(shù)等參數(shù)。第二,引物的優(yōu)勢。只有所有引物同時識別靶序列才啟動擴增,靶序列上的任何區(qū)域與引物不匹配均不能完成擴增,從而保證其特異性和靈敏度。第三,結(jié)果判定的優(yōu)勢。本研究選用染料鈣黃綠素進行顯色,這種染料不抑制擴增反應,所以可以在擴增前加入反應管,擴增后用裸眼觀察反應管的顏色變化即可,不但避免了反應后開蓋帶來的氣溶膠污染問題,而且具有和電泳檢測相當?shù)男Ч庇^性好。
本研究建立的RT-LAMP技術(shù)為HCV的分型檢測提供了初步探索經(jīng)驗。如果對該技術(shù)做進一步的完善,如檢測不常見的HCV基因型或研制一體化、自動化的檢測裝置,將更有利于該技術(shù)在現(xiàn)場或基層醫(yī)院的推廣,有利于丙肝患者個體化治療的發(fā)展。
參考文獻:
[1] Peng J, Lu Y, Liu W, et al. Genotype distribution and molecular epidemiology of hepatitis C virus in Hubei, Central China[J]. PLoS One, 2015, 10(9): e0137059. DOI: 10.1371/journal.pone.0137059
[2] Zhang LX, Wang L, Xu WS, et al.Study of the distribution of HCV genotypes and serotypes in Shandong province[J]. J Clin Hepatol, 2005, 21(4): 215-216. (in Chinese)
張立新, 王磊, 徐皖蘇, 等.山東地區(qū)丙型肝炎病毒的基因型及血清學分型的研究[J]. 臨床肝膽病雜志, 2005,21(4):215-216.
[3] Bruno S, Crosignani A, Maisonneuve P, et al. Hepatitis C virus genotype 1b as a major risk factor associated with hepatocellular carcinoma in patients with cirrhosis: a seventeen-year prospective cohort study[J]. Hepatol (Baltimore, Md), 2007, 46(5): 1350-1356. DOI: 10.1002/hep.21826
[4] Raimondi S, Bruno S, Mondelli MU, et al. Hepatitis C virus genotype 1b as a risk factor for hepatocellular carcinoma development: a meta-analysis[J]. J Hepatol, 2009, 50(6): 1142-1154. DOI: 10.1016/j.jhep.2009.01.019
[5] Sangiovanni A, Iavarone M. Hepatitis C virus genotype 1b, cirrhosis, and risk of hepatocellular carcinoma[J]. Hepatol (Baltimore, Md), 2008, 47(1): 357; author reply -8. DOI: 10.1002/hep.22060
[6] Nagano T, Seki N, Tomita Y, et al. Impact of chronic hepatitis C virus genotype 1b infection on triglyceride concentration in serum lipoprotein fractions[J]. Intl J Mol Sci, 2015, 16(9): 20576-20594. DOI: 10.3390/ijms160920576
[7] Xie ZB, Zhou JL, Li YZ, et al. The characteristics and clinical significance of HCV genotypes in huaihua area of Hunan province[J]. China J Mond Med, 2013, 23(31): 43-46. (in Chinese)
謝知兵, 周建亮, 李勇忠, 等. 懷化地區(qū)丙肝基因分型分布及臨床意義[J]. 中國現(xiàn)代醫(yī)學雜志, 2013,23(31):43-46.
[8] Kargar M, Askari A, Doosti A, et al. Loop-mediated isothermal amplification assay for rapid detection of hepatitis C virus[J]. Indian J Virol, 2012, 23(1): 18-23. DOI: 10.1007/s13337-012-0067-2
[9] Wang QQ, Zhang J, Hu JS, et al. Rapid detection of hepatitis C virus RNA by a reverse transcription loop-mediated isothermal amplification assay[J]. FEMS Immunol Medical Microbiol, 2011, 63(1): 144-147. DOI: 10.1111/j.1574-695X.2011.00828.x
[10] Yang J, Fang MX, Li J, et al. Detection of hepatitis C virus by an improved loop-mediated isothermal amplification assay[J]. Arch Virol, 2011, 156(8): 1387-1396. DOI: 10.1007/s00705-011-1001-4
[11] Margall N, March F, Espanol M, et al. Two unusual hepatitis C virus subtypes, 2j and 2q, in Spain: Identification by nested-PCR and sequencing of a NS5B region[J]. J Virologi Methods, 2015, 223: 105-108. DOI: 10.1016/j.jviromet.2015.07.022
DOI:10.3969/j.issn.1002-2694.2016.04.013
通訊作者:劉金霞,Email:1158210524@qq.com
中圖分類號:R373
文獻標識碼:A
文章編號:1002-2694(2016)04-0383-05
Corresponding author:Liu Jin-xia, Email: 1158210524@qq.com
收稿日期:2015-10-26修回日期:2015-12-20
Visual genotyping detection of HCV by reverse transcription loop-mediated isothermal amplification technique
ZHAO Na1,2, LIU Jin-xia1, SUN Dian-xing2
(1.ChengdeMedicalUniversity,Chengde067000,China;2.BethuneInternationalPeaceHospital,Shijiazhuang050082,China)
Abstract:Reverse transcription loop-mediated isothermal amplification (RT-LAMP) method was applied to detect hepatitis C virus(HCV) genotypes 1b and 2a visually, and provided prelimary exploration experience for its promotion at field or in primary care hospitals. First, clinical samples were collected and genotyped by fluorescent quantitative PCR, which could genotype these samples into HCV 1 genotype and non-1 genotype in general. After that, RT-LAMP primers were designed according to HCV genotypes 1b and 2a, the reaction condition was tested for optimization. The specificity of the 2 sets of primers was validated by interchange of templates. The sensitivity of the 2 sets of primers was validated through detection of dilute templates. In the meantime, products strain was realized by calcein for visual HCV genotyping detection. At last, clinical samples were detected by RT-LAMP, and positive rate of RT-LAMP was calculated, the chi-square test was applied to compare the RT-LAMP with fluorescent quantitative PCR. Results showed that optimized RT-LAMP had good specificity,which the sensitivity for detection of HCV genotype 1b was 103 IU/mL and for HCV genotype 2a was 104 IU/mL, respectively. In addition, calcein showed the same effect with electrophoresis in products detection. After detection of clinical samples, RT-LAMP had no statistics difference with fluorescent quantitative PCR (P>0.05)for detection of HCV genotype 1b. RT-LAMP had statistics difference with fluorescent quantitative PCR (P<0.05) for detection of HCV genotype 2a, but we found that there were two HCV 2b samples in the undetected samples. In conclusion, the RT-LAMP method performs well for visualized genotyping detection of HCV. It is easy to operate, with good specificity and sensitivity, and has the application prospect at field or in primary care hospitals.
Keywords:hepatitis C virus (HCV); reverse transcription loop-mediated isothermal amplification (RT-LAMP); genotyping detection
全軍醫(yī)藥衛(wèi)生科研基金項目(No.CBJ14C010)資助

