酰腈化合物的合成和應用
葉素斌,徐宏烈,林婷婷,劉志濱(浙江普洛醫藥科技有限公司,浙江 東陽322118)
?
酰腈化合物的合成和應用
葉素斌,徐宏烈,林婷婷,劉志濱*
(浙江普洛醫藥科技有限公司,浙江東陽322118)
摘要:分別介紹了以酰鹵和金屬氰化物、K4[Fe(CN)6]和芳酰鹵、α-溴-苯乙腈、炔醛為原料的四種酰腈化合物的合成方法,以及酰腈化合物在有機合成中的應用。
關鍵詞:酰腈;合成;應用
修回日期:2015-08-24
酰腈化合物的分子結構特點是羰基連著氰基,兩種功能基團都能夠參與反應,其應用也十分廣泛。S.Hünig等[1]發表的“酰腈化學”綜述中提到:“早在1882年就首次報導了酰腈,直至1956年文獻都未見過酰腈化學的綜述”。近年來,該類化合物的重要性不斷增加,新的合成方法效果顯著,例如已經應用到雜環化合物的結構上(除草劑),進一步調查研究,我們認為是值得做的。時至今日又過去了30多年,酰腈化學的發展更為迅速,相關的應用更為廣泛,有趣的新成果不斷出現,令人鼓舞,適時歸納和總結是有益的。
1 酰腈化合物的合成
1.1酰鹵與金屬氰化物反應
酰鹵有芳烴的、取代芳烴的或脂肪烴(烷烴、烯烴)類的,以酰氯或酰溴為主。氰源有金屬氰化物,例如氰化鉀(KCN)、氰化鈉(NaCN)、氰化亞銅(CuCN)、氰化亞鉈(TlCN)、氰化三丁基錫(Bu3SnCN)等;非金屬氰化物,例如氰化四乙基銨(Et4NCN)等;再配合適當的催化劑或助劑以及溶劑在一定的溫度下反應就可以制得相應的酰腈化合物。S.Hünig等[1]作了如下歸納,見表1。


表1 酰鹵與金屬氰化物的反應
另外,羧酸酐與無水氫氰酸(HCN)或堿金屬氰化物在50℃~250℃也可制得酰腈。羧酸酐還可以與三甲基氰硅烷(Me3SiCN)在催化劑(如Zn Cl2,AlCl3,NaCN,Et3N)存在下,以溶劑稀釋于50℃~250℃反應可獲得高收率酰腈。
1.2無毒亞鐵氰化鉀作為氰源與芳酰鹵反應
李政等[2]用無毒亞鐵氰化鉀(K4[Fe(CN)6])作為氰源代替劇毒的堿金屬氰化物及碘化銀-聚乙二醇-400-碘化鉀(AgI-PEG400-KI)作為催化體系,分別采用取代的苯甲酰氯、2-呋喃酰氯及2-噻吩酰氯作底物,在室溫下用DMF作溶劑,反應8~10 h,獲得芳酰腈化合物,收率為60%~89%,反應如下所示:

催化量的AgI能提高反應收率,Ag+離子能促進K4[Fe(CN)6]釋放出(CN)-離子,PEG400作為相轉移催化劑能夠與K4[Fe(CN)6]形成穩定的絡合物((K-PEG400)+及(Fe-PEG400)2+),釋放出可供利用的(CN)-離子。KI能改進AgI的溶解性,提高I-離子在溶液中的濃度,并且作為一個好的離去基團能有效地與苯甲酰氯交換Cl-離子,促進親核取代反應的進行。采用非質子極性溶劑DMF使反應收率獲得最佳化。
當苯環上有吸電子或給電子取代基時,上述反應條件仍然適宜。由TLC和GC分析顯示幾乎無二聚物產生。雜環芳酰氯(2-呋喃酰氯、2-噻吩酰氯)同樣獲得好結果。
1.3硝酸羥腈酯中間體轉化為酰腈[3]
硝酸有機酯應用廣泛,例如制造炸藥、火箭燃料,以及護理心臟藥物等。其中硝基有建議為擬鹵化物,其α-氫易消去,如此硝酸烷基酯就轉變為羰基化合物。當采用α-溴代芳基乙腈與硝酸銀反應,一個平穩的過渡就可獲得高收率的芳酰腈,反應過程如下:

化合物1可用芳乙腈與NBS反應制得,當1 與AgNO3進行親核取代反應生成AgBr和硝酸羥腈酯中間體2,后者有一定的穩定性,當消去亞硝酸時獲得產物酰腈3。在相同的反應條件下,芳環上有給電子取代基時(如MeO-,Me-)仍可獲得好收率,而吸電子基團在間位時(如m-Br,m-MeOC (O)-)其原料反應不完,并無中間體2存在。酰腈最佳合成示例如下:
1(196.0 mg,1 mmol)和AgNO3(220.8 mg,1.3 mmol)混合于乙腈(10 mL)中,在N2下加熱至50℃,5 h,冷卻過濾,濾液真空濃縮,再加入己烷或CH2Cl2攪拌過濾,并將濾液真空濃縮,獲得無色固體,即反應的粗品,用己烷于-78℃重結晶,得純品3(103.9 mg,收率78%)白色固體,3的1HNMR,IR和GC-MS數據與可信的相對應標樣一致。
1.4α,β-不飽和酰腈的合成[4]
將有機功能團正常反應性能顛倒為多樣性的新反應,稱該發現為極反轉(umplung),由此就擴大了新鍵形成以及功能團轉換的機遇。將炔醛進行立體有擇氧化還原氰化制得α,β-不飽和酰腈化合物是采用三乙胺(TEA)作為Lewis堿和Br?nsted堿的雙重催化作用,三甲基氰硅烷(Me3SiCN或TMSCN)作為氰源,二者成為炔醛極反轉中間體的有效試劑,該親核中間體能夠被等摩爾量的乙醇所質子化,有效地促進轉化為α,β-不飽和酰腈。炔醛的催化氧化還原氰化反應如下:

反應條件:炔醛(1)(0.4 mmol),TMSCN (0.48 mmol),堿催化劑(0.12 mmol),添加劑(0.4 mmol),THF(0.4 mol/L),室溫,在N2下,用石英填料過濾樣品后,1HNMR譜內標測定。

合理的催化循環機理
1的氧化還原氰化反應機理是以三乙胺(TEA)作為Lewis堿催化醛的三甲基氰硅烷(TMSCN)化開始的,生成酰腈的三甲基硅烷醚(I);三乙胺又作為Br?nsted堿脫質子化酸式醛質子(II)進行H-遷移,形成α-三甲基硅氧丙二烯氰化物(III),該丙二烯中間體水解,借助三乙胺進行結構互變異構為α,β-不飽和酰腈2。
2 酰腈化合物的應用
2.1α-氨基酮的合成[5]
α-氨基酮是有多種用途的雙官能團化合物,它們在有機合成中具有廣泛的應用范圍,例如作為含氮雜環的結構單元。酰腈轉變為α-氨基酮的例子是研究Stephen還原(SnCl2/HCl)芳酰腈1轉變為相應的α-氨基苯乙酮2(又稱為芳酰甲胺)的:
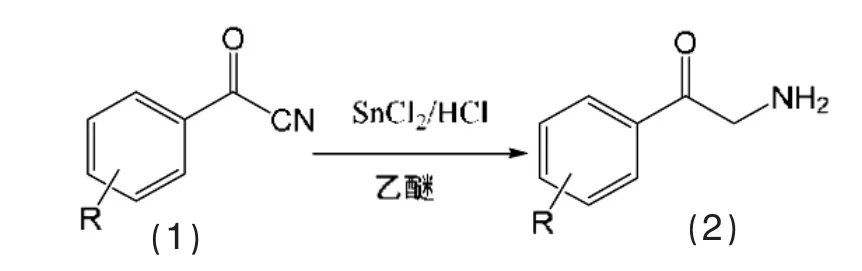
在室溫下,將無水SnCl2(28.0 g,0.15 mol)加到用干燥HCl(g)飽和的無水乙醚(100 mL)反應容器內,同時置于冰水浴中冷卻,在攪拌下滴加0.1 mol的芳酰腈,混合反應3 h后過濾,將固體物懸浮在含鹽酸5 mL的500 mL水中,再通入H2S(g)使其飽和,過濾除去硫化錫,濾液置于旋轉蒸發器中脫去水,收集殘留的芳酰甲胺鹽酸鹽,用丙酮-乙醚純化結晶。
在脂肪族酰腈中,類似的轉變也是可行的,例如:

3-甲酰腈丙酸甲酯1在鋅/乙酸中,當有過量的乙酸酐存在時,是徹底還原的,以高收率獲得結晶化合物5-氨基-4-氧代-戊酸鹽酸鹽,總收率60%。
而苯甲酰腈的鋅還原不能獲得相應的氨基酮,唯一產物是低收率(30%)的苯甲醛的羥腈[5]。

2.2酰腈的還原性偶合[6]
烷基膦試劑如三甲基膦(PMe3)或三丁基膦(PBu3)在中等反應條件下,可促進酰腈還原性偶合獲得高收率的取代羥腈:

典型反應工藝:將芳酰腈1(0.5 mmol)與PMe3(0.5 mL,0.5 mmol,THF 1.0 mol/L)于反應瓶內攪拌混合6 h,然后將反應溶液在減壓下濃縮,殘留物用閃蒸色譜法于硅膠上純化(洗脫液:乙酸乙酯/石油醚=1/20)獲得純品羥腈2。
對于酰腈還原性偶合似乎合理的機理如下所示,酰腈1多半是活化的,由膦化物或亞膦酸酯形成的中間體A或A’,與其對應的中間體B 或B’是平衡的;就以A或A’的按以下步驟親核進攻,獲得中間體C,緊接著從PMe3或PBu3發生一個H轉移到與CN基團相連的碳上,獲得產物羥腈,以及相應的膦氧化物,是以環境的潮濕逐漸完成反應時而產生HCN。氫的轉移僅僅是在R’或R’’為烷基時才發生,驅動力使平衡朝著形成最終產物的方向運行。當PR3’為P(OBu)3在中間體C中時,反應不能得到最終產物,將逆向返回中間體A和A’或B和B’反應性中間體。另外,所生成的HCN要被0.5當量膦化物或亞膦酸酯于反應期間所猝滅,此為使用50 mol% PMe3和50 mol% P(OBu)3之原由。該反應性偶合的關鍵在于烷基膦的促進。

2.3β-酮酯的合成[7]
酰腈作為親電子試劑與α-鹵代酯在銦(In)參與下的一個典型的Reformatsky反應如下:

酰腈1與溴代乙酸乙酯2在In及超聲波存在時反應生成β-酮酯3。因為In介入,溶劑的選擇至關重要,結果THF是對于反應時間和收率最為穩定的溶劑。聲波輻射能加速反應,是由于空化作用,使金屬銦表面活化,易與酰腈偶合而獲得β-酮酯。當酰腈:金屬銦:溴乙酸乙酯=1∶1.5∶2時,獲得收率為最佳。
典型工藝如下:將In(176 mg,1.5 mmol)加到溴乙酸乙酯2(334 g,2.0 mmol)的THF(3 mL)溶液中,在室溫下攪拌30 min,加入苯甲酰腈1 (131 mg,1.0 mmol)的THF(1 mL)溶液,在超聲波處理下,于室溫反應2 h,經TLC測試,待反應完成,將反應物倒入水中,用乙醚提取,合并有機層,硅膠柱層析純化(己烷:乙酸乙酯=6∶1)得苯甲酰基乙酸乙酯3(169 mg),收率88%。

2.4掩蔽酰腈試劑的應用[8]
掩蔽酰腈(masked acyl cyanide)(MAC)試劑用作對映選擇性Michael反應,加成到取代烯酮上,顯示為有效的極反轉合成子,反應是采用手性方形酰胺催化的,獲得高收率加成產物(90%~ 99%)以及極佳的對應選擇性(85%~98%)。所謂的掩蔽酰腈(MAC)實際上是羥基丙二腈受到有效的極反轉合成子的保護。即MAC試劑與α-烯酮用堿處理生成等價的親核酰基負離子,可與各種親電單元結構反應,發生脫MAC生成中間狀態的酰腈,就此與醇或胺等攔截生成相應的羧酸、酯或酰胺。
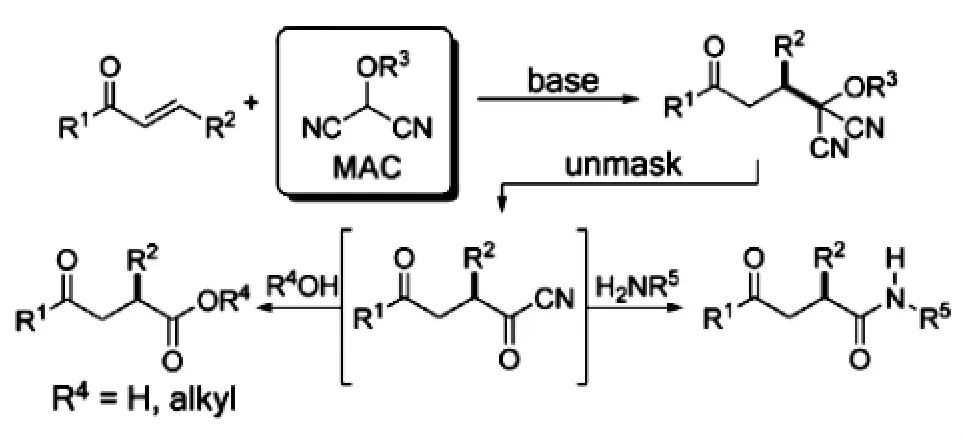
圖經由MAC試劑加成為1,4-二羰基化合物

表2 方形酰胺催化的MAC加成反應底物類型a

通常范圍廣泛的烯酮都能獲得較高的收率及對映選擇性,很顯然TBS-MAC試劑4對于對映選擇性Michael反應是有效的,4與2比較起來顯示出低的反應性,要完成反應就要較長的反應時間和較高的溫度,才能提供類似的對映選擇性。當烯酮β-位具備缺電子的芳基,將獲得極好的結果(項目2~3)。而對甲氧基苯基烯酮1d就要較高反應溫度及以降低對映選擇性為條件(項目4)。Michael加成采用萘烯酮1e及各種雜芳烴取代的烯酮(項目5~9)均為有效。共軛烯酮1j的β-位選擇性反應以好收率和對映選擇性(項目10)形成加成物。相關的取代二烯酮1k提供的加成產物的對映選擇性有了明顯降低,與其降低的反應性相一致(項目11)。值得注意的是烯酮1l含一個游離酚(項目12),說明底物中的酸性氫鍵,對于供電子基團具耐受性。還有含苯并三氮唑的烯酮1m(項目13)也成功使用。
MAC試劑與具伯烷基取代的烯酮進行反應能夠很好地進行,接近定量收率及高對映選擇性的加成物(項目14~16)。對于較大空間位阻的環己基-烯酮1q(項目17)需要在室溫進行反應,仍然能獲得89% ee的產物。而環丙烷基-烯酮1r(項目18)具更強的反應性,以極好的收率和選擇性獲得加成物。MOM-MAC試劑與三氟甲基取代的烯酮1s的Michael反應能很好地進行,可以獲得含三氟甲基基團的手性單元。
3 結論
綜合以上方法,酰鹵可以通過和金屬氰化物或亞鐵氰化鉀反應生成相應的酰腈。也可以選用α-溴-苯乙腈、炔醛為原料制備相應的酰腈。選擇合適的酰腈化合物合成方法,從收率、環保等方面考慮,對工業生產有重大意義。
參考文獻:
[1] Siegfried H,Rainer S. The chemistry of acyl cyanides[J]. Angew. Chem. Int. Ed. Engl.,1982,21:36-49.
[2] Li Z, Shi S Y, Yang J Y. AgI-PEG400-KI catalyzed environmentally benign synthesis of aroyl cyanides using potassium hexacyanoferrate (11) as the cyanating agent[J]. Synlett, 2006, 15:2495-2497.
[3] Takuya S, Masashi S, Kiyoharu N. A new convenient synthesis of aroyl cyanides via the formation of cyanohydrin nitrate intermediates[J]. Tetrahedron Letters, 2008,49:5070-5072.
[4] Hyang H C, Young H S. Min S J, et al.α,β- Unsaturated acyl cyanide synthesis via trimethylamine catalyzed redox cyanation [J]. Tetrahedron Letters,2001,52:2312-2315.
[5] Andreas P,Saeed A. Synthesis of α-amino ketones via se lective reduction of acyl cyanides[J]. Tetrahedron Letters, 1984, 25(28):2977-2980.
[6] Zhang W,Shi M. Alkyl phosphines promoted reductive coupling of acyl cyanides: formation o-acyl cyanohydrins [J]. Tetrahedron,2006,62:8715-8719.
[7] Young S P. Facile synthesis of β-ketoesters by indium-mediated reaction of acyl-cyanides with ethyl bromoacetate under ultrasonication[J]. Bull. Korean Chem. Soc.,2005, 26 (6):878-879.
[8] Yang K S, Nibbs A E, Türkmen Y E, et al. Squaramidecatalyzed Enontioselective Michael Addition of Masked A-cyl cyanides to Substituted Enones [J]. J. Am. Chem. Soc., 2013, 135: 16050-16053.
Synthetic Method and Application of Acyl Cyanides Compound
YE Su-bin, XU Hong-lie, LIN Ting-ting, LIU Zhi-bin
(Zhejiang Apeloa Medical Technology Co., Ltd., Dongyang,Zhejiang 322118,China)
Abstract:Four different methods to the synthesis of acyl cyanides were introduced and their application in organic synthesis were discussed. Acyl cyanides can be synthesized by the addition of acyl halide and metal cyanide directly. Metal cyanide can be replaced by potassium ferrocyanide, which can react with aromatic acyl halide to generate acyl cyanides. Another two methods are using alpha-bromo-benzylacetonitrile and ethynylaldehyde as starting materials.
Keywords:acyl cyanide;synthetic method;application
文章編號:1006-4184(2016)2-0023-05
作者簡介:葉素斌(1977-),女,浙江紹興人,工程師,本科,主要從事有機合成研究。
*通訊作者:劉志濱。E-mail: studydeep586@163.com。

