家蠶感染球孢白僵菌后4種抗菌肽基因的表達分析
呂丁丁 侯成香 耿濤 黃玉霞 覃光星 高坤 郭錫杰

摘要:【目的】闡明家蠶(Bombyx mori)抗菌肽對球孢白僵菌感染的應答模式,為揭示家蠶及鱗翅目昆蟲抗真菌機制提供參考依據。【方法】利用實時熒光定量PCR檢測家蠶被球孢白僵菌感染后抗菌肽基因cecropinA、gloverin2、lebocin1/2和lysozyme的表達情況,比較4種抗菌肽在家蠶脂肪體、血淋巴、馬氏管和中腸中不同時間點的表達差異。【結果】經球孢白僵菌誘導后,cecropinA基因在家蠶脂肪體中的最高上調表達倍數為10.2倍,在血淋巴中的最高上調表達倍數為13.2倍,在馬氏管中感染初期顯著上調表達(P<0.05,下同),在中腸中感染后期顯著上調表達;gloverin2基因在家蠶脂肪體中出現2次上調表達過程,最高上調表達倍數為15.7倍,在血淋巴中感染前期呈上調表達,在馬氏管中略呈下調表達,中腸中的gloverin2基因在接種后16~48 h呈顯著上調表達,最高上調表達倍數為6.7倍;lebocin1/2基因在家蠶脂肪體和血淋巴中的最高上調表達倍數分別為19.4和22.4倍,在馬氏管中僅在接種后16 h呈顯著上調表達,在中腸中則是接種后24~48 h呈顯著上調表達;lysozyme基因在家蠶脂肪體中顯著上調表達,在血淋巴和馬氏管中感染初期也呈顯著上調表達,但在中腸中的表達無明顯規律。【結論】cecropinA、gloverin2、lebocin1/2和lysozyme基因在球孢白僵菌侵染家蠶的過程中均不同程度地被誘導上調表達,尤其在家蠶脂肪體和血淋巴中較明顯,由此推測這4種抗菌肽在抵御球孢白僵菌的侵染過程中發揮重要作用。
關鍵詞: 家蠶;球孢白僵菌;抗菌肽;表達水平
中圖分類號: S884.31 文獻標志碼:A 文章編號:2095-1191(2016)11-1952-06
Abstract:【Objective】The present study was conducted to evaluate response pattern of antimicrobial peptides in Bombyx mori against Beauveria bassiana infection in order to provide beneficial reference for researches on antifungal mechanism of B. mori and other lepidoptera insects. 【Method】The expression patterns of antimicrobial peptide genes cecropinA, gloverin2, lebocin1/2 and lysozyme in B. mori after being infected with B. bassiana were detected using real-time fluorescence quantitative PCR. The differential expressions of the four antimicrobial peptide genes in fat body, hemolymph, malpighian tubule and midgut at different time points were compared. 【Result】After being induced by B. bassiana, the expression of cecropinA was up-regulated by 10.2 times to the maximum in fat body and 13.2 times to maximum in hemolymph. The expression of cecropinA was also significantly up-regulated in malpighian tubule at early stage of the infection(P<0.05, the same below), and in midgut at middle-late stages of the infection. Up-regulated expression of gloverin2 occurred twice in fat body and the maximum re-regulated expression multiple was 15.7 times. The expression of gloverin2 up-regulated in hemolymph at earlier stage but down-regulated in malpighian tubule. It also up-regulated in mindgut after 16-48 hours of infection, with maximum up-regulated multiples reaching 6.7 times. The expression of lebocin1/2 up-regulated in fat body by 19.4 times to utmost limit and by 22.4 times to the maximum in hemolymph. It also up-regulated significantly in malpighian tubule after 16 hours of infection and in midgut after 24-48 hours of infection. The expression of lysozyme significantly up-regulated in fat body, and also significantly up-regulated in hemolymph and malpighian tubule at earlier stage of infection. But the expression in midgut showed no obvious regulation. 【Conclusion】The expressions of antimicrobial peptide genes cecropinA, gloverin2, lebocin1/2 and lysozyme up-regulated to different extents after B. mori infected by B. bassiana, especially in fat body and hemolymph of B. mori. The results suggest that cecropinA, gloverin2, lebocin1/2 and lysozyme may play important roles in B. mori antifungal process against B. bassiana infection.
Key words: Bombyx mori; Beauveria bassiana; antimicrobial peptide; expression characteristics
0 引言
【研究意義】家蠶(Bombyx mori)的先天性免疫系統包括細胞免疫應答和體液免疫應答。體液免疫應答主要是合成和釋放若干抗微生物肽分子,而這些抗菌肽(Antimicrobial peptides,AMPs)均產生于脂肪體、血細胞及上皮組織(呂鴻聲,2008)。家蠶抗菌肽在正常情況下不表達或呈低水平的組成型表達,一旦有外界微生物入侵,即在體內迅速合成與釋放,參與免疫反應。白僵病是危害最嚴重、病勢最急的一種家蠶真菌性傳染病(呂鴻聲等,1990),研究家蠶抗菌肽對球孢白僵菌(Beauveria bassiana)感染的應答模式,對闡明家蠶對白僵菌的體液免疫機制及其防治具有重要意義。【前人研究進展】自1981年Boman和Steiner在惜古比天蠶(Hyatophora cecropia)中發現可誘導抗微生物肽以來,目前已從家蠶中分離鑒定出多種可誘導抗菌肽,如cecropins、defensins、lebocins、gloverins等(Yamano et al.,1994;Chowdhury et al.,1995;Cheng et al.,2006;Kaneko et al.,2007, 2008)。當昆蟲受到免疫刺激時,溶菌酶(lysozymes)在其體內含量迅速升高,并參與免疫應答,因此也常被視為免疫分子(呂鴻聲,2008)。目前,已有研究證實家蠶抗菌肽對革蘭氏陽性細菌或革蘭氏陰性細菌均有抑菌作用(Zhang et al.,1999;Cheng et al.,2006;Xia et al.,2013;姚遠等,2014),但能抑制真菌的家蠶抗菌肽僅有cecropin類,如化學合成的cecropin多肽對馬鈴薯晚疫病菌(Phytophthora infestans)、尖孢鐮刀菌(Fusarium oxysporum)、串珠鐮刀菌(Fusarium moniliforme)等植物病原真菌具有較強的抑菌作用(Cavallarin et al.,1998),而原核表達的家蠶cecropinA在體內外對昆蟲病原真菌球孢白僵菌均具有抗菌作用(Lu et al.,2016)。【本研究切入點】家蠶cecropin類抗菌肽能被革蘭氏陽性細菌和革蘭氏陰性細菌及真菌誘導上調表達,但不能被病毒誘導表達(Cheng et al.,2006;Hong et al.,2008);家蠶脂肪體、馬氏管組織中的gloverin基因能被大腸桿菌誘導上調表達(Kaneko et al.,2007),中腸中的gloverin基因能被家蠶核型多角體病毒誘導上調表達(唐芬芬等,2015);家蠶脂肪體、中腸、馬氏管、血淋巴中的lebocin基因被大腸桿菌誘導后顯著上調表達(Tanaka et al.,2012);家蠶脂肪體、血淋巴和表皮中的lysozyme基因能被革蘭氏陽性細菌誘導上調表達(Lee and Brey,1995)。但這4類抗菌肽在家蠶不同組織中被真菌誘導表達的機制研究鮮見報道。【擬解決的關鍵問題】以球孢白僵菌接種家蠶后,利用實時熒光定量PCR檢測家蠶體內抗菌肽基因cecropinA、gloverin2、lebocin1/2、lysozyme的表達情況,比較4種抗菌肽在家蠶脂肪體、血淋巴、馬氏管和中腸中不同時間點的表達差異,闡明家蠶抗菌肽對球孢白僵菌感染的應答模式,為揭示家蠶及鱗翅目昆蟲抗真菌機制提供參考依據。
1 材料與方法
1. 1 試驗材料
供試家蠶品種p50由中國農業科學院蠶業研究所保存并飼養。球孢白僵菌HN6菌株由中國農業科學院蠶業研究所病理室保存提供,其寄主是家蠶,試驗前經家蠶復壯。Taq DNA聚合酶、RNApure Ultrapure Total RNA Extraction Kit購自北京博凌科為生物科技有限公司;Ex Taq■、RNAiso Plus、PrimeScriptTM 1st Strand cDNA Synthesis Kit、DNA Ligation Kit Ver.2.1、SYBR Premix Ex TaqTM Kit等購自TaKaRa公司。
1. 2 球孢白僵菌接種及家蠶組織收集
HN6菌株在PDA培養基中25 ℃培養7~10 d后,用小鑰勺將培養基上的孢子刮取到200.0 mL含0.01% Tween-20的滅菌ddH2O中,漩渦振蕩至孢子分散,再用加有3層無菌脫脂棉的50.0 mL注射器過濾孢懸液,對過濾獲得的孢懸液進行梯度稀釋并計數,將其濃度調至1×108個/mL。試驗組取350頭5齡起蠶,在孢懸液中浸泡接種15 s后迅速撈起并濾去多余的孢懸液,放置在正常環境進行飼養;對照組的350頭家蠶在含0.02% Tween-20的滅菌ddH2O中浸泡15 s。為防止細菌感染家蠶,孢懸液和對照品的無菌水均添加青霉素—鏈霉素混合溶液。
分別于接種后8、12、16、20、24、30、36、42、48和54 h取材,試驗組和對照組設3個重復,每個重復取10頭家蠶。首先將家蠶置于冰上2 min,剪去一只腹足,收集血淋巴,裝入含0.5 mL RNAiso Plus的凍存管中,再將家蠶固定到解剖臺上,分別解剖收集脂肪體、馬氏管和中腸,組織樣品均用0.9%生理鹽水浸泡洗滌,再裝入含0.5 mL RNAiso Plus的凍存管中。裝有組織樣品的凍存管先放入液氮中速凍,然后-80 ℃保存備用。
1. 3 總RNA提取及cDNA第一鏈合成
將各組織樣品自然解凍,加入200 μL RNAiso Plus,置于冰上用勻漿機充分勻漿破碎,加入RNAiso Plus,血淋巴樣品需用1.0 mL注射器反復吹打,再根據RNApure超純總RNA快速提取試劑盒說明提取總RNA,檢測RNA濃度、純度及其完整性。調整各樣品組織總RNA濃度,根據PrimeScript RT Reagent Kit with gDNA Eraser試劑盒操作說明合成cDNA第一鏈,并以管家基因actin引物對cDNA模板進行PCR檢測。
1. 4 選取靶基因及其引物設計
針對家蠶的cecropin類抗菌肽,選取cecropinA基因(NM_001043997.1)為靶基因;針對gloverin類抗菌肽,選取gloverin2基因(NM_001044218.2)為靶基因;針對lebocin類抗菌肽,選取lebocin1/2基因(NM_001044003.1)為靶基因;針對lysozyme類抗菌肽,選取lysozyme基因(L37416.1)為靶基因。根據實時熒光定量PCR引物設計原則,利用Primer Premier 5.0對4個抗菌肽基因進行引物設計(表1),以家蠶管家基因actinA3(NM_001126254.1)為內參基因。
1. 5 實時熒光定量PCR檢測
實時熒光定量PCR反應體系20.0 μL:10.0 μL 2×SYBR Premix Ex Taq,0.4 μL 50×ROX Reference Dye,0.5 μL正、反向引物(10 μmol/L),1.0 μL稀釋100倍的cDNA模板,ddH2O補足至20.0 μL。擴增程序:95 ℃預變性5 min;95 ℃ 5 s,55 ℃ 15 s,72 ℃ 40 s,進行45個循環。然后按照SYBR Premix Ex TaqTM試劑盒說明在Applied Biosystems 7300 Real-Time PCR System上進行檢測,每個樣品重復3次。獲得的試驗數據采用2-ΔΔCt法進行分析(Livak and Schmittgen,2001)。
1. 6 統計分析
實時熒光定量PCR檢測結果以RQ Study Application Version 1.4進行分析,并采用SPSS 19.0進行差異顯著性分析。
2 結果與分析
2. 1 球孢白僵菌對家蠶的感染致病情況
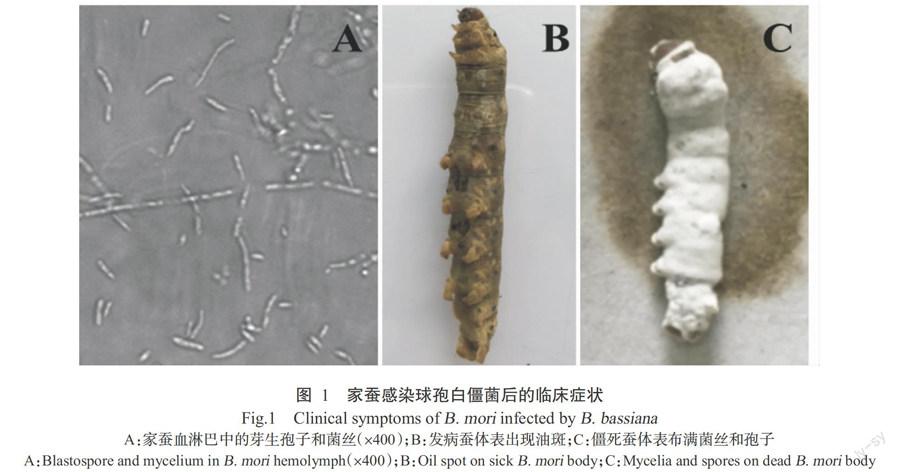
5齡家蠶在接種球孢白僵菌HN6菌株后48 h開始有部分家蠶體表出現油斑,食欲下降,并伴有吐液現象,約在接種后80 h試驗組的所有家蠶體表均出現大面積油斑(圖1-B),瀕臨死亡,至96 h后試驗組家蠶全部死亡。隨機挑選5頭死亡家蠶穿刺腹足采集血淋巴鏡檢,結果發現死亡家蠶血淋巴中有大量球孢白僵菌的芽生孢子和營養菌絲(圖1-A)。將病蠶尸體放在保濕的培養皿中3~4 d后,所有蠶尸體表面布滿白色菌絲和孢子(圖1-C)。對照組家蠶未出現油斑和死亡現象,且能正常結繭化蛹。
2. 2 接種球孢白僵菌對家蠶cecropinA基因相對表達水平的影響
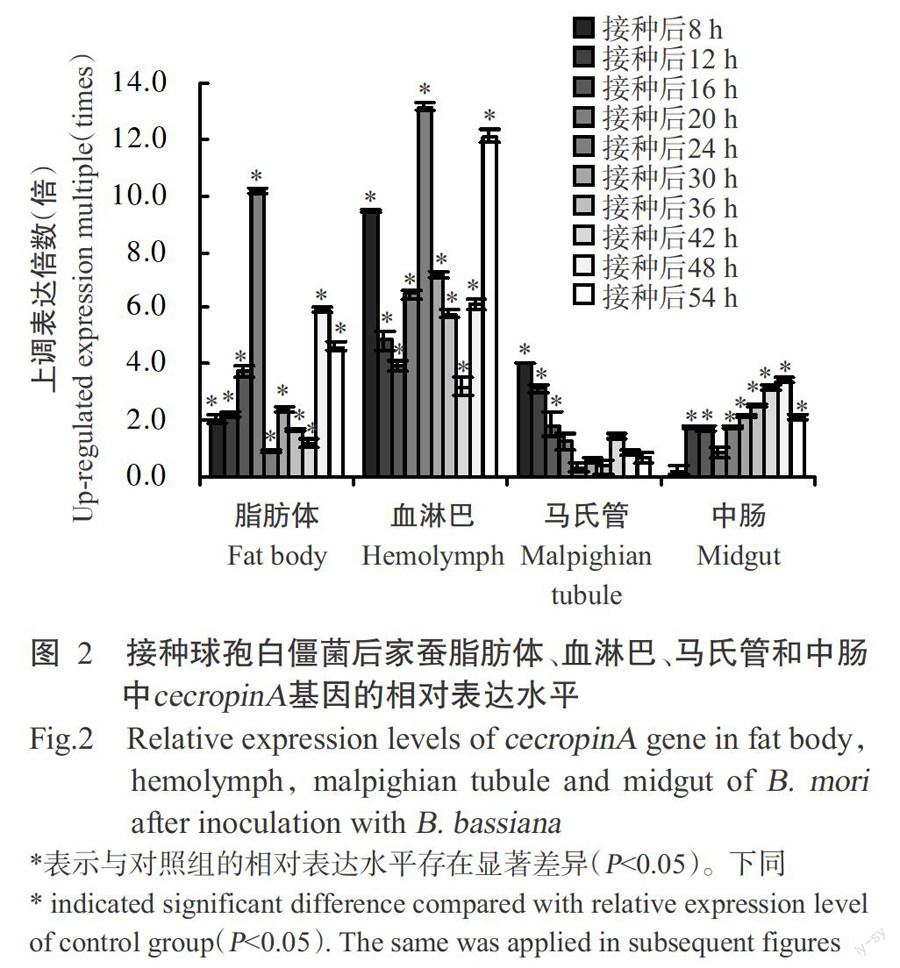
以實時熒光定量PCR檢測球孢白僵菌感染后家蠶脂肪體、血淋巴、馬氏管和中腸4個組織中cecropinA基因的相對表達水平,將各時間點對照組家蠶cecropinA基因的相對表達量設為1.0。當靶基因的相對表達量大于1.0時即為上調表達,反之為下調表達。從圖2可看出,接種球孢白僵菌后,家蠶脂肪體中cecropinA基因于接種后20 h上調表達約10.2倍,然后表達水平回落;在血淋巴中cecropinA基因的相對表達水平顯著上調(P<0.05,下同),接種后8、24和54 h的表達水平分別上調約9.5、13.2和12.1倍,說明家蠶在抵御球孢白僵菌侵染過程中,其脂肪體和血淋巴中的cecropinA抗菌體發揮了重要作用。cecropinA基因在馬氏管中也呈上調表達,但上調表達水平沒有在脂肪體和血淋巴中的明顯,且隨著時間的推移上調表達水平逐漸下降,至接種后24 h時甚至呈下調表達;在中腸中,cecropinA基因初期呈下調表達,之后明顯上調表達,但上調倍數不及脂肪體和血淋巴。說明家蠶馬氏管中cecropinA抗菌體在感染初期可能對抵御球孢白僵菌起到一定作用,而中腸中的cecropinA抗菌體在感染中后期對抵御球孢白僵菌可能起到重要作用。
2. 3 接種球孢白僵菌對家蠶gloverin2基因相對表達水平的影響
從圖3可看出,在球孢白僵菌的誘導下,家蠶脂肪體和中腸中gloverin2基因的相對表達水平絕大部分時間點呈顯著上調表達,尤其在脂肪體中gloverin2基因的最高上調表達為15.7倍;在感染初期,中腸中該基因的上調表達水平逐漸提高,至接種后20 h達最高上調表達倍數(6.7倍),然后上調表達水平逐漸回落。在血淋巴中的gloverin2基因僅在接種后12~30 h呈顯著上調表達,且上調表達倍數不及在脂肪體和中腸中的表達水平高,其他時間點略呈下調表達。在馬氏管中,gloverin2基因未被球孢白僵菌誘導上調表達,而略呈下調表達。球孢白僵菌的感染可能激活了家蠶脂肪體、中腸、血淋巴中gloverin2基因的轉錄,翻譯合成大量gloverin抗菌肽以抵御入侵的球孢白僵菌,而家蠶馬氏管中gloverin2基因可能未參與抵御過程。
2. 4 接種球孢白僵菌對家蠶lebocin1/2基因相對表達水平的影響
由圖4可看出,在球孢白僵菌誘導下,從接種后16 h起家蠶脂肪體中lebocin1/2基因的表達水平均顯著上調表達,最高上調倍數達19.4倍(接種后24 h),高于cecropinA和gloverin2基因在脂肪體中的最高上調表達倍數。在血淋巴中,lebocin1/2基因在接種后8~42 h也呈顯著上調表達,最高上調表達倍數(22.4倍)也高于cecropinA(13.1倍)和gloverin2基因(2.6倍),說明lebocin1/2抗菌肽在家蠶抵御球孢白僵菌的體液免疫過程中發揮重要作用。lebocin1/2基因在馬氏管中僅在接種后16 h上調2.8倍,可能在家蠶馬氏管中lebocin1/2基因沒有或未全程參與抵御球孢白僵菌的免疫應答過程。在中腸免疫應答中,lebocin1/2基因可能在接種后24~48 h參與了免疫應答。
2. 5 接種球孢白僵菌對家蠶lysozyme基因相對表達水平的影響
由圖5可看出,在球孢白僵菌的誘導下,家蠶脂肪體中lysozyme基因從接種后16 h開始呈顯著上調表達,且出現兩個上調表達高峰,最高上調表達倍數為4.6倍;在血淋巴中,lysozyme基因初期呈顯著上調表達,然后上調表達水平逐漸回落;在馬氏管中lysozyme基因也是初期逐漸上調表達,至接種后24 h達最高上調表達水平,然后上調表達水平逐漸回落;lysozyme基因在中腸中的表達無明顯規律,僅在個別時間點呈上調表達,大部分時間點呈下調表達。在家蠶抵御球孢白僵菌的免疫反應中,lysozyme基因的相對表達變化雖然不及cecropinA、 gloverin2和lebocin1/2基因明顯,但其在抵御球孢白僵菌入侵過程中也發揮了重要作用,尤其在脂肪體和血淋巴中。
3 討論
正常情況下,球孢白僵菌約在接種感染8 h后能侵入家蠶體表。因此,本研究從球孢白僵菌孢懸液侵染家蠶8 h后開始取材,動態觀察球孢白僵菌在整個侵染致病過程中對家蠶抗菌肽基因表達的影響,結果表明,在家蠶脂肪體中,接種后8和12 h兩個時間點gloverin2、lebocin1/2和lysozyme基因均未表現出上調表達,cecropinA基因雖呈上調表達,但上調表達倍數不高;在血淋巴中,接種后8和12 h兩個時間點4種抗菌肽均呈顯著上調表達,說明血淋巴中的抗菌肽最先被誘導合成,進而快速參與免疫應答過程,而脂肪體中抗菌肽需在接種后16 h才開始顯著上調表達,然后分泌到血淋巴中,以抵御入侵的球孢白僵菌。
雖然4種抗菌肽在球孢白僵菌的誘導下均能上調表達,但在脂肪體和血淋巴中,lebocin1/2基因的上調表達水平明顯高于cecropinA、gloverin2和lysozyme基因,說明在抵御球孢白僵菌侵染過程中,lebocin1/2抗菌肽可能發揮了更重要的作用。Rao等(2012)研究表明,化學合成的lebocin短肽對致病真菌新型隱球酵母(Cryptococcus neoformans)有明顯的抑菌活性。因此,在家蠶抗真菌機制及蠶藥研發中可將lebocin1/2基因作為一個重要的研究對象。在家蠶中腸中,球孢白僵菌能誘導抗菌肽上調表達,說明感染球孢白僵菌能引起家蠶腸道的免疫反應,且gloverin2和lebocin1/2抗菌肽可能在腸道免疫中發揮了更重要的作用。在家蠶馬氏管中,除lysozyme基因外,其他3種抗菌肽基因對球孢白僵菌的誘導應答不明顯,大多數時期呈下調表達。McGettigan等(2005)研究報道,果蠅馬氏管能獨立于脂肪體,且作為自主免疫組織能被細菌誘導表達抗菌肽。因此,推測在家蠶抵抗微生物入侵的過程中,發揮免疫的組織主要是脂肪體、血淋巴和中腸。
本研究還發現,除血淋巴的cecropinA基因在接種后54 h仍處于持續上調表達趨勢外,其他3種抗菌肽在脂肪體、血淋巴、中腸感染后期均呈上調表達水平逐漸回落趨勢,推測在感染后期,球孢白僵菌在家蠶體內的增殖抑制了家蠶的一系列免疫保護反應,或是家蠶自身為防止過度免疫而造成的現象(Welchman et al.,2009)。不同家蠶組織在感染球孢白僵菌后,4種抗菌肽基因相對表達水平隨時間的變化也不同,說明不同組織對球孢白僵菌有不同的防御機制,即對外來微生物的抵御是一個多免疫組織與多免疫因子協作的過程。家蠶被球孢白僵菌感染后,cecropinA、gloverin2、lebocin1/2和lysozyme等4種抗菌肽基因均被誘導上調表達,故推測這4種抗菌肽對球孢白僵菌具有一定的抑殺作用。本課題組前期已證明,用原核表達和化學合成的抗菌肽cecropinA在體內和體外對球孢白僵菌均具有較強的抑制作用(Lu et al.,2016),但關于lebocin1/2、gloverin2和lysozyme抗菌肽是否對球孢白僵菌具有抑殺作用,尚需進一步研究證實。
4 結論
cecropinA、gloverin2、lebocin1/2和lysozyme基因在球孢白僵菌侵染家蠶的過程中均不同程度地被誘導上調表達,尤其在家蠶脂肪體和血淋巴中較明顯,由此推測這4種抗菌肽在抵御球孢白僵菌的侵染過程中發揮重要作用。
參考文獻:
呂鴻聲. 2008. 昆蟲免疫學原理[M]. 上海:上海科學技術出版社:42-63.
Lü H S. 2008. Insect Immunology Principle[M]. Shanghai:Shanghai Science and Technology Publishers:42-63.
呂鴻聲,陳錫潮,朱宗才,莊大桓,劉之元,蔣猷龍,賈菊芬. 1990. 中國養蠶學[M]. 上海:上海科學技術出版社:567-570.
Lü H S,Chen X C,Zhu Z C,Zhuang D H,Liu Z Y,Jiang Y L,Jia J F. 1990. Chinese Sericulture[M]. Shanghai:Shanghai Science and Technology Publishers:567-570.
唐芬芬,楊偉克,張永紅,朱峰,邵榆嵐,白興榮. 2015. 喂食家蠶核型多角體病毒誘導家蠶抗菌肽基因表達[J]. 南方農業學報,46(12): 2191-2195.
Tang F F,Yang W K,Zhang Y H,Zhu F,Shao Y L,Bai X R. 2015. Expression of antimicrobial peptide genes in Bombyx mori induced by feeding B. mori nucleopolyhedrovirus[J]. Journal of Southern Agriculture,46(12):2191-2195.
姚遠,匡偉,黃忠陽,郗正林,王冰心,何宗亮,王潤之. 2014. 抗菌肽天蠶素對雞生長性能、腸道黏膜形態、盲腸菌群及免疫功能的影響[J]. 江蘇農業學報,30(2):331-338.
Yao Y,Kuang W,Huang Z Y,Xi Z L,Wang B X,He Z L,Wang R Z. 2014. Effect of antibacterial peptide cecropin on growth performance,intestinal mucosal morphology,caecal microflora and immune function of chickens[J]. Jiangsu Journal of Agricultural Sciences,30(2):331-338.
Boman H G,Steiner H. 1981. Humoral immunity in Cecropia pupae[J]. Current Topics in Microbiology and Immunology,94-95:75-91.
Cavallarin L,Andreu D,San Segundo B. 1998. Cecropin A-derived peptides are potent inhibitors of fungal plant pathogens[J]. Molecular Plant-Microbe Interactions,11(3):218-227.
Cheng T,Zhao P,Liu C,Xu P,Gao Z,Xia Q,Xiang Z. 2006. Structures,regulatory regions,and inductive expression patterns of antimicrobial peptide genes in the silkworm Bombyx mori[J]. Genomics,87(3):356-365.
Chowdhury S,Taniai K,Hara S,Kadono-Okuda K,Kato Y,Yamamoto M,Xu J,Choi S K,Debnath N C,Choi H K,Miyanoshita A,Sugiyama M,Asaoka A,Yamakawa M. 1995. cDNA cloning and gene expression of lebocin, a novel member of antibacterial peptides from the silkworm, Bombyx mori[J]. Biochemical and Biophysical Research Communications,214(1):271-278.
Hong S M,Kusakabe T,Lee J M,Tatsuke T,Kawaguchi Y,Kang M W,Kang S W,Kim K A,Nho S K. 2008. Structure and expression analysis of the cecropin-E gene from the silkworm, Bombyx mori[J]. Bioscience,Biotechnology,and Biochemistry,72(8):1992-1998.
Kaneko Y,Furukawa S,Tanaka H,Yamakawa M. 2007. Expression of antimicrobial peptide genes encoding Enbocin and Gloverin isoforms in the silkworm, Bombyx mori[J]. Bioscience,Biotechnology,and Biochemistry,71(9):2233-2241.
Kaneko Y,Tanaka H,Ishibashi J,Iwasaki T,Yamakawa M. 2008. Gene expression of a novel defensin antimicrobial peptide in the silkworm, Bombyx mori[J]. Bioscience,Biotechnology,and Biochemistry,72(9):2353-2361.
Lee W J,Brey P T. 1995. Isolation and characterization of the lysozyme-encoding gene from the silkworm Bombyx mori[J]. Gene,161(2):199-203.
Livak K J,Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods,25(4):402-408.
Lu D,Geng T,Hou C,Huang Y,Qin G,Guo X. 2016. Bombyx mori cecropin A has a high antifungal activity to entomopathogenic fungus Beauveria bassiana[J]. Gene,583(1):29-35.
McGettigan J,McLennan R K,Broderick K E,Kean L,Allan A K,Cabrero P,Regulski M R,Pollock V P,Gould G W,Davies S A,Dow J A. 2005. Insect renal tubules constitute a cell-autonomous immune system that protects the organism against bacterial infection[J]. Insect Biochemistry and Molecular Biology,35(7):741-754.
Rao X J,Xu X X,Yu X Q. 2012. Functional analysis of two lebocin-related proteins from Manduca sexta[J]. Insect Biochemistry and Molecular Biology,42(4):231-239.
Tanaka H,Sagisaka A,Fujita K,Furukawa S,Ishibashi J,Yamakawa M. 2012. BmEts upregulates promoter activity of lebocin in Bombyx mori[J]. Insect Biochemistry and Molecu-
lar Biology,42(7):474-481.
Welchman D P,Aksoy S,Jiggins F,Lemaitre B. 2009. Insect immunity:from pattern recognition to symbiont-mediated host defense[J]. Cell Host & Microbe,6(2):107-114.
Xia L,Liu Z,Ma J,Sun S,Yang J,Zhang F. 2013. Expression,purification and characterization of cecropin antibacterial peptide from Bombyx mori in Saccharomyces cerevisiae[J]. Protein Expression and Purification,90(1):47-54.
Yamano Y,Matsumoto M,Inoue K,Kawabata T,Morishima I. 1994. Cloning of cDNAs for cecropins A and B,and expression of the genes in the silkworm, Bombyx mori[J]. Bioscience,Biotechnology,and Biochemistry,58(8):1476-1478.
Zhang L,Benz R,Hancock R E. 1999. Influence of proline residues on the antibacterial and synergistic activities of alpha-helical peptides[J]. Biochemistry,38(25):8102-8111.
(責任編輯 蘭宗寶)

