結締組織生長因子對人眼Tenon囊成纖維細胞間質轉化的影響及機制
羅鋼,蔡麗英
(黃石市中心醫院 湖北省理工學院附屬醫院,湖北黃石435000)
結締組織生長因子對人眼Tenon囊成纖維細胞間質轉化的影響及機制
羅鋼,蔡麗英
(黃石市中心醫院 湖北省理工學院附屬醫院,湖北黃石435000)
目的 觀察結締組織生長因子(CTGF)對人眼Tenon囊成纖維細胞間質轉化的影響,探討其作用機制。方法 體外培養人眼Tenon囊成纖維細胞,取傳代(第3代)細胞隨機分為CTGF組和對照組,CTGF組用含50 ng/mL CTGF的DMEM培養基培養,對照組僅用DMEM培養基培養。培養48 h,采用實時熒光定量PCR法檢測兩組鈣黏素E(E-cadherin)、α平滑肌肌動蛋白(α-SMA)和Wnt信號通路相關基因β連環蛋白(β-catenin)、淋巴樣增強因子1(Lef1)、Wnt基因家族2B(Wnt2B)、糖原合成酶激酶3(GSK-3β)mRNA相對表達量,Western blotting法檢測E-cadherin和α-SMA蛋白相對表達量。結果 CTGF組β-catenin、Lef1、Wnt2B、GSK-3β mRNA相對表達量均高于對照組(P均<0.01),E-cadherin、α-SMA mRNA及蛋白相對表達量均高于對照組(P均<0.01)。結論 CTGF可致人眼Tenon囊成纖維細胞發生間質轉化,激活Wnt信號通路可能是其作用機制。
人眼Tenon囊成纖維細胞;結締組織生長因子;細胞間質轉化;Wnt信號通路
青光眼為眼科常見病,其病因復雜,對視力危害極大,是致盲的主要原因[1]。青光眼濾過術是臨床治療青光眼的常用方法,通過建立房水外引流而降低眼壓,修復視功能[2];但術后濾過區瘢痕形成常影響手術效果。研究表明,成纖維細胞異常黏附、增殖、間質-上皮轉化及細胞外基質大量合成是導致青光眼濾過術后濾過區瘢痕形成的重要原因[3]。但人眼Tenon囊成纖維細胞在病理情況下是否發生間質轉化鮮有報道。結締組織生長因子(CTGF)作為一種新的致纖維化生長因子,在轉化生長因子β下游發揮重要作用,是病理性纖維瘢痕化過程中的重要介質[4,5]。2014年6月~2015年7月,本研究觀察了CTGF對人眼Tenon囊成纖維細胞間質轉化的影響,并探討其作用機制。
1 材料與方法
1.1 主要試劑及儀器 人眼Tenon囊成纖維細胞株來源于黃石市中心醫院眼科中心。DMEM培養基(高糖型)購自上海高創化學科技有限公司,FBS購自南京安培化工科技有限公司,Wnt信號通路相關基因β連環蛋白(β-catenin)、淋巴樣增強因子1(Lef1)、Wnt基因家族2B(Wnt2B)、糖原合成酶激酶3β(GSK-3β)多克隆抗體均購自美國Abcam公司,鈣黏素E(E-cadherin)抗體購自武漢博士德生物工程有限公司,鼠抗人α平滑肌肌動蛋白(α-SMA)單克隆抗體購自北京中杉金橋生物技術有限公司。TRIzol總RNA提取試劑盒購自美國Biomiga公司,逆轉錄試劑盒和PCR試劑盒均購自美國Fermentas公司。實時熒光定量PCR儀購自美國ABI公司。CTGF購自美國Peprotech公司,采用0.1%牛血清白蛋白(BSA)液稀釋,稀釋濃度為50 ng/mL,分裝于EP管中,置于-20 ℃冰箱保存,實驗過程中根據所需質量濃度用DMEM培養液進行稀釋。
1.2 人眼Tenon囊成纖維細胞培養及分組處理 將人眼Tenon囊成纖維細胞置于含10% FBS的DMEM培養基(高糖型)中,于5% CO2、恒溫培養箱中培養至細胞融合達到80%,進行傳代培養。傳代后每24 h更換1次培養液,每3天進行1次傳代,取第3代細胞完成后續實驗。取傳代培養生長良好的細胞,用胰蛋白酶進行消化,按照密度為6×104/mL接種于96孔板。隨機分為CTGF組和對照組,CTGF組細胞培養液中加入50 ng/mL的 CTGF,于5% CO2培養箱中37 ℃恒溫培養48 h;對照組僅在培養液中相同條件下培養48 h。
1.3 E-cadherin、α-SMA、β-catenin、Lef1、Wnt2B、GSK-3β mRNA表達檢測 采用實時熒光定量PCR法。取兩組貼壁培養48 h的細胞,將培養液棄去,PBS沖洗3次,細胞裂解液裂解細胞;采用TRIzol總RNA提取試劑盒提取總RNA,紫外分光光度計測定總RNA純度,取A260/A280>1.80樣品完成后續實驗;采用逆轉錄試劑盒將總RNA逆轉錄為模板鏈cDNA;以cDNA為模板,采用PCR試劑盒完成擴增。相關基因引物均由上海生工公司設計合成,引物序列見表1。PCR反應條件:95 ℃、45 s,92 ℃、30 s,56 ℃、15 s,74 ℃、15 s ,連續38個循環。每個樣品均設置3個平行反應復孔。以內參GAPDH為對照,2-△△Ct法計算上述各基因mRNA的相對表達量。

表1 基因引物序列
1.4 E-cadherin和α-SMA蛋白表達檢測 采用Western blotting法。取兩組貼壁培養48 h的細胞,將培養液棄去,PBS沖洗3次,細胞裂解液裂解細胞;采用總蛋白提取試劑盒提取總蛋白,并用BCA法檢測蛋白濃度;SDS-PAGE凝膠電泳,轉膜至硝酸纖維膜;用含5%脫脂奶粉的封閉液封閉60 min;TBST液進行洗膜30 min;加入一抗 E-cadherin抗體(1∶500)或鼠抗人α-SMA 單克隆抗體(1∶200),于4 ℃下過夜孵育;洗膜,加入1∶1 000稀釋的相應二抗,室溫下孵育60 min。每個樣品均重復3次實驗,以β-actin為內參,用Quantity One凝膠圖像分析軟件分析條帶灰度值,獲得E-cadherin和α-SMA蛋白相對表達量。
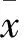
2 結果
CTGF組β-catenin、Lef1、Wnt2B、GSK-3β mRNA相對表達量均高于對照組(P均<0.01),見表2。CTGF組E-cadherin、α-SMA mRNA和蛋白相對表達量均高于對照組(P均<0.01),見表3。
3 討論
術后濾過區瘢痕形成為青光眼濾過手術術后常見不良反應,不利于患者術后視力恢復[6]。研究表明,瘢痕形成涉及多個過程,如細胞因子合成、釋放,成纖維細胞遷移、活化、增殖和轉化,細胞外基質降解等[7]。CTGF為纖維化過程中發揮關鍵作用的因子,在調控成纖維細胞增殖、遷移、分化及細胞外基質合成中發揮重要作用[8]。Zhang等[9]將CTGF注射到濾過泡內,觀察到濾過通道瘢痕形成速度顯著增加。亦有研究利用RNA干擾技術使人眼Tenon囊成纖維細胞中CTGF基因沉默,觀察到細胞增殖能力被顯著抑制[10]。上述研究均提示,CTGF與青光眼濾過手術術后濾過區瘢痕形成關系密切。
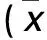
表2 兩組β-catenin、Lef1、Wnt2B、GSK-3β mRNA相對表達量比較±s)
注:與對照組比較,*P<0.01。
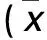
表3 兩組E-cadherin、α-SMA mRNA及蛋白相對表達量比較±s)
注:與對照組比較,*P<0.01。
E-cadherin是上皮細胞標志物,在正常間葉組織來源的成纖維細胞中幾乎不表達,在維持細胞間黏附性、細胞極性及細胞間信息傳遞過程中發揮重要作用,其表達增加是間質-上皮轉化的最顯著特征。本研究CTGF組Tenon囊成纖維細胞中E-cadherin mRNA和蛋白相對表達量均高于對照組,提示CTGF可能促進成纖維細胞發生間質轉化[11]。α-SMA為肌動蛋白家族成員,表達于血管平滑肌細胞和肌性上皮細胞,是人眼成纖維細胞向肌成纖維細胞轉分化的標志物,其表達增加可加速細胞纖維化過程[12]。本研究CTGF組細胞中α-SMA mRNA和蛋白相對表達量均高于對照組,進一步說明CTGF可促進人眼Tenon囊成纖維細胞發生間質轉化。
Wnt信號通路不僅在維持人體正常生理過程中發揮重要作用,而且與細胞轉分化過程關系密切[13]。本研究CTGF組細胞中Wnt信號下游樞紐信號分子β-catenin、下游靶因子Lef1及Wnt配體Wnt2B相對表達量均高于對照組,而Wnt信號激活因子GSK-3β相對表達量則低于對照組,表明CTGF可能通過激活Wnt信號通路而促進人眼Tenon囊成纖維細胞發生間質轉化;具體作用機制可能為在生理狀態下GSK-3β通過降解β-catenin而抑制Wnt信號活性[14],CTGF通過抑制GSK-3β活性進而導致β-catenin在細胞質內大量積累,并與胞核內TCF/LEF結合而誘導Wnt信號通路激活,促進成纖維細胞發生間質轉化,E-cadherin大量表達,加速瘢痕形成。
綜上所述,CTGF可致人眼Tenon囊成纖維細胞發生間質轉化,激活Wnt信號通路可能是其作用機制。
[1] Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review[J]. JAMA, 2014,311(18):1901-1911.
[2] Maggio F, Bras D. Surgical treatment of canine glaucoma: filtering and end-stage glaucoma procedures[J]. Vet Clin North Am Small Anim Pract, 2015,45(6):1261-1282.
[3] Van Bergen T, Jonckx B, Hollanders K, et al. Inhibition of placental growth factor improves surgical outcome of glaucoma surgery[J]. J Cell Mol Med, 2013,17(12):1632-1643.
[4] 戴麗冰,謝有富,姚依村,等.褪黑素對人增生性瘢痕成纖維細胞結締組織生長因子表達的影響[J].中華實驗外科雜志,2015,32(3):486-489.
[5] 郭云珊,丁堯海,楊炳琴,等.甲狀旁腺激素通過介導Wnt信號通路誘導人近曲小管上皮細胞轉分化[J].中華腎臟病雜志,2015,31(8):615-622.
[6] 申穎,吳偉,陸曉和,等.基質金屬蛋白酶抑制劑GM6001抑制兔青光眼濾過性手術后瘢痕的形成[J].南方醫科大學學報,2014,34(2):241-245.
[7] Galatz LM, Gerstenfeld L, Heber-Katz E, et al. Tendon regeneration and scar formation: the concept of scarless healing[J]. J Orthop Res, 2015,33(6):823-831.
[8] Lee HS. Paracrine role for TGF-β-induced CTGF and VEGF in mesangial matrix expansion in progressive glomerular disease[J]. Histol Histopathol, 2012,27(9):1131-1141.
[9] Zhang JY, Gao P, Ye W, et al. Functional characteristics of connective tissue growth factor on human tenon′s capsule fibroblast[J]. Curr Eye Res, 2014,39(1):53-61.
[10] Jing J, Li P, Li T, et al. RNA interference targeting connective tissue growth factor inhibits the transforming growth factor-β2induced proliferation in human tenon capsule fibroblasts[J]. J Ophthalmol, 2013,20(3):354-368.
[11] 李靜,謝安明.結締組織生長因子對人Tenon囊成纖維細胞中E-cadherin蛋白表達的促進作用[J].中華實驗眼科雜志,2015,33(8):695-698.
[12] 楊楠,康剛勁,董敏.bFGF與ERK1/2阻斷劑對人晶狀體上皮細胞α平滑肌肌動蛋白mRNA表達的影響[J].眼科新進展,2014,34(4):326-329.
[13] Lee SC, Kim OH, Lee SK, et al. IWR-1 inhibits epithelial-mesenchymal transition of colorectal cancer cells through suppressing Wnt/β-catenin signaling as well as survivin expression[J]. Oncotarget, 2015,6(29):27146-27159.
[14] Gao X, Zhang L, Gu G, et al. The effect of oxLDL on aortic valve calcification via the Wnt/β-catenin signaling pathway: an important molecular mechanism[J]. J Heart Valve Dis, 2015,24(2):190-196.
蔡麗英(E-mail: 2755229172@qq.com)
10.3969/j.issn.1002-266X.2016.28.010
R775
A
1002-266X(2016)28-0031-03
2015-11-04)

