微生物酶催化的不對稱還原反應合成(S)-(+)-4-苯基-2-丁醇
楊 敏, 李 珂, 周曉建, 崔寶東, 陳永正
(遵義醫學院 藥學院,貴州 遵義 563000)
?
·快遞論文·
微生物酶催化的不對稱還原反應合成(S)-(+)-4-苯基-2-丁醇
楊敏, 李珂, 周曉建, 崔寶東, 陳永正*
(遵義醫學院 藥學院,貴州 遵義563000)
摘要:以LB培養基培養Pseudomonas monteilii TA-5,將其整細胞作為生物催化劑(Cat),催化4-苯基-2-丁酮(1)的不對稱還原反應,對映選擇性地合成了(S)-(+)-4-苯基-2-丁醇。在最佳反應條件[1 10 mmol·L(-1), c(Cat) 30 g cdw·L(-1), 10%丙三醇,pH 8.0, 300 r·min(-1),于30 ℃反應24 h]下,轉化率82%, ee值91%。
關鍵詞:生物催化; LB培養基; Pseudomonas monteilii TA-5; 不對稱還原; (S)-(+)-4-苯基-2-丁醇; 合成
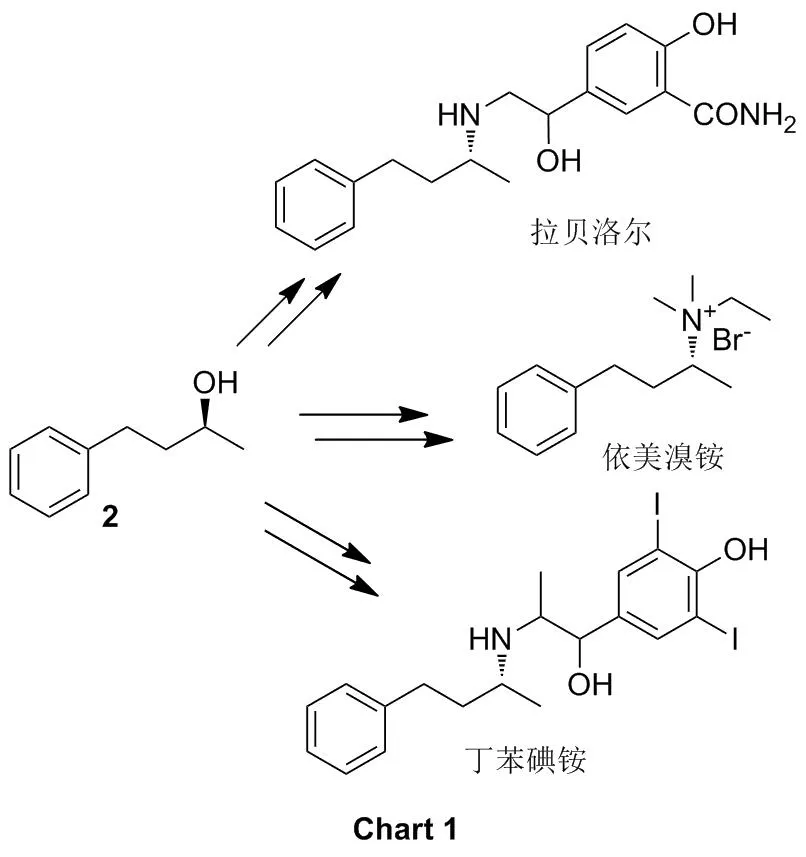
手性二級醇是許多藥物的重要中間體和合成模塊,其中(S)-(+)-4-苯基-2-丁醇(2)為抗高血壓藥拉貝洛爾、丁苯碘銨,解痙鎮癇劑依美溴銨的重要關鍵中間體(Chart 1)[1]。因此,研究該類化合物的不對稱合成方法極為重要。目前,手性2的合成大多采用金屬-手性配體催化酮的不對稱還原[2-7]或者烯醇的異構化和不對稱轉移氫化串聯反應[8]等方法來實現。近年來,科研工作者發現利用生物催化劑進行不對稱還原的方法也可實現[9-14]。生物催化的不對稱氧化還原反應合成手性藥物中間體的方法越來越引起相關科研人員的關注[15-18]。
本課題組研究[19]發現,PseudomonasmonteiliiTA-5在M9培養基中以甲苯為誘導碳源進行菌株培養,可實現4-苯基-2-丁酮(1)芐位亞甲基的不對稱羥基化反應,獲得(R)-3-羥基-4-苯基-2-丁酮,對映選擇性達99%,且未檢測到羰基還原產物2的產生。本文以LB培養基培養PseudomonasmonteiliiTA-5,將其整細胞作為生物催化劑(Cat),催化1的不對稱還原反應,對映選擇性地合成了2(Scheme 1),其結構經1H NMR和13C NMR確證。并對催化反應條件進行了優化。

Scheme 1
1實驗部分
1.1儀器與試劑
Agilent 400 MHz型核磁共振儀;SHIMADZU LC-20A型正相高效液相色譜儀[色譜柱:CHIRALCEL OD-H(4.6 mmΦ×250 mm, 5 μm);流動相:95%正己烷/5%異丙醇;流速:0.5 mL·min-1;分析時間:35 min;檢測波長:210 nm, tR=22.2 min, tS=33.6 min]; BHC-1300ⅡA/B3型生物潔凈安全柜;FE20型pH酸度計;Multiskan Spectrun型全波長酶標儀。
PseudomonasmonteiliiTA-5,自制;氯化鈉(99.5%),氯化銨(99.5%),磷酸二氫鉀(99%)和十二水磷酸氫二鈉(99%),百靈威科技公司;酵母浸粉,蛋白胨,瓊脂,OXOID;其余所用試劑均為分析純。
1.2合成
(1) 細胞培養
稱取胰蛋白胨10.0 g,酵母浸粉5.0 g和氯化鈉10.0 g,用適量重蒸水溶解,混勻,定容至1 000 mL,并調至pH 7.0。取10 mL分裝于20 mL螺口瓶中;另取50 mL分裝于250 mL錐形瓶中,于121 ℃滅菌30 min得LB培養基,備用。
將PseudomonasmonteiliiTA-5接種于20 mL螺口瓶的LB培養基中,標記為一級培養,在 30 ℃, 300 r·min-1條件下于搖床中培養7 h。取種子菌液2 mL于250 mL錐形瓶的LB培養基中,標記為二級培養,在30 ℃, 300 r·min-1條件下于搖床中培養17 h。將菌液取出并快速分裝于已冰浴好的50 mL離心管中,用全波長酶標儀測量各管菌液的OD值。利用冷凍離心機(8 000 r·min-1,于4 ℃離心5 min)離心后倒掉上層液體。根據OD值與細胞濃度關系計算出應加入適量的Na2HPO4-KH2PO4緩沖溶液,振搖使細胞與緩沖溶液混合均勻,制得c(Cat) 30 g cdw·L-1細胞溶液。
(2) 2的合成
配制反應液5 mL[c(Cat) 30 g cdw·L-14.5 mL, 10 mmol·L-11 7.62 μL, 丙三醇492.38 μL],調至pH 7, 300 r·min-1,于30 ℃反應24 h[HPLC監測(在EP管內加入反應液850 μL,用乙酸乙酯850 μL萃取,漩渦振蕩器振搖,使其充分混合。在10 000 r·min-1, 5 min, 4 ℃條件下離心。取上清液600 μL加入裝有適量無水硫酸鈉的EP管中,振搖,干燥。取上清液400 μL到HPLC樣品瓶中,并加入400 μL含有2 mmol·L-1苯甲醇內標的乙酸乙酯溶液。根據內標物、底物和產物的峰面積,用內標法得到相應底物濃度、產物濃度,計算轉化率、產率及ee值)]。合并50瓶反應液,用乙酸乙酯(3×200 mL)萃取,合并有機相,用無水Na2SO4干燥,減壓旋蒸后經柱層析[洗脫劑:V(乙酸乙酯) ∶V(石油醚)=1 ∶20]純化得無色油狀液體2 223.5 mg,轉化率82%,ee值91%;1H NMRδ: 7.35(d,J=8.0 Hz, 3H), 7.29~7.23(m, 2H), 4.56(d,J=6.4 Hz, 3H), 3.82~3.86(m, 1H), 2.67~2.78(m, 2H), 2.01(s, 1H), 1.75~1.83(m, 2H);13C NMRδ: 142.1, 128.5, 125.9, 67.5, 40.9, 32.2, 23.6;其絕對構型用標準品經手性液相色譜對照鑒定(圖1)。
2結果與討論
2.1反應條件優化
為了探索最佳反應條件,考察了反應時間、細胞濃度、底物濃度、pH和輔助溶劑對1的不對稱還原反應的影響。

Time/min
(1) 反應時間
反應液5 mL,c(Cat) 50 g cdw·L-1,其余反應條件同1.2(2),考察反應時間對不對稱還原反應的影響,結果見圖2。

Time/h
由圖2可見,其反應時間達6 h時轉化率的曲線已基本平穩,即在反應6 h后底物已基本不再轉化為產物;而反應時間從40 min至24 h時,其產物對映選擇性變化不大,ee值均為91%~92%。由于在實際反應過程中生物催化劑的不穩定性,6 h反應結果的重現性較差,而24 h反應結果重現性較好。因此,最佳反應時間確定為24 h。
(2)c(Cat)
1 5 mmol·L-1,反應時間24 h,其余反應條件同2.1(1),考察c(Cat)對不對稱還原反應的影響,結果見表1。由表1可見,c(Cat)對產物對映選擇性的影響不明顯;當c(Cat)為30 g cdw·L-1時,轉化效果較好(轉化率52%,ee值90%)。因此最佳c(Cat)為30 g cdw·L-1。
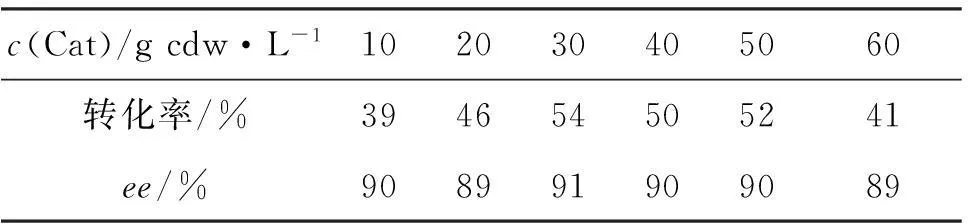
表1 c(Cat)對不對稱還原反應的影響*
*1 5 mmol·L-1,反應時間24 h,其余反應條件同2.1(1)。
(3)c(1)
反應時間為24 h,其余反應條件同2.1(1),考察c(1)對不對稱還原反應的影響,結果見表2。由表2可見,隨著c(1)增大,轉化率增加,可能是因為c(1)在一定范圍內的增加導致反應中酶與底物接觸的幾率有所增大,從而使反應速率提高而得到較高的轉化率。因此,最佳的c(1)為10 mmol·L-1。
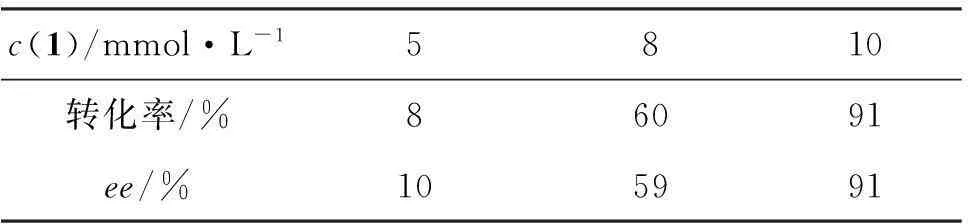
表2 c(1)對不對稱還原反應的影響*
*反應時間24 h,其余反應條件同表1。
(4) pH
反應時間為24 h,其余反應條件同2.1(1),考察反應體系pH對不對稱還原反應的影響,結果見表3。由表3可見,當pH逐漸升高時,ee值變化不大(90%~92%);但轉化率隨著pH的增高而逐漸增加,且pH 8.0時,轉化率達到最大值(69%)。

表3 pH值對不對稱羥基化反應的影響*
*反應時間24 h,其余反應條件同表1。
(5) 輔助溶劑
當加入少量的有機溶劑時,可以提高底物在水中的濃度,增加底物與酶反應的接觸面,提升反應的轉化率[20]。反應時間24 h,其余反應條件同2.1(1),考察輔助溶劑對不對稱還原反應的影響,結果見表4。由表4可見,采用親水性較強的有機溶劑丙三醇為輔助溶劑時,ee值提高至93%,而轉化率也有了較大的提升。因此,輔助溶劑確定為丙三醇。

表4 輔溶劑對不對稱羥基化反應的影響
*反應時間24 h,其余反應條件同表1。
綜上所述,最佳還原反應條件為:反應液5 mL,細胞濃度為30 g cdw·L-1,底物濃度10 mmol·L-1, 10%(體積百分數)丙三醇為輔溶劑,pH 8.0, 300 r·min-1,于30 ℃反應24 h,轉化率82%,ee值91%。
以LB培養基培養的PseudomonasmonteiliiTA-5催化還原4-苯基-2-丁酮,合成了(S)-(+)-4-苯基-2-丁醇。該方法具有高效,高選擇性,專一性強,反應條件溫和,環境友好等特點,為手性二級醇的合成提供了一個新的思路。
參考文獻
[1]Bracher F, Litz T. Building blocks for the preparation of enantiomerically pure drugs containing a phenylalkylamine moiety[J].Arch Pharm,1994,327:591-593.
[2]Kuwano R, Uemura T, Saitoh M,etal. A trans-chelating bisphosphine possessing only planar chirality and its application to catalytic asymmetric reactions[J].Tetrahedron:Asymmetry,2004,15:2263-2271.
[3]Hosoda N, Kamito H, Takano M,etal. Synthesis of chiral 2-(anilinophenylmethyl) pyrrolidines and 2-(anilinodiphenylmethyl)pyrrolidine and their application to enantioselective borane reduction of prochiral ketones as chiral catalysts[J].Tetrahedron,2013,69:1739-1746.
[4]Ghoshal A, Sarkar A R, Manickam G,etal. Rhodium-catalyzed asymmetric hydrosilylation of ketones employing a new ligand embodying the bis(oxazolinyl)pyridine moiety[J].Synlett,2010,10:1459-1462.
[5]He P, Liu X H, Zheng H F,etal. Asymmetric 1,2-reduction of enones with potassium borohydride catalyzed by chiralN,N'-dioxide-scandium(III) complexes[J].Org Lett,2012,14(19):5134-5137.
[6]Inagaki T, Ito A, Ito J,etal. Asymmetric iron-catalyzed hydrosilane reduction of ketones:Effect of zinc metal upon the absolute configuration[J].Angew Chem Int Ed,2010,49:9384-9387.
[7]Imamoto T, Itoh T, Yamanoi Y,etal. Highly enantioselective hydrosilylation of simple ketones catalyzed by rhodium complexes of P-chiral diphosphine ligands bearing tert-butylmethylphosphino groups[J].Tetrahedron:Asymmetry,2006,17:560-565.
[8]Slagbrand T, Lundberg H, Adolfsson H. Ruthenium-catalyzed tandem-isomerization/asymmetric transfer hydrogenation of allylic alcohols[J].Chem Eur J,2014,20:16102-16106.
[9]Nakamura K, Fujii M, Ida Y. Stereoinversion of arylethanols byGeotrichumcandidum[J].Tetrahedron:Asymmetry,2001,12:3147-3153.
[10]Nakamura K, Takenaka K, Fujii M,etal. Asymmetric synthesis of both enantiomers of secondary alcohols by reduction with a single microbe[J].Tetrahedron Letters,2002,43:3629-3631.
[11]Matsuda T, Harada T, Nakamura K. Alcohol dehydrogenase is active in supercritical carbon dioxide[J].Chem Commun,2000:1367-1368.
[12]Patel J M, Musa M M, Rodriguez L,etal. Mutation of thermoanaerobacter ethanolicus secondary alcohol dehydrogenase at Trp-110 affects stereoselectivity of aromatic ketone reduction[J].Org Biomol Chem,2014,12:5905-5910.
[13]Voss C V, Gruber C C, Faber K,etal. Orchestration of concurrent oxidation and reduction cycles for stereoinversion and deracemisation of sec-alcohols[J].J Am Chem Soc,2008,130:13969-13972.
[14]Musa M M, Phillips R S, Laivenieks M,etal. Racemization of enantiopure secondary alcohols by thermoanaerobacter ethanolicus secondary alcohol dehydrogenase[J].Org Biomol Chem,2013,11:2911-2915.
[15]Zhuo J R, Chen Y Z. Research progress on asymmetric oxidation of sulfides with biocatalysts[J].Chin J Syn Chem,2015,23(5):456-460.
[16]Chen Y Z, Tang W L, Mou J,etal. High-throughput method for determining the enantioselectivity of enzyme-catalyzed hydroxylations based on mass spectrometry[J].Angew Chem Int Ed,2010,49:1-8.
[17]Wu S K, Chen Y Z, Xu Y,etal. Enantioselective trans-dihydroxylation of aryl olefins by cascade biocatalysis with recombinant escherichia coli coexpressing monooxygenase and epoxide hydrolase[J].ACS Catal,2014,4:409-420.
[18]Paul C E, Tischler D, Riedel A,etal. Nonenzymatic regeneration of styrene monooxygenase for catalysis[J].ACS Catal,2015,5:2961-2965.
[19]Chen Y Z, Lie F, Li Z,etal. Enantioselective benzylic hydroxylation with pseudomonas monteilii TA-5:A simple method for the syntheses of (R)-benzylic alcohols containing reactive functional groups[J].Adv Synth Catal,2009,351:2107-2112.
[20]Griebenow K, Vidal M, Baéz C,etal. Nativelike enzyme properties are important for optimum activity in neat organic solvents[J].J Am Chem Soc,2001,123:5380-5381.
Asymmetric Synthesis of (S)-(+)-4-phenyl-2-butanol by Carbonyl Reduction with Microbial Enzymes
YANG Min,LI Ke,ZHOU Xiao-jian,CUI Bao-dong,CHEN Yong-zheng*
(School of Pharmarcy, Zunyi Medical University, Zunyi 563000, China)
Abstract:Pseudomonas monteilii TA-5 cultivated with LB medium was employed as the biocatalysts(Cat) for the synthesis of (S)-(+)-4-phenyl-2-butanol with high enantioselectivity by asymmetric reduction. In this paper, the optimal reaction conditions for bioreduction of 4-phenyl-2-butanone(1) were optimized. Under the optimized reaction conditions[1 10 mmol·L(-1), c(Cat) 30 g·cdw·L(-1), 10% glycerol as the cosolvent, pH 8.0, 300 r·min(-1), at 30 ℃ for 4 h], the conversion was 82% and ee was 91%.
Keywords:biocatalysis; LB medium; Pseudomonas monteilii TA-5; asymmetric reduction; (S)-(+)-4-phenyl-2-butanol; synthesis
中圖分類號:O623.42; O621.3
文獻標志碼:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.16009
作者簡介:楊敏(1991-),女,苗族,貴州臺江人,碩士研究生,主要從事生物催化的研究。通信聯系人: 陳永正,教授, Tel. 0851-28642336, E-mail: yzchen@zmc.edu.cn
基金項目:國家自然科學基金資助項目(21262051); 貴州省教育廳自然科學項目(黔教科2011-046號)
收稿日期:2015-12-29

