淋巴瘤患兒血清鐵調素、IL-6的水平變化及意義
穆慢慢,徐學聚,孫繪霞,張園,陳佩佩
(1鄭州大學第一附屬醫院,鄭州450052;2鄭州市兒童醫院)
?
淋巴瘤患兒血清鐵調素、IL-6的水平變化及意義
穆慢慢1,徐學聚1,孫繪霞2,張園1,陳佩佩1
(1鄭州大學第一附屬醫院,鄭州450052;2鄭州市兒童醫院)
摘要:目的觀察淋巴瘤患兒血清中鐵調素(Hepcidin)和白細胞介素6(IL-6)水平變化,并探討其臨床意義。方法 選取初治并排除骨髓浸潤的淋巴瘤患兒69例,分為貧血組15例、非貧血組54例,另選取健康體檢兒童15例作為正常對照組。用ELISA法檢測淋巴瘤患兒及正常對照組兒童血清Hepcidin和IL-6水平,分析血清Hepcidin和IL-6水平與貧血的關系。結果貧血組、非貧血組、正常對照組血清Hepcidin水平分別為(38.93±14.12)、(31.26±11.01)、(21.99±5.14)ng/mL,IL-6水平分別為(12.13±1.92)、(10.23±1.67)、(8.59±1.01)pg/mL,3組血清Hepcidin和IL-6水平比較差異有統計學意義(P均<0.05)。貧血組Hepcidin水平與血紅蛋白水平呈負相關(r=-0.765,P=0.003), Hepcidin水平與IL-6呈正相關(r=0.657,P=0.014)。結論 淋巴瘤貧血患兒血清Hepcidin、IL-6水平升高,二者在兒童淋巴瘤相關貧血中發揮重要作用。
關鍵詞:淋巴瘤,兒童;貧血;鐵調素;白細胞介素6
淋巴瘤是原發于淋巴結和(或)結外淋巴組織的惡性腫瘤,是兒童常見的惡性腫瘤,貧血是其常見并發癥[1];其中慢性病貧血(ACD)最為常見,炎性細胞因子所引起的鐵代謝異常在ACD機制中起至關重要的作用。鐵調素(Hepcidin)可以通過抑制鐵的吸收及單核巨噬細胞系統鐵的釋放對鐵代謝起負性調控作用,白細胞介素6(IL-6)是刺激Hpcidin合成的最主要炎性因子,可通過刺激Hpcidin的合成調節鐵的代謝,導致貧血的發生。本研究探討淋巴瘤患兒血清Hpcidin、IL-6水平與貧血的關系,以進一步揭示淋巴瘤相關性貧血的發病機制。
1資料與方法
1.1臨床資料2011年12月~2013年12月鄭州大學第一附屬醫院、鄭州市兒童醫院共收治的淋巴瘤患兒69例。入選標準:①依據病理(細胞)形態學、免疫學和細胞、分子遺傳學確診為淋巴瘤;②經骨髓細胞學檢查明確無骨髓浸潤。排除標準:①有明確引起貧血的其他疾病,如新近和活動性出血、血液系統疾病、嚴重心肝腎功能損害,合并其他腫瘤;②淋巴瘤合并骨髓浸潤。根據WHO貧血標準[2]將69例患兒分為貧血組15例(男12例、女3例,年齡8個月~12歲、平均6.19歲)和非貧血組54例(男37例、女17例,年齡1~13歲、平均6.57歲)。同期選取鄭州大學第一附屬醫院兒科門診健康體檢兒童15例(男9例、女6例,年齡1~12歲、平均6.71歲)作為正常對照組。以上患兒及健康兒童均未接受補鐵、重組人促紅細胞生成素及輸血治療。各組性別、年齡比較差異無統計學意義。
1.2檢測方法早晨采集3組空腹外周靜脈血5 mL,取2 mL測定血紅蛋白水平,另3 mL離心(3 000 r/min)20 min,取上清,-80 ℃冰箱保存備用。采用ELISA法檢測Hepcidin、IL-6水平,依據說明書進行操作。
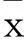
2結果
2.13組血清Hepcidin、IL-6水平比較3組血清Hepcidin、IL-6水平比較差異有統計學意義(P均<0.05);貧血組Hepcidin及IL-6水平高于非貧血組和正常對照組,非貧血組高于正常對照組,差異均有統計學意義(P均<0.05)。見表1。
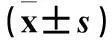
表1 3組血清Hepcidin、IL-6水平比較
注:與非貧血組、正常對照組比較,*P<0.05;與正常對照組比較,**P<0.05。
2.2 血清Hepcidin、IL-6水平與貧血的關系淋巴瘤貧血患兒血清Hepcidin水平與血紅蛋白水平呈負相關(r=-0.765,P=0.003),血清Hepcidin水平與IL-6水平呈正相關(r=0.657,P=0.014)。
3討論
貧血是淋巴瘤常見并發癥,但在臨床診療中往往忽視貧血對患者的影響。郭春寶等[3]研究顯示,50%的淋巴瘤貧血患兒沒有接受貧血治療。貧血時組織和細胞缺氧,可抑制正常組織和細胞的增殖,促進細胞分化、凋亡和壞死,可致腫瘤細胞發生適應性改變,導致腫瘤進展和腫瘤治療抵抗[4]。初治淋巴瘤患兒的貧血主要原因為ACD。ACD的發病機制尚未完全闡明,目前認為是由原發疾病啟動的免疫反應所介導;激活的免疫細胞主要是單核-巨噬細胞和CD3+T細胞分泌多組炎性細胞因子,誘發了肝臟Hepcidin水平升高及鐵代謝異常、紅系造血前體細胞增殖受損、促紅細胞生成素生成減少及反應鈍化、紅細胞壽命縮短等,從而導致貧血[5]。大量研究表明,IL-6在ACD的發生和發展中起著重要作用。鐵代謝異常是ACD的突出特點,Hepcidin是鐵代謝的核心激素。
Hepcidin是2000年由Krause和Park同時發現的一種抗菌多肽[6],屬防衛素蛋白家族,主要由肝臟合成,此外在單核-巨噬細胞、脂肪細胞、腎小管上皮細胞、胃腸黏膜細胞及心臟與肌肉細胞中均有少量表達。Hepcidin在維持機體的鐵動態平衡中起關鍵作用。其調節鐵代謝的機制是:Hepcidin分泌入血后與鐵輸出細胞(巨噬細胞、腸上皮細胞、肝細胞)表面的跨膜鐵輸出蛋白(FPN)結合,啟動hepcidin-FPN復合物的內化、降解,使鐵輸出減少,從而對鐵代謝起到負向調節作用。這種負調控作用導致體內可用于合成血紅蛋白的原料鐵減少,骨髓幼紅細胞成熟受阻,在ACD發病機制中起著至關重要的作用。目前,有多項研究表明,Hepcidin通過影響鐵代謝促進ACD的發生[7]。Sasu等[8]認為Hepcidin水平與炎性因子密切相關,是診斷貧血和判斷療效的有效指標,是鐵轉運的負性調節劑。Hohaus等[9]研究發現,霍奇金淋巴瘤患者血清中的Hepcidin的表達高于健康正常對照組,而且霍奇金淋巴瘤合并貧血患者血清中Hepcidin的表達水平更高,Massaki等[10]對非霍奇金淋巴瘤患者進行1年的前瞻性研究發現,血紅蛋白水平在高Hepcidin組明顯高于低Hepcidin組。本研究結果顯示,淋巴瘤合并貧血患兒血清中Hepcidin表達水平不僅高于正常對照組,而且也高于非貧血組;血清Hepcidin表達水平與血紅蛋白水平呈負相關。這與Hohaus研究結果一致。隨著血清Hepcidin表達水平增加,血紅蛋白水平下降,提示Hepcidin表達水平的上調參與了淋巴瘤貧血的發生。
作為多效免疫調節細胞因子,IL-6在ADC發生、發展中起著重要作用。人類編碼Hepcidin的基因(HAMP)位于第19號染色體上,但研究發現在HAMP中并沒有找到鐵元素的作用位點,提示Hepcidin對鐵代謝的調節可能通過某種介質進行,而不是直接通過鐵水平來實現的[11]。有明確證據表明,IL-6能誘導編碼Hepcidin的基因表達,促進Hepcidin合成[12]。在體外細胞培養中發現IL-6可有效誘導Hepcidin的產生。體外細胞培養證實,IL-6可介導Hepcidin mRNA表達增加,認為脂多糖刺激了IL-6表達,繼而導致Hepcidin表達的增加,Hepcidin又通過鐵代謝的異常最終引起貧血[13]。本研究顯示,淋巴瘤合并貧血患兒血清中IL-6表達高于非貧血組及正常對照組,而且非貧血組患兒血清中IL-6表達也高于正常對照組。Hepcidin在淋巴瘤合并貧血患兒血清中的表達水平與IL-6的表達呈正相關。提示隨著淋巴瘤患兒血清中IL-6表達水平的增加,Hepcidin表達水平也增加。有研究顯示,在2例Castleman病患者體內注入抗IL-6受體,抗體能快速降低血清Hepcidin的水平,從而提升血紅蛋白水平[14]。提示淋巴瘤的發生與循環系統中IL-6的生成和釋放有關,IL-6能刺激肝臟合成Hepcidin,高水平的Hepcidin導致巨噬細胞內鐵的滯留,用于紅細胞生成的原料鐵不足,從而導致貧血的發生。
淋巴瘤合并貧血會加重患兒臨床癥狀,影響生活質量,增加死亡風險及醫療費用的投入。輸血及補充鐵劑、促紅細胞生成素(EPO)治療可改善淋巴瘤合并貧血患兒的臨床癥狀,但輸血不良后果較多,EPO治療效果有限,及早降低血清Hepcidin、IL-6水平可能會成為治療淋巴瘤患兒貧血癥狀的另一種有效方法。
參考文獻:
[1] Ludwig H, van Belle S, Barrett-Lee P, et al. The European cancer anemia survey(ECAS):a large,multinational, prospective survey defining the prevalence,incidence, and treatment of anemia in cancer patients[J]. Eur J Cancer, 2004,40(15):2293-2306.
[2] Bokemeyer C, Aapro MS, Courdi A, et al. European Organisation for Research and Treatment of Cancer (EORTC) Taskforce for the Elderly. EORTC guidelines for the use of erythropoietic proteins in anaemic patients with cancer: 2006 update[J]. Eur J Cancer, 2007,43(2): 258-270.
[3] 郭春寶,金先慶,王珊,等.兒童淋巴瘤病人貧血狀況回顧性調查評估[J].臨床小兒外科雜志,2008,7(1):15-19.
[4] Lutterbach J, Guttenberger R. Anemia is associated with deceased local aontrol of surgically treated squamous cell carcinomas of the glottic larynx[J]. Int J Radiat Oncol Phys, 2000,48(5):1345-1350.
[5] Weiss G, Goodnough LT.Anemia of Chronic Disease[J]. N Engl J Med, 2005,352(10):1011-1023.
[6] Krause A, Neitz S, M?gert HJ, et al. LEAP-1, a novel highly disulfide-bonded human peptide, exhibits antimicrobial activity[J]. FEBS Letters, 2000,480(2):147-150.
[7] Aapro M, Osterborg A, Gascon P, et al. Prevalence and management of cancer-related anemia, iron deficiency and the specific role of i. viron[J]. Ann Oncol, 2012,23(8):1954-1962.
[8] Sasu BJ, Li H, Rose MJ, et al. Serum hepcidin but not prohepcidin may be an effective maker for anemia of inflammation(AI)[J]. Blood Cell Mol Dis, 2010,45(3):238.
[9] Hohaus S, Massini G, Giachelia M, et al. Anemia in Hodgkin's lymophoma:the role of interleukin-6 and hepcidin[J]. J Clin Oncol, 2010,28(15):2538-2543.
[10] Masaki H, Minoru A, Ken T, et al. Serum hepcidin-25 level linked with high mortality in patients with non-Hodgkin lymphoma[J]. Ann Hematology, 2015,94(4):603-608.
[11] Piperno A, Mariani R, Trombini P, et al. Hepcidin modulation in human diseases: from research to clinic[J]. World J Gastroenterol, 2009, 15(5): 538.
[12] Nemeth E, Rivera S, Gabayan V, et al. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin[J]. J Clin Investi, 2004, 113(9): 1271-1276.
[13] Kanda J, Uchiyama T, Tomousugi N, et al. Oncostation M and Leukemia inhibitory factor increase Hepcidin expressin in hepatoma cell lines[J]. Int J Hematol, 2009,90(6):545-552.
[14] Roy CN, Mak HH, Akpan I, et al. Hepcidin antimicrobial peptide transgenic mice exhibit features of the anemia of inflammation[J]. Blood, 2007,109(9):4038-4044.
(收稿日期:2015-09-23)
中圖分類號:R725.6
文獻標志碼:B
文章編號:1002-266X(2016)09-0062-03
doi:10.3969/j.issn.1002-266X.2016.09.024

