體外診斷試劑質(zhì)量控制標(biāo)準(zhǔn)研究
郭世富 黃 穎 母瑞紅 李靜莉
?
體外診斷試劑質(zhì)量控制標(biāo)準(zhǔn)研究
郭世富①國家食品藥品監(jiān)督管理總局醫(yī)療器械標(biāo)準(zhǔn)管理中心 中國食品藥品檢定研究院 北京 100050黃 穎①母瑞紅①李靜莉①

[摘要]目的:體外診斷試劑標(biāo)準(zhǔn)是監(jiān)管的重要依據(jù),完善質(zhì)量控制標(biāo)準(zhǔn),有效提高體外診斷試劑的質(zhì)量,以保障大眾用械安全有效。方法:調(diào)研國內(nèi)體外診斷醫(yī)療器械產(chǎn)業(yè)和標(biāo)準(zhǔn)情況,對比國外標(biāo)準(zhǔn)的體系建設(shè)情況,對我國體外診斷試劑的國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)的分布及實施情況進行分析。結(jié)果:體外診斷產(chǎn)品種類數(shù)量多,各地分布不統(tǒng)一,雖然近年我國體外標(biāo)準(zhǔn)質(zhì)量和數(shù)量有很大提升,但與國外相比標(biāo)準(zhǔn)體系有待完善。結(jié)論:借鑒國外先進經(jīng)驗,提出完善我國體外診斷試劑標(biāo)準(zhǔn)體系和強化標(biāo)準(zhǔn)宣傳貫徹等措施,以提升我國體外診斷試劑質(zhì)量控制標(biāo)準(zhǔn)水平。
[關(guān)鍵詞]體外診斷試劑;標(biāo)準(zhǔn);法規(guī);質(zhì)量控制
[First-author’s address] Center for Medical Device Standardization Administration, CFDA (National Institutes for Food and Drug Control), Beijing 100050, China.
目前,體外診斷產(chǎn)品在臨床上用于疾病的預(yù)測、預(yù)防、診斷、治療監(jiān)測、預(yù)后觀察和健康狀態(tài)評價,公眾對體外診斷試劑產(chǎn)品的質(zhì)量評價越來越關(guān)注,政府監(jiān)管越來越重視,質(zhì)量評價標(biāo)準(zhǔn)的適宜性越來越重要[1-7]。為此,本研究結(jié)合參與國家食品藥品監(jiān)督管理總局“體外診斷試劑質(zhì)量評估和綜合治理”的實踐,對我國體外診斷試劑的國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)的分布及實施情況進行調(diào)研探討,對體外診斷試劑產(chǎn)品國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)及注冊產(chǎn)品標(biāo)準(zhǔn)(產(chǎn)品技術(shù)要求)在上市后監(jiān)管各個環(huán)節(jié)中的作用進行分析,為加強體外診斷試劑標(biāo)準(zhǔn)管理提供參考。
1 我國體外診斷試劑產(chǎn)業(yè)情況
近年來,我國診斷試劑產(chǎn)業(yè)發(fā)展迅猛,體外診斷試劑可分為生化診斷試劑、免疫診斷試劑、血液學(xué)診斷試劑、分子診斷試劑以及培養(yǎng)基等[8]。根據(jù)國際研究公司Kalorama Information在《China Healthcare Reform and Its Impact On IVD,Pharma and Device Markets》報告分析的數(shù)據(jù),我國體外診斷產(chǎn)品種類分布比例如圖1所示[9]。
我國各省、市體外診斷企業(yè)及產(chǎn)品數(shù)量差異顯著,體外診斷產(chǎn)品種類數(shù)量多,總體而言,生化、免疫類占絕大部分,其他品類較雜,各省、市分布不同,其體外診斷產(chǎn)品種類統(tǒng)計見表1。
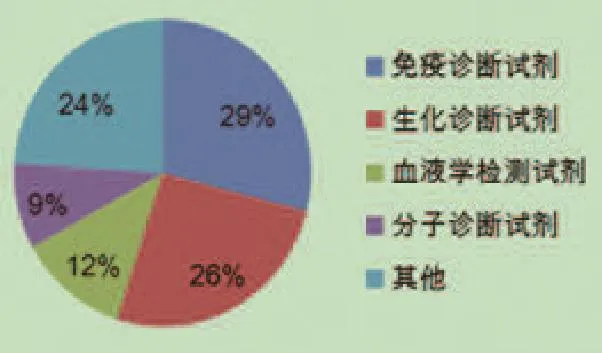
圖1 我國體外診斷產(chǎn)品種類示意圖
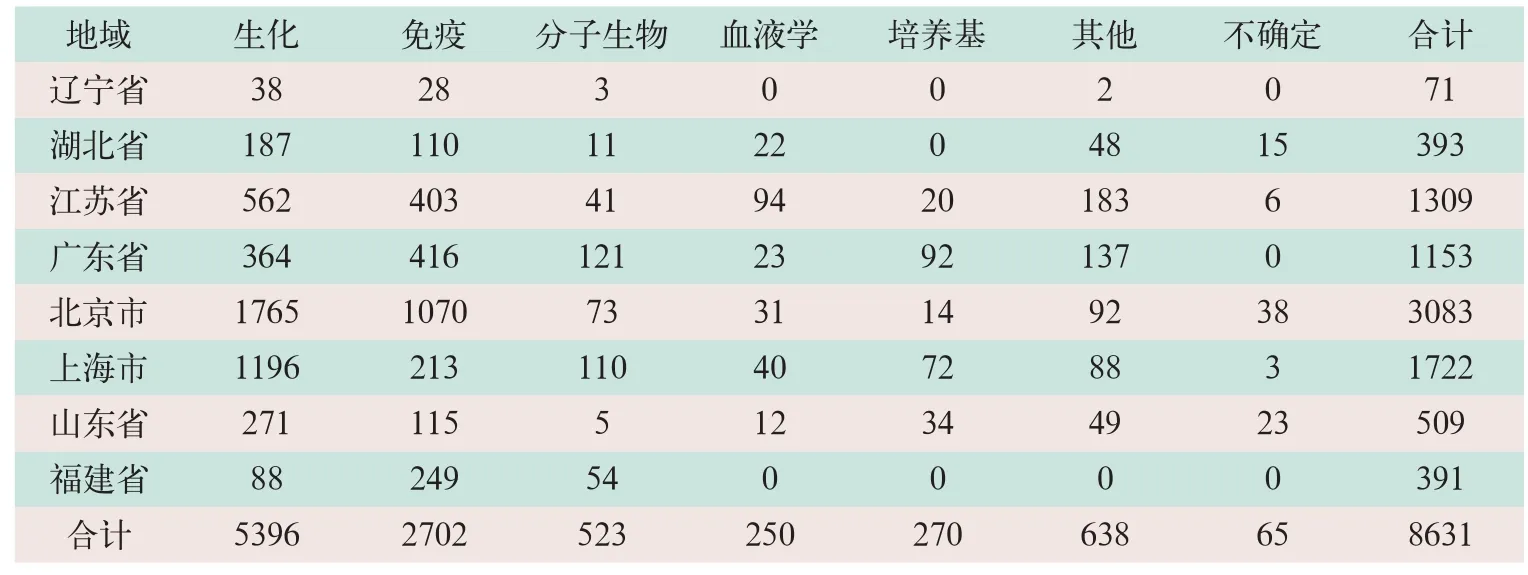
表1 我國相關(guān)省、市體外診斷產(chǎn)品種類分布
2 我國體外診斷試劑醫(yī)療器械標(biāo)準(zhǔn)
2.1 體外診斷試劑標(biāo)準(zhǔn)現(xiàn)狀
體外診斷試劑標(biāo)準(zhǔn)在體外診斷試劑產(chǎn)品生產(chǎn)和行業(yè)監(jiān)管中起著越來越重要的作用[10]。標(biāo)準(zhǔn)猶如大樹之樹干,是產(chǎn)品質(zhì)量保證的基礎(chǔ),可謂牽一發(fā)而動全身[11-12]。為了滿足行業(yè)監(jiān)管需要,我國正在加快體外診斷產(chǎn)品國家標(biāo)準(zhǔn)及行業(yè)標(biāo)準(zhǔn)制訂、修訂工作。全國醫(yī)用臨床檢驗實驗室和體外診斷系統(tǒng)標(biāo)準(zhǔn)化技術(shù)委員會(SAC/TC136)負(fù)責(zé)組織起草體外診斷試劑醫(yī)療器械標(biāo)準(zhǔn),為推動標(biāo)準(zhǔn)的制訂、修訂和貫徹實施做了大量工作[13-14]。國家食品藥品監(jiān)督管理總局成立醫(yī)療器械標(biāo)準(zhǔn)管理中心后,協(xié)調(diào)各方面資源,充足標(biāo)準(zhǔn)經(jīng)費,加強標(biāo)準(zhǔn)制訂、修訂工作流程管理,保障標(biāo)準(zhǔn)制定質(zhì)量。近年來,我國體外診斷試劑產(chǎn)品標(biāo)準(zhǔn)數(shù)量和質(zhì)量均得到很大提升。截至2015年5月,體外診斷產(chǎn)品國家行業(yè)標(biāo)準(zhǔn)數(shù)量達到172項,其中國家標(biāo)準(zhǔn)16項,行業(yè)標(biāo)準(zhǔn)156項。
2.2 體外診斷國家行業(yè)標(biāo)準(zhǔn)體系
為了更好地研究體外診斷國家行業(yè)標(biāo)準(zhǔn)體系建設(shè)情況,對體外診斷標(biāo)準(zhǔn)進行了橫向和縱向?qū)Ρ取8鶕?jù)《體外診斷試劑注冊管理辦法》和2013年國家食品藥品監(jiān)督管理總局公布梳理的體外診斷試劑產(chǎn)品分類子目錄,在產(chǎn)品品種分類子目錄中列出766種。在172項國家行業(yè)標(biāo)準(zhǔn)中,產(chǎn)品標(biāo)準(zhǔn)154項,占90%,其他(如溯源方法標(biāo)準(zhǔn)等)僅占10%。
在154項產(chǎn)品標(biāo)準(zhǔn)中,有基礎(chǔ)標(biāo)準(zhǔn)和具體產(chǎn)品標(biāo)準(zhǔn)(包括21項體外診斷儀器標(biāo)準(zhǔn))。其中基礎(chǔ)標(biāo)準(zhǔn)10項,包括6項產(chǎn)品標(biāo)示信息的標(biāo)準(zhǔn)、1項術(shù)語標(biāo)準(zhǔn)(生物芯片術(shù)語)、2項原材料(體外診斷用水、芯片用醛基基片)以及1項命名標(biāo)準(zhǔn)。具體產(chǎn)品標(biāo)準(zhǔn)包括21項體外診斷儀器標(biāo)準(zhǔn)和123項具體試劑標(biāo)準(zhǔn)。124項具體體外診斷試劑標(biāo)準(zhǔn)在各個分類學(xué)科中的分布見表2。
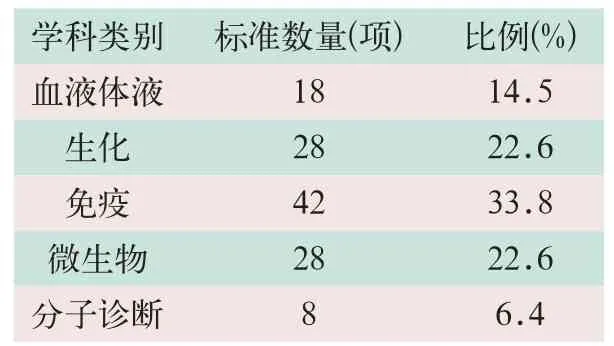
表2 體外診斷試劑標(biāo)準(zhǔn)分類統(tǒng)計
表2統(tǒng)計數(shù)據(jù)顯示,免疫、生化領(lǐng)域標(biāo)準(zhǔn)修訂比重比較大,而其他比重比則較小,這與體外診斷試劑發(fā)展歷程以及在臨床應(yīng)用情況基本相符。其中,血液體液的常規(guī)產(chǎn)品包括血液分析、凝血分析、尿液分析、血流變分析及血型檢測,目前制定的標(biāo)準(zhǔn)基本能夠覆蓋。生化類有生化試劑盒的通用技術(shù)要求標(biāo)準(zhǔn),以及結(jié)合具體品種的產(chǎn)品標(biāo)準(zhǔn)。免疫類包括酶聯(lián)免疫吸附、化學(xué)發(fā)光、時間分辨熒光、免疫層析、免疫組化及流式細(xì)胞技術(shù)等常見免疫學(xué)分析方法的標(biāo)準(zhǔn);涉及到激素檢測、血清蛋白檢測、病原體檢測及腫瘤標(biāo)記物檢測等試劑。微生物類制定有各類微生物培養(yǎng)基、微生物鑒定以及微生物藥物敏感性測試紙片等標(biāo)準(zhǔn)。分子診斷類,近年來陸續(xù)制定了涉及聚合酶鏈?zhǔn)椒磻?yīng)(polymerase chain reaction,PCR)、熒光原位雜交技術(shù)(fluorescence in situ hybridization,F(xiàn)ISH)以及基因芯片技術(shù)的各類標(biāo)準(zhǔn)。
2.3 體外診斷產(chǎn)品標(biāo)準(zhǔn)與體外診斷分類子目錄比較
體外診斷標(biāo)準(zhǔn)與體外診斷分類子目錄進行比較,具體產(chǎn)品標(biāo)準(zhǔn)覆蓋分類子目錄中3個大類15個小類的97個產(chǎn)品,占分類子目錄中產(chǎn)品總數(shù)的13%。未涉及到的6小類包括:①Ⅲ-4與遺傳性疾病相關(guān)的試劑;②Ⅲ-5與麻醉藥品、精神藥品及醫(yī)療用毒性藥品檢測相關(guān)的試劑;③Ⅲ-8與變態(tài)反應(yīng)(過敏原)相關(guān)的試劑;④Ⅱ-6用于維生素檢測的試劑;⑤Ⅱ-8用于藥物及藥物代謝物檢測的試劑;⑥Ⅱ-9用于自身抗體檢測的試劑。這6小類產(chǎn)品的共同特點是臨床用量小,生產(chǎn)廠商數(shù)量少,產(chǎn)品方法學(xué)繁雜,具體標(biāo)準(zhǔn)的制定尚在推進中。
3 國外體外診斷產(chǎn)品標(biāo)準(zhǔn)制訂情況
(1)國際標(biāo)準(zhǔn)化組織(International Organization for Standardization,ISO)是國際標(biāo)準(zhǔn)化工作的權(quán)威機構(gòu),其中ISO/TC212(臨床實驗室檢測和體外診斷試驗系統(tǒng))負(fù)責(zé)醫(yī)學(xué)實驗室和體外診斷試驗系統(tǒng)方面的標(biāo)準(zhǔn)化和指南性工作,包括質(zhì)量管理、檢驗前和檢驗后程序、分析性能、實驗室安全、參考系統(tǒng)和質(zhì)量保證。目前,ISO秘書處設(shè)在美國臨床實驗室標(biāo)準(zhǔn)化協(xié)會(Clinical and Laboratory Standards Institute,CLSI)[15-17]。
(2)ISO/TC 212下設(shè)5個工作組,即第1工作組(WG1,Quality and competence in the medical laboratory醫(yī)學(xué)實驗室質(zhì)量和能力);第2工作組(WG2,Reference systems參考系統(tǒng));第3工作組(WG3,In vitro diagnostic products體外診斷產(chǎn)品);第4工作組(WG4,Antimicrobial susceptibility test微生物敏感性測試);第5工作組(WG5,Laboratory biorisk management實驗室生物安全管理)。
(3)ISO/TC 212在成立20年以來的時間里共發(fā)布24項標(biāo)準(zhǔn),其中包括醫(yī)學(xué)實驗室質(zhì)量和能力6項、參考系統(tǒng)5項、體外診斷產(chǎn)品10項以及微生物敏感性測試3項。在24項標(biāo)準(zhǔn)中ISO15189、ISO17511、ISO15193、ISO15194及ISO15195等均為具有很強影響力的關(guān)于醫(yī)學(xué)實驗室、溯源和參考測量系統(tǒng)的標(biāo)準(zhǔn),在全世界得到廣泛應(yīng)用。
歐洲標(biāo)準(zhǔn)由歐盟標(biāo)準(zhǔn)化機構(gòu)管理。歐洲標(biāo)準(zhǔn)化委員會(CEN)的CEN/TC140負(fù)責(zé)體外診斷醫(yī)療器械標(biāo)準(zhǔn)化工作體外診斷醫(yī)療器械技術(shù)委員會,負(fù)責(zé)體外診斷醫(yī)療器械標(biāo)準(zhǔn)化工作。CEN/TC140下設(shè)5個工作組:①CEN/TC 140/WG 3醫(yī)學(xué)實驗室質(zhì)量管理,秘書處設(shè)在BSI(英國標(biāo)準(zhǔn)協(xié)會);②CEN/TC 140/WG 4參考系統(tǒng),秘書處設(shè)在DS(丹麥標(biāo)準(zhǔn)協(xié)會);③CEN/TC 140/WG 5樣本容器,秘書處設(shè)在DIN;④CEN/TC 140/WG 9外部質(zhì)量評價方案的使用,秘書處設(shè)在DIN;⑤CEN/TC 140/WG 10抗菌劑敏感性試驗,秘書處設(shè)在DIN,CEN/TC140發(fā)布7項標(biāo)準(zhǔn)。
(4)歐盟協(xié)調(diào)標(biāo)準(zhǔn)是指與歐盟法規(guī)相配套的標(biāo)準(zhǔn),由各成員國轉(zhuǎn)化為成員國標(biāo)準(zhǔn),按協(xié)調(diào)標(biāo)準(zhǔn)生產(chǎn)的標(biāo)準(zhǔn),可以假定是符合指令的基本要求。歐盟共發(fā)布了26項體外診斷醫(yī)療器械協(xié)調(diào)標(biāo)準(zhǔn),其中有CEN的CEN/TC140制定的標(biāo)準(zhǔn),也有CEN下其他醫(yī)療器械TC制定的標(biāo)準(zhǔn),且認(rèn)可ISO的部分標(biāo)準(zhǔn)。在26項標(biāo)準(zhǔn)中,有電氣安全標(biāo)準(zhǔn)、軟件標(biāo)準(zhǔn)、標(biāo)示信息標(biāo)準(zhǔn)、方法標(biāo)準(zhǔn)、質(zhì)量管理體系標(biāo)準(zhǔn)及樣本容器標(biāo)準(zhǔn)等,關(guān)于產(chǎn)品標(biāo)準(zhǔn)只有2項,即培養(yǎng)基標(biāo)準(zhǔn)、自測血糖標(biāo)準(zhǔn)。
(5)美國CLSI是重要的標(biāo)準(zhǔn)化機構(gòu),涉及標(biāo)準(zhǔn)化9大領(lǐng)域:即自動化和信息、臨床化學(xué)和毒理學(xué)、評價方案、血液學(xué)、免疫和配體分析、微生物學(xué)、分子生物學(xué)方法、POCT、質(zhì)量體系和實驗室操作。迄今為止,CLSI發(fā)布的標(biāo)準(zhǔn)為366項,按其內(nèi)容主要分為兩大類:①實驗室檢驗程序的標(biāo)準(zhǔn)化,如檢驗前程序、檢驗中程序及檢驗后程序的標(biāo)準(zhǔn)化;②實驗室所使用方法的標(biāo)準(zhǔn)化,如參考方法的定義、描述和發(fā)布。兩大類標(biāo)準(zhǔn)的最終目的都是為了促進“檢驗結(jié)果的一致性”。CLSI的方法學(xué)評價標(biāo)準(zhǔn)(EP文件)被全球范圍內(nèi)的體外診斷產(chǎn)品制造商和監(jiān)管機構(gòu)廣為接受,這些標(biāo)準(zhǔn)為體外診斷產(chǎn)品的性能評價提供了依據(jù)和參考。CLSI的許多標(biāo)準(zhǔn)被美國食品藥品監(jiān)督管理局(Food Drug Administration,F(xiàn)DA)認(rèn)可和使用[18]。
4 我國體外診斷試劑醫(yī)療標(biāo)準(zhǔn)制(修)訂及實施
通過對體外診斷試劑醫(yī)療標(biāo)準(zhǔn)制(修)訂的調(diào)研,借鑒國際各標(biāo)準(zhǔn)權(quán)威機構(gòu)體外診斷試劑標(biāo)準(zhǔn)的制定,提出完善我國體外診斷試劑標(biāo)準(zhǔn)體系和強化標(biāo)準(zhǔn)宣傳貫徹措施,以提升我國體外診斷試劑質(zhì)量控制標(biāo)準(zhǔn)水平[7-8]。
4.1 加大標(biāo)準(zhǔn)宣傳貫徹力度 提高標(biāo)準(zhǔn)執(zhí)行能力
充分利用網(wǎng)絡(luò)信息技術(shù),加強體外診斷標(biāo)準(zhǔn)的宣傳,增加標(biāo)準(zhǔn)可獲得時效性。同時,在管理部門、檢驗檢測機構(gòu)和生產(chǎn)企業(yè)等部門均需加強標(biāo)準(zhǔn)宣傳貫徹和實際操作培訓(xùn)。隨著標(biāo)準(zhǔn)數(shù)量和質(zhì)量的提升,迫切需要統(tǒng)一對標(biāo)準(zhǔn)的理解,便于實施。目前的體外診斷試劑國家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn)多為推薦性標(biāo)準(zhǔn),在監(jiān)督抽驗、生產(chǎn)體系考核及產(chǎn)品延續(xù)注冊等監(jiān)管環(huán)節(jié)執(zhí)行時尚無充分的法律依據(jù)。在技術(shù)審評、監(jiān)督抽驗中不能強制性要求企業(yè)執(zhí)行,企業(yè)對強制要求執(zhí)行推薦性標(biāo)準(zhǔn)有較大疑義,從而造成各地檢測尺度不一致、審評把握尺度不一致。因此,急需對標(biāo)準(zhǔn)進行宣傳貫徹,統(tǒng)一適用性認(rèn)識,統(tǒng)一檢測尺度,以提高標(biāo)準(zhǔn)執(zhí)行能力。
4.2 加強標(biāo)準(zhǔn)體系的研究 促進標(biāo)準(zhǔn)的制(修)訂
體外診斷試劑產(chǎn)品項目種類、檢測方法繁多,檢測技術(shù)飛速發(fā)展,新的檢測方法和平臺不斷推陳出新,在繼續(xù)制定產(chǎn)品標(biāo)準(zhǔn)的同時應(yīng)加大對國外體外診斷標(biāo)準(zhǔn)體系的研究,更加關(guān)注方法學(xué)(尤其是新興技術(shù)方法學(xué))標(biāo)準(zhǔn),參考體外診斷系統(tǒng)、實驗室質(zhì)量控制標(biāo)準(zhǔn)的研究結(jié)果,制定通用的基礎(chǔ)標(biāo)準(zhǔn),形成體外診斷系統(tǒng)質(zhì)量控制整體新思路,切實提高標(biāo)準(zhǔn)服務(wù)產(chǎn)業(yè)、服務(wù)監(jiān)管的服務(wù)水平。及時收集監(jiān)管機構(gòu)、審評機構(gòu)以及生產(chǎn)企業(yè)標(biāo)準(zhǔn)使用過程中發(fā)現(xiàn)的問題,加快組織問題標(biāo)準(zhǔn)的制(修)訂。
4.3 統(tǒng)一標(biāo)準(zhǔn)物質(zhì)管理 完善管理實施細(xì)則
體外診斷試劑標(biāo)準(zhǔn)的實施大多依賴標(biāo)準(zhǔn)物質(zhì)(質(zhì)控盤)完成。與此同時,產(chǎn)品開發(fā)、溯源、監(jiān)督抽驗和質(zhì)量控制過程需要標(biāo)準(zhǔn)物質(zhì)(質(zhì)控盤),從法律法規(guī)角度而言,《體外診斷注冊管理辦法》規(guī)定了由中國食品藥品檢定研究院負(fù)責(zé)國家標(biāo)準(zhǔn)物質(zhì)的管理和研發(fā),但目前尚缺乏明確的實施細(xì)則。此外,其他機構(gòu)也提供標(biāo)準(zhǔn)物質(zhì),標(biāo)準(zhǔn)物質(zhì)管理不統(tǒng)一,造成標(biāo)準(zhǔn)物質(zhì)信息不充分等問題。同時,標(biāo)準(zhǔn)物質(zhì)的制備工藝復(fù)雜,有些原料的獲得較為困難,導(dǎo)致標(biāo)準(zhǔn)物質(zhì)數(shù)量缺口較大,對于某些標(biāo)準(zhǔn)物質(zhì)的缺乏,已成為產(chǎn)品研發(fā)、臨床檢驗測量方法標(biāo)準(zhǔn)化、試劑溯源和醫(yī)學(xué)檢驗結(jié)果互認(rèn)的瓶頸。因此,急需完善標(biāo)準(zhǔn)物質(zhì)管理實施細(xì)則。
5 結(jié)語
應(yīng)依據(jù)《體外診斷試劑注冊管理辦法》,細(xì)化標(biāo)準(zhǔn)物質(zhì)管理細(xì)則,統(tǒng)一管理。國家食品藥品監(jiān)督管理總局需要加強與各部門的溝通,爭取國家科技支撐資金支持,加大標(biāo)準(zhǔn)品研發(fā)力度,以提高體外診斷試劑產(chǎn)品的質(zhì)量控制標(biāo)準(zhǔn)水平。
參考文獻
[1]中華人民共和國國務(wù)院令.第650號.醫(yī)療器械監(jiān)督管理條例[S].中華人民共和國國務(wù)院,2014-02-12.
[2]國家食品藥品監(jiān)督管理總局令.第5號.體外診斷試劑注冊管理辦法[S].國家食品藥品監(jiān)督管理總局, 2014-06-27.
[3]安撫東.我國醫(yī)療器械監(jiān)管法規(guī)體系建設(shè)之思考[J].中國藥事,2007,21(7):453-459.
[4]孫立魁,施燕平.我國體外診斷試劑質(zhì)量現(xiàn)狀分析[J].中國醫(yī)療器械信息,2011,17(3):1-3.
[5]李彬,李曉霞,劉春莉,等.體外診斷試劑監(jiān)管分析[J].中國醫(yī)藥科學(xué),2012,2(8):138-139.
[6]章宏法,張敏紅.醫(yī)療機構(gòu)體外診斷試劑使用管理現(xiàn)狀調(diào)查及思考[J].中國醫(yī)療設(shè)備,2010,25(11):10-13.
[7]黃穎,郭世富,母瑞紅,等.體外診斷試劑液體輔助試劑分類界定初步研究[J].中國藥事,2013,22(11): 1250-1250.
[8]鄢盛愷.關(guān)于我國臨床檢驗醫(yī)學(xué)設(shè)備的現(xiàn)狀與發(fā)展問題的思考[J].中華檢驗醫(yī)學(xué)雜志,2005,28(12): 1327.
[9]China Healthcare Reform and Its Impact On IVD.Pharma and Device Markets[M].Kalorama Information,2011:20-30.
[10]梁洪,郭寶萍.體外診斷試劑(藥品)經(jīng)營質(zhì)量管理現(xiàn)狀、問題及解決方法[J].首都醫(yī)藥,2013,23(14): 10-11.
[11]王菲菲,王箐舟,張春濤.體外生物診斷試劑參考物質(zhì)的現(xiàn)狀與發(fā)展[J].中國藥事,2013,27(3):318-323.
[12]戴捷,蘇磊.體外診斷試劑有效管理與質(zhì)量安全控制的探討[J].中國醫(yī)學(xué)裝備,2011,8(11):80-81.
[13]劉艷,孫楠,王玉梅,等.體外診斷試劑行業(yè)標(biāo)準(zhǔn)制定工作的現(xiàn)狀分析及展望[J].中國醫(yī)療器械雜志, 2014,38(6):448-450.
[14]仇保躍.探討體外診斷試劑成本監(jiān)管與檢驗設(shè)備性能評價體系的建立[J].中國醫(yī)學(xué)裝備,2014,11(8): 87-89.
[15]EU.European Standardization[S].EU,2015.
[16]ISO/TC 212.Clinical laboratory testing and in vitro diagnostic test systems[S].ISO/ TC212,2015.
[17]Clinical and Laboratory Standards Institute. CLSI Guidelines[S].Clinical and Laboratory Standards Institute,2015.
[18]FDA.Overview of Device Regulation[S].FDA,2015.
Research on the IVD quality control standard/GUO Shi-fu, HUANG Ying, MU Ruihong, et al// China Medical Equipment,2016,13(1):28-31.
[Abstract]Objective: The standard of In Vitro Diagnostic medical device(IVD) is an important basis for the supervision. To improve the quality control standards, effectively improve the quality of in vitro diagnostic reagents, and ensure the safety and effective of IVD. Methods: To study IVD industry and standard system in FDA, European and China. The analysis was carried out on the distribution and the implementation of the IVD standard. Results: Distribution of the type of IVD is different in different region. In recent years, the quality and quantity of our country’s standard has been greatly improved. The standard system needs to be improved compared with the standard systems of foreign countries. Conclusion: To reference standard regulation in FDA and European, some measures were put forward on the perfecting standard system and strengthening standard training to enhance the quality control standards in my country.
[Key words]In vitro diagnostic reagents; Standard; Regulation; Quality control
收稿日期:2015-10-23
DOI:10.3969/J.ISSN.1672-8270.2016.01.009
[文章編號]1672-8270(2016)01-0028-04
[中圖分類號]R197.39
[文獻標(biāo)識碼]A
作者簡介
郭世富,男,(1977- ),博士,高級工程師。國家食品藥品監(jiān)督管理總局醫(yī)療器械標(biāo)準(zhǔn)管理中心 中國食品藥品檢定研究院,從事醫(yī)療器械監(jiān)管及標(biāo)準(zhǔn)管理研究工作。
- 中國醫(yī)學(xué)裝備的其它文章
- 美國GE AMX-4移動X光機維修案例
- GE 8800 C臂X光機立柱升降控制系統(tǒng)改進
- 射頻識別系統(tǒng)對醫(yī)療設(shè)備安全有效性的影響
- 益氣活血方藥對缺血性腦損傷保護作用的實驗研究進展**基金項目:國家自然科學(xué)基金青年基金(81403288)“基于腦缺血動物模型的“腎通于腦”中醫(yī)理論的生物學(xué)實質(zhì)研究”;黑龍江省自然科學(xué)基金(QC2015102)“基于腦缺血動物模型的“腎通于腦”中醫(yī)理論的生物學(xué)實質(zhì)研究”;黑龍江省政府博士后資助基金(LBHZ13200)“針刺補腎改善性腺切除動物記憶障礙的機制研究”
- CT質(zhì)量控制檢測分析
- 羥乙基纖維素與再生氧化纖維素止血紗布理化性質(zhì)的對比研究

