多種過繼性細胞免疫聯合替吉奧治療老年晚期胃癌患者的臨床研究
張曉蕾,魏瑋,楊春梅,劉曰芬,郭海生,王旬果(山東省東營市人民醫院腫瘤科,山東東營257000)
?
多種過繼性細胞免疫聯合替吉奧治療老年晚期胃癌患者的臨床研究
張曉蕾,魏瑋,楊春梅,劉曰芬,郭海生,王旬果
(山東省東營市人民醫院腫瘤科,山東東營257000)
摘要:目的探討多種過繼性細胞免疫(ACI)聯合替吉奧治療老年晚期胃癌患者的近期療效,觀察兩組的有效性、安全性及患者的生活質量。方法選取該院32例初治為晚期胃癌的老年患者,按照擬定的納入及排除標準,采用隨機數字表法隨機分為兩組:聯合治療組(多種ACI聯合替吉奧治療)和對照組(單用替吉奧)。通過影像學、實驗室檢查結果觀察臨床療效、患者生活質量改善狀況及毒性反應。結果老年晚期胃癌患者應用聯合組的中位無進展生存期(PFS)為4.7個月,對照組的中位PFS為3.9個月,差異有統計學意義(P<0.05)。聯合治療組改善失眠、乏力、食欲等的效果優于對照組,可顯著改善患者生活質量。聯合組與對照組的不良反應比較,僅增加發生率極低的發熱癥狀,安全性高。結論多種ACI聯合替吉奧治療老年晚期胃癌患者的中位PFS較單獨應用替吉奧患者明顯延長,疾病控制率和有效率提高,患者的生活質量明顯提高,毒性反應更低、更安全,免疫力也顯著提高。
關鍵詞:過繼性細胞免疫治療;替吉奧膠囊;晚期胃癌;生活質量;免疫功能
我國是胃癌高發國家之一,根據2013年最新發布的中國腫瘤發病率排行,胃癌的發病率居第2位。胃癌多發于中老年人,其高發年齡段為55~70歲。目前,隨著我國人口老齡化,加上老年人癥狀不明顯,多數胃癌患者就診時已為晚期,失去手術治療的機會。對無法切除或轉移性的晚期胃癌的治療基本上是姑息性的,包括姑息性手術、放射治療、化學藥物治療(以下簡稱化療)、生物免疫治療及中醫中藥治療。主要目的是改善不適癥狀,提高患者的生活質量,延長生命。目前,國內外晚期胃癌化療已廣泛應用,相關研究顯示,單藥有效率可達44.6%[1]。化療可作用于全身,但在殺滅腫瘤細胞的同時對無辜的健康細胞也有損傷,破壞人體的免疫功能,顯著降低免疫力,且癌細胞對藥物逐步產生耐藥性成為影響其治療效果的主要原因。近年來,過繼性細胞免疫治療(adoptive cellular immunotherapy,ACI)備受矚目,是一種新興的通過自身免疫細胞治療腫瘤的方法。主要通過采集患者的自體免疫細胞,在實驗室內進行體外培養和擴增,誘導、分化出可殺滅腫瘤的多種無免疫缺陷的自體免疫細胞,再將培養出的具有抗瘤活性的正常免疫細胞輸入腫瘤患者體內,起免疫監視、啟動自身抗瘤免疫反應、修復自身免疫系統的作用,提高腫瘤患者機體免疫力,并循序漸進的殺滅腫瘤細胞。目前應用的ACI主要包括:樹突狀細胞(dendritic cell,DC)、細胞因子誘導的殺傷細胞(cytokine-induced kill cells,CIK)、自然殺傷細胞(natural killer cell,NK)、抗CD3單克隆抗體激活的殺傷細胞(anti-CD3McAb activated killer cells,CD3AK)、γδT細胞等[2]。
1 資料與方法
1.1一般資料
選取2013年1月-2014年1月本科收治的32例符合條件的晚期胃癌患者,全部入組患者簽署知情同意書。分組方法采用隨機數字表法,32例患者隨機分入聯合治療組與對照組。兩組患者中印戒細胞癌5例,乳頭狀腺癌19例,黏液腺癌4例,管狀腺癌4例。年齡65~88歲,平均76.5歲;Kamofsky體力狀況評分(kamofsky performance status,KPS)70~90分。其中聯合治療組(多種ACI聯合替吉治療)16例,男性9例,女性7例;胃癌原發灶位于賁門7例,幽門6例,胃體3例。對照組(單用替吉奧)16例,男性10例,女性6例;胃癌原發灶位于賁門6例,幽門8例,胃體2例。兩組患者在性別、年齡、KPS評分、病理類型等臨床特征方面比較,差異無統計學意義(P>0.05),有可比性。
1.1.1納入標準經胃鏡病理檢查確診為胃癌,影像學證實臨床分期為Ⅳ期。既往未接受任何化療方案,目前患者全身狀況無法耐受靜脈化療或可耐受靜脈化療但患者及家屬拒絕。未出現明顯消化道梗阻、出血及穿孔等并發癥。KPS評分70~90分,生存期預計≥3個月。年齡65~88歲。依照實體瘤的療效評價標準(response evaluation criteria in solid tumors,RECIST)1.1,所有入組患者有≥1個客觀可測量病灶。
1.1.2排除標準①無可測量病灶;②嚴重冠狀動脈粥樣硬化性心臟病或重要臟器功能不全;③不易控制的精神病史;④聯合組中對白介素-2及其他生物制劑過敏;⑤合并其他腫瘤;⑥合并嚴重感染或活動性乙肝、肺結核、艾滋病或其他傳染病史;⑦正使用激素類、免疫抑制劑的自身免疫性疾病患者。⑧實驗室檢查存在嚴重異常。
1.2實驗分組
1.2.1聯合治療組治療前1天完善相關檢查,排除治療禁忌證后行外周血單核細胞采集。細胞采集后的第1天開始口服替吉奧膠囊治療,2次/d,1~14 d,3周為1個周期,具體劑量根據體表面積(body surface measurement,BSM)<1.25 m2,40 mg/次;BSM 1.25~1.50 m2,50 mg/次;BSM>1.5 m2,60 mg/次,出現病情進展或不能耐受不良反應可停藥。治療期間根據病情需要復查血常規及肝、腎功能,如出現≥Ⅲ度骨髓抑制、消化道反應,≥Ⅱ度肝、腎功能損傷則暫時停止治療,直至癥狀及血液學指標恢復至無明顯治療禁忌證。如停藥≥4周上述不良反應仍無明顯改善,則終止治療。第22天開始第2周期口服替吉奧。2周期治療結束后1個月復查。
1.2.2對照組治療前1 d完善相關檢查,治療第1天開始口服替吉奧,方法及劑量同聯合治療組。
1.3ACI治療
分外周單核細胞采集、實驗室培養、定期免疫細胞回輸3個階段。
1.3.1細胞采集采用細胞分離機為納入患者進行細胞采集。通過患者外周靜脈采集血液標本,應用封閉性與安全性更佳的全封閉式費森尤斯配套采集套件,避免交叉感染,時間約1 h。采集腫瘤患者體內的單個核細胞,液體總量為60~100 ml。采集前后及采集過程中需密切關注患者血壓、心率、呼吸等生命體征變化。
1.3.2細胞培養在符合藥品生產質量管理規范(good manufacturing practice,GMP)標準的實驗室,應用培養液和細胞因子將分離的外周血單核細胞(pe ripheral blood mononuclear cell,PBMC)進行反復刺激細胞分裂增殖。分別誘導生成DC、CIK、NK、γδT等多種免疫細胞。經過培養,各種免疫細胞大量擴增,細胞總量擴增至≥1×109個。
1.3.3細胞回輸培養完成的細胞,經檢測細胞存活率≥85%,并經厭氧菌、需氧菌、真菌培養、內毒素等檢測為陰性。細胞數量達到標準后,按照既定的回輸方案和不同的回輸時間要求分別進行回輸。見表1。
1.4療效評價
1.4.1療效標準按RECIST 1.0標準評價,客觀有效率(objective response rate,ORR)為完全緩解(complete response,CR)+部分緩解(complete response,PR),疾病控制率(disease control rate,DCR)為CR+PR+疾病穩定(stable disease,SD)+無進展生存期(progression-free survival,PFS)。
1.4.2臨床受益反應評定標準采用KPS評分、疼痛及體重指標。
1.4.3免疫指標每周期化療前及化療后檢測外周血淋巴細胞表型的變化,采用美國Becton Dickinson公司生產的流式細胞儀(FACSCalibur)檢測血CD8+、CD4+、CD3+、NK細胞的百分率,比較其治療前后的變化。
1.4.4不良反應不良反應主要為惡心、嘔吐、骨髓抑制、發熱、腹瀉、口腔炎、手足綜合征等。
1.5統計學方法
采用SPSS 20.0統計軟件進行數據處理,計量資料以均數±標準差(±s)表示,計數資料以率表示,組間臨床特征均衡性比較用方差分析和Fisher精確檢驗,組間無進展生存期比較用Kaplan-meier法,P<0.05為差異有統計學意義。
2 結果
2.1近期療效
2.1.1有效率從有效率來看,兩組無CR,考慮與晚期腫瘤負荷大有關。聯合治療組ORR為31.25%,DCR為87.5%,對照組ORR為25%,DCR為62.5%,兩組比較差異無統計學意義(P>0.05),但聯合治療組的有效率和臨床受益率明顯高于對照組。此外,兩組患者的ORR低于目前國內外研究的44.6%,考慮與兩組患者高齡、晚期腫瘤廣泛侵犯、腫瘤負荷大有關。見表2。
2.1.2PFS聯合治療組中位PFS為4.7個月(95% CI:3.916,5.484),對照組中位PFS為3.9個月(95% CI:3.116,4.684),兩組比較差異有統計學意義(P= 0.015)。
2.2臨床受益率

表1 回輸時間表
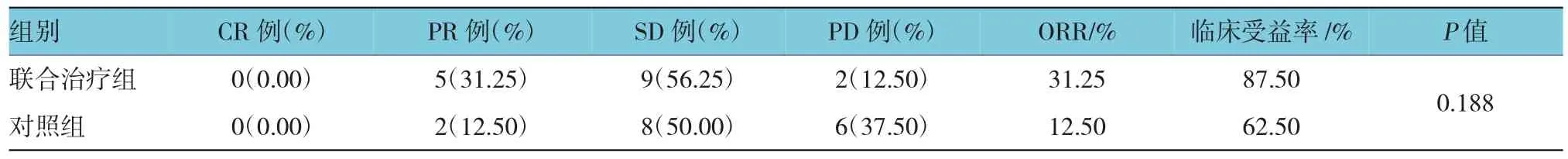
表2 兩組有效率比較
通過比較治療前后KPS評分,分析癥狀是否緩解。本研究中聯合治療組KPS評分提高7例,穩定6例,減退3例;對照組KPS評分提高4例,穩定5例,減退7例,兩組比較差異有統計學意義(P<0.05)。聯合治療組KPS評分改善較對照組更明顯,提示ACI與替吉奧聯合治療對患者體力的恢復有較大幫助。見表3。
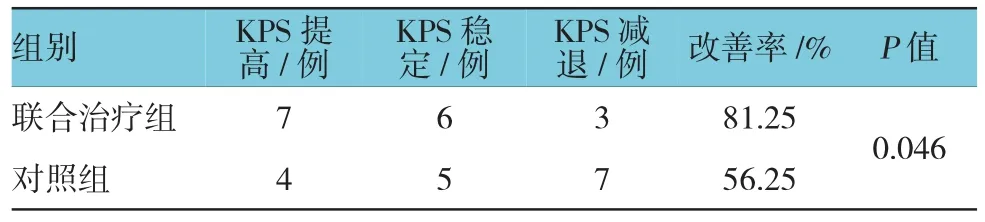
表3 兩組KPS評分比較
2.3免疫指標變化
免疫指標主要觀察T細胞亞群(CD3+、CD4+、CD8+)及NK細胞的變化。聯合治療組治療后CD3+、CD4+、NK與治療前比較,差異有統計學意義(P<0.05);CD8+有所下降,但差異無統計學意義(P>0.05)。對照組T細胞亞群較治療前略改善,但差異無統計學意義(P>0.05)。CD4+比例升高提示預后較好,而CD8+升高則是免疫受損的標志[3]。研究結果證實,患者聯合治療后免疫功能較前恢復,且免疫力明顯提高。對照組NK細胞增多較T細胞明顯,但差異無統計學意義。見表4。
2.4不良反應
兩組主要不良反應為骨髓抑制、惡心、嘔吐、腹瀉及發熱癥狀。其中聯合治療組的惡心、嘔吐及白細胞減少的發生率低于對照組,差異有統計學意義(P<0.05)。手足綜合征、腹瀉、口腔炎是替吉奧最常見的不良反應,兩組均出現該不良反應,總發生率較低。兩組無嚴重肝、腎功損傷。聯合治療組1例患者出現發熱癥狀,考慮為生物治療所致,該患者體溫最高38.6℃,經退熱對癥治療后體溫恢復正常。見表5。
表4 兩組T細胞亞群及NK細胞治療前后變化(±s)

表4 兩組T細胞亞群及NK細胞治療前后變化(±s)
組別聯合治療組CD3+ CD4+ CD8+ NK治療前 45.23±6.58 21.90±6.32 30.23±5.73 15.61±1.62治療后 68.63±5.45 42.00±4.95 25.57±4.14 30.52±3.56 t值 6.470 2.490 1.720 3.220 P值對照組治療前治療后0.0000.0000.8900.000 16.41±1.47 21.66±2.30 t值P值46.21±6.50 49.54±7.51 32.35±5.07 34.05±5.05 31.07±5.69 29.07±6.47 1.900 0.210 1.530 0.130 1.190 0.160 2.080 0.080
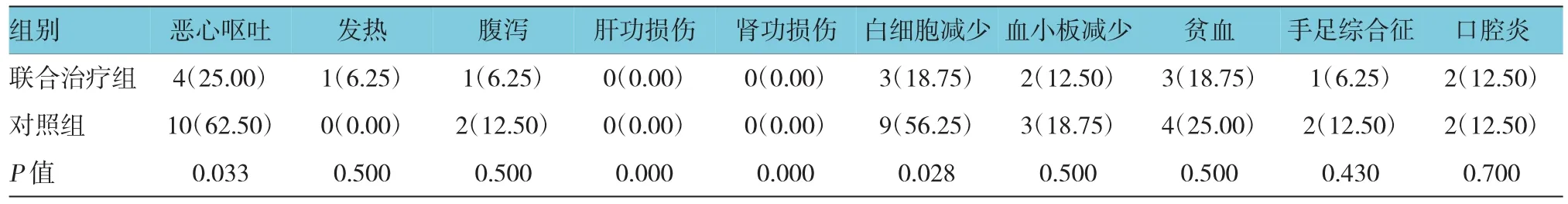
表5 兩組不良反應比較 例(%)
3 討論
目前,我國每年胃癌的新發病例即將突破40萬,是世界胃癌總發病率的2倍多。隨著食品、環境等污染加劇,胃癌的發病率仍然呈上升趨勢。由于早期臨床癥狀無特異性,多數患者就診時已為晚期。對晚期胃癌患者的治療主要為姑息性的,無明顯梗阻癥狀不推薦行姑息手術;姑息放射治療臨床效果欠佳;靶向治療主要針對少部分Her-2陽性患者且費用昂貴。因此,姑息化療是晚期胃癌治療的主要手段,但無標準化療方案。鉑類和5氟尿嘧啶(5-fluorouracil,5-FU)類是晚期胃癌最基本的藥物,但鉑類藥物胃腸道及腎毒性反應較重,使其在老年晚期胃癌患者中使用受限。5-FU類藥物是特異性細胞周期嘧啶類藥物,在細胞周期的S期發揮主要作用,其半衰期短只有6~21 min,在體內代謝快。第3代氟尿嘧啶類口服藥替吉奧膠囊(tegafur gimeracil and oteracil potassium capsules,S-1),在氟尿嘧啶類藥物抗瘤活性的基礎上,對進展期胃癌的治療高更安全。JCOG991試驗顯示,S-1的ORR和PFS優于5-FU單藥組,分別為28%和9%及4.8和2.9個月[4]。Kang等[5]研究表明,SP方案(替吉奧/順鉑)的ORR (54.0% vs 31.1%)及PFS(13個月vs 11個月)皆優于S-1單藥組,但其Ⅳ級骨髓抑制和胃腸道反應顯著增大。據統計,日本≥80%晚期胃癌患者選擇S-1化療,有效率可達44.6%。Maruo等[6]報道一項單藥S-1治療21例晚期胃癌的開放性實驗,其中1例達CR,24例達PR,總有效率為49%。一項4 177例晚期胃癌患者加入的Ⅱ期臨床研究顯示,S-1在實驗中≥Ⅲ級血液學及胃腸道毒性反應發生率只有14.9%[7]。雖然S-1的血液學毒性比優福啶及其他口服5-FU類藥物更常見,但是總發生率≤6%[8],患者的耐受性良好。Tsuburaya等[9]報道,一項多中心(23個國家)Ⅲ期臨床試驗結果表明,S-1在晚期胃癌和胃食管腺癌患者的安全性方面具有顯著優勢。因此,對身體狀況欠佳無法承受聯合化療,以及不能耐受化療副作用的老年晚期胃癌患者,選擇單藥口服S-1是唯一有效的辦法。但是,化療藥物常會損傷一定的機體免疫力,隨著目前分子生物學和細胞免疫技術飛速發展,補充DC-CIK的ACI聯合化療在臨床越來越受到關注,聯合治療既保證療效,又增強患者的自身免疫力,逐漸被人們接受并認可。
Jiang等[10]用CIK細胞治療29例中晚期胃癌患者,ORR為58.6%。蔡俊霞等[11]選取56例確診為晚期胃癌并采用DC-CIK聯合化療的患者對比28例單純化療,結果表明,聯合治療組DCR為78.6%,與對照組DCR(53.6%)比較,差異有統計學意義(P<0.05);兩組KPS評分改善率分別為82.14%和57.14%,差異有統計學意義(P<0.05)。孫明芳等[12]選取62例晚期胃癌患者應用多西他賽+順鉑+氟尿嘧啶化療聯合自體CIK比較單純化療組,結果近期療效評價顯示,兩組ORR比較差異無統計學意義,但實驗組DCR較對照組提高(83.9% vs 61.3%,P= 0.046)。實驗組患者生活質量改善明顯優于對照組。張娜等[13]通過體外研究顯示,5-氟尿嘧啶聯合DC-CIK細胞對晚期胃癌細胞的殺傷率較單獨應用5-FU或DC-CIK明顯升高,為ACI聯合化療奠定理論依據。
目前手術、靶向治療、放射治療及化療等傳統的治療方法不能有效控制晚期胃癌患者的病情進展,傳統治療模式破壞機體免疫平衡,且副反應明顯,患者生活質量受到嚴重影響,尤其對于晚期患者無法耐受上述治療,總體預后極差。所以晚期患者迫切需要一種或多種不但不會損害免疫系統,反而能增強患者自身免疫功能、提高生活質量的治療手段。過繼性細胞免疫聯合化療藥物治療模式可以起固本培元的作用,尤其對晚期腫瘤患者,不良反應少,患者耐受性好,在增強免疫功能、改善生活質量、控制腫瘤轉移及延緩腫瘤進展等方面療效確切,為腫瘤患者帶來新的希望。由于其高效、低度、安全性高,有廣闊的應用前景。本實驗結論為ACI結合替吉奧治療能明顯改善老年晚期胃癌患者中位無疾病進展時間,具有安全性高、不良反應小、耐受性好等特點。臨床上,多種過繼性細胞免疫聯合化療受到晚期惡性腫瘤患者的認可。
目前,多種過繼性細胞免疫聯合化療治療晚期胃癌患者多為小樣本的臨床研究,且具體的培養技術和回輸途徑還需要更成熟的研究,以后DC-CIK及其他多種過繼性細胞免疫聯合化療還需要大量的研究,期待在臨床應用中更加成熟,為廣大患者提供福音。過繼性細胞免疫治療方案價格昂貴,對臨床推廣造成一定困難,但隨著社會的進步,人們經濟水平的提高及醫療社會保障體系的進一步完善,越來越多的患者有條件應用該先進的醫療技術。
參考文獻:
[1] Chen Y, Wang XJ, Lin RB, et al. Efficacy of intraperitoneal and intravenous chemotherapy for advanced gastric cancer with peritoneal metastasis[J]. Tumori, 2014, 100(5): 180-188.
[2] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. The Lancet Oncology, 2012, 13(3): 239-246.
[3] Li Pira G, Ivaldi F, Starc N, et al. A registry of HLA-typed donors for production of virus-specific CD4 and CD8 T lympho cytes for adoptive reconstitution of immune-compromised patients[J]. Transfusion, 2014, 54(12): 3145-3154.
[4] Koizumi W, Kim YH, Fujii M, et al. Addition of docetaxel to S-1 without platinum prolongs survival of patients with advanced gastric cancer: a randomized study (START)[J]. Journal of Cancer Research and Clinical Oncology, 2014, 140(2): 319-328.
[5] Kang BW, Kim JG, Kwon OK, et al. Non-platinum-based chemotherapy for treatment of advanced gastric cancer: 5-fluorouracil, taxanes, and irinotecan[J]. World Journal of Gastroenterology, 2014, 20(18): 5396-5402.
[6] Maruo H, Suzuki K, Ishikawa S, et al. Study of S-1 and oxaliplatin(SOX) plus bevacizumab as first-line therapy in patients with unresectable colorectal cancer [J]. Gan to Kagaku Ryoho Cancer Chemotherapy, 2014, 41(13): 2583-2586.
[7] Takahashi T, Saikawa Y, Fukuda K, et al. Phase I study of S-1 plus fractional cisplatin as adjuvant chemotherapy for advanced gastric cancer in an outpatient setting (KOGC-03)[J]. Anticancer Research, 2015, 35(1): 467-471.
[8] Bittoni A, Scartozzi M, Giampieri R, et al. Clinical evidence for three distinct gastric cancer subtypes: time for a new approach[J]. PLoS One, 2013, 8(11): DOI: 10.1371/journal.pone.0078544.
[9] Tsuburaya A, Morita S, Kodera Y, et al. A randomized phaseⅡtrial to elucidate the efficacy of capecitabine plus cisplatin (XP) and S-1 plus cisplatin(SP) as a first-line treatment for ad-vanced gastric cancer: XP ascertainment vs. SP randomized PⅡtrial (XParTSⅡ)[J]. BMC Cancer, 2012, (12): 307-401.
[10] Jiang J, Wu C, Lu B. Cytokine-induced killer cells promote antitumor immunity[J]. Journal of Translational Medicine, 2013, 11: 83-86.
[11]蔡俊霞,吳錦昌,王彬,等. DC-CIK聯合化療治療晚期胃癌的近期療效觀察[J].南京醫科大學學報(自然科學版), 2014, 34(1): 36-40.
[12]孫明芳,丁震宇,劉兆喆,等.化療聯合自體CIK細胞治療晚期胃癌的隨機對照研究[J].現代腫瘤醫學, 2013, 21(7): 1537-1540.
[13]張娜,杜昱蕾,李晶,等. 5-氟尿嘧啶聯合DC-CIK細胞對胃癌細胞殺傷作用的體外研究[J].白求恩醫學雜志, 2014, 12(1): 3-5.
(童穎丹編輯)
Multicellular adoptive immunotherapy combined with S-1 in the elderly patients with advanced gastric cancer
Xiao-lei Zhang, Wei Wei, Chun-mei Yang, Yue-fen Liu, Hai-sheng Guo, Xun-guo Wang
(Department of Oncology, Dongying Peopleˊs Hospital, Dongying, Shandong 257000, China)
Abstract:Objective To explore the recent treatment effect and toxicity of multicellular adoptive immunotherapy combined with S-1 in the elderly advanced gastric cancer patients, and compare the difference in the therapeutic effect between multicellular adoptive immunotherapy combined with S-1 and S-1 used alone. Methods Thirty-two elderly patients who were diagnosed as advanced gastric cancer in our hospital were selected. The patients were randomly divided into two groups. The combined treatment group used multicellular adoptive immunotherapy combined with S-1, while the control group used S-1 alone. The clinical therapeutic effect was observed through imaging and laboratory results. The median progression-free survival (PFS), the patientsˊquality of life, the toxicity and immunity were observed. Results The median progressionfree survival in the combined treatment group and the control group was 4.7 months and 3.9 months respectively, the difference was statistically significant (P<0.05). Multicellular adoptive immunotherapy in combination with S -1 therapy significantly improved the patientsˊquality of life, especially for insomnia, fatigue and stomachic effect. Comaring the adverse reactions of both groups, the combined treatment group only had additional fever with lower incidence. The combined treatment had high safety compared to S-1 alone. Conclusions Compared with the therapy of S-1 alone, multicellular adoptive immunotherapy combined with S-1 has significant efficacy and low toxicity for the treatment of advanced gastric cancer in elderlybook=121,ebook=127patients, can prolong their progression-free survival, and improve the patientsˊquality of life and immunity.
Keywords:adoptive cellular immunotherapy; S-1 capsule; advanced gastric cancer; quality of life; immunity
[通信作者]王旬果,E-mail:wangxunguocn@126.com;Tel:13864768818
收稿日期:2015-04-24
文章編號:1005-8982(2016)03-0120-06
DOI:10.3969/j.issn.1005-8982.2016.03.025
中圖分類號:R735.2
文獻標識碼:B

